
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
аЛкены
151
|
|
|
|
H |
121,7° |
|
|
|
H |
H |
|
|
|
H |
|||
|
|
|
|
|
|
|
|
|
C |
C |
|||||||
|
|
|
0,107 íìC |
C |
116,6° |
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
0,134 íì |
|
|
H |
|
|
|
H |
|||||
|
|
|
|
|
|
||||||||||||
à |
|
|
|
|
|
á |
|
|
|
|
â |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π-связь |
|
|
|
|
|
|
|
|
|
π-связь |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
Í |
Í |
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
||
Ñ |
Ñ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Í |
Í |
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
σ-связь |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ã |
|
|
|
|
|
|
|
|
|
|
ä |
|
σ-связь |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Рис. 10.1. Строение молекулы этилена:
а — шаростержневая модель; б — геометрия молекулы; в — σ-связи; г — π-связь; д — атомно-орбитальная модель
агентом (электрофильной частицей) электронов π-связи, а поэтому их называют
реакциями электрофильного присоединения (АЕ ). |
|
||||
H |
|
Кроме того, двойная связь влияет на реакционную спо- |
|||
|
собность связей С—Н у соседнего с ней sp3-гибридизован- |
||||
|
|
|
|
||
H—C |
|
CH—CH2 |
ного атома углерода. |
|
|
|
|
||||
|
|
|
|
Благодаря сверхсопряжению (σ,π-сопряжение) |
атомы |
H |
|
||||
|
водорода, расположенные у α-углеродного атома |
по от- |
|||
|
|
|
|
||
ношению к двойной связи, приобретают подвижность и способность вступать в реакции замещения (SR), которые протекают значительно легче, чем у алканов.
Для алкенов характерны также реакции окисления, восстановления и полимеризации.
10.5.1. реакЦии ЭЛекТроФиЛьного ПрисоединениЯ (AE )
За счет наличия в своей структуре π-связи алкены проявляют нуклеофильные (электронодонорные) свойства и вступают в реакции с электрофильными реагентами, такими, как галогены, галогеноводороды, серная кислота, вода в присутствии минеральных кислот и др. Эти реакции протекают по механизму электрофильного присоединения (АЕ ).
Механизм включает две последовательные стадии:
Стадия I
δ+ δ– |
|
|
|
|
|
|
+ |
|||||||||
C—C + X |
|
Y |
|
|
|
|
|
C—C |
|
|
|
|
C—C + Y– |
|||
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
δ+ |
δ– |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
X |
|||||
|
|
|
|
|
|
|
|
X |
|
Y |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
π-комплекс |
карбокатион |
|||||||

Глава 10
152
Стадия II
|
|
|
|
|
|
Y |
|
|
+ |
|
|
|
|
||
|
|
C—C + Y– |
|
C—C |
|||
|
|
||||||
|
|
|
|
|
|
|
|
|
|
X |
|
X |
|||
На стадии I электрофильная частица или молекула электрофильного реа- |
|||||||
δ+ |
|
δ– |
|
|
|
|
|
гента Х |
|
Y в результате электростатического взаимодействия с электронным |
|||||
|
|||||||
облаком π-связи образует с молекулой алкена так называемый π-комплекс. Затем образуется ковалентная связь между электрофильной частицей X+ и одним из атомов углерода двойной связи, при этом π-комплекс превращается в карбокатион.
На стадии II карбокатион взаимодействует с освободившейся из электрофильного реагента нуклеофильной частицей Y– и образуется конечный продукт присоединения.
Присоединение галогенов (галогенирование). Алкены довольно легко присо-
единяют по двойной связи хлор и бром, труднее — йод. В результате взаимодействия образуются дигалогенопроизводные алканов, содержащие атомы галогена у соседних атомов углерода (вицинальные дигалогенопроизводные углеводородов):
H2С—СH2 + Br2  H2С—СН2
H2С—СН2
Br Br
1,2-дибромэтан
Многочисленными исследованиями установлено, что механизм этой реакции включает электрофильную атаку молекулы галогена на π-электроны двойной связи.
Под влиянием π-электронного облака двойной связи молекула галогена поля-
δ+ δ–
ризуется (Вr Вr) и приобретает способность выступать в качестве электрофильного реагента.
Вr) и приобретает способность выступать в качестве электрофильного реагента.
На стадии I реакции атом галогена, несущий частичный положительный заряд, вступает во взаимодействие с π-электронами двойной связи, в результате чего образуется π-комплекс:
H |
|
H |
δ+ |
|
δ– |
|
|
|
H |
|
|
|
H |
|
— |
|
|
|
|
|
|
|
— |
|
|||
C |
C |
|
+ Вr |
|
Вr |
|
|
|
|
C |
|
|
C |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||
H |
|
H |
|
|
|
|
|
|
H |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Вrδ+ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вrδ– |
||
этилен |
|
|
|
|
|
|
|
|
π-комплекс |
||||
Затем в π-комплексе постепенно происходит гетероциклический разрыв связи между атомами галогена с образованием продукта присоединения, строение которого может быть представлено равновесием между ионом карбония и циклическим ионом галогенония:
аЛкены
153
H |
|
H |
|
|
|
H |
+ H |
|
|
|
H |
H |
|
C—C |
|
|
|
Вr– + H |
C—C |
|
|
|
|
C—C |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
H |
|
H |
|
|
|
Вr |
H |
|
|
|
H |
Вr H |
|
Вrδ+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Вrδ– |
|
|
|
|
|
|
|
|
|
|
|
|
π-комплекс |
|
|
|
ион карбония |
циклический |
||||||
|
|
|
|
|
|
|
|
|
|
|
ион бромония |
|
Положение равновесия в большинстве случаев смещено в сторону циклического иона галогенония. Но если двойная связь алкена сопряжена с бензольным ядром, способным делокализовать положительный заряд, продукт присоединения существует преимущественно в виде иона карбония.
На стадии II реакции циклический ион галогенония подвергается атаке отрицательным ионом галогена по атому углерода со стороны, противоположной расположению уже имеющегося галогена, с образованием продукта транс-при- соединения:
H |
H |
|
H |
|
Вr |
C—C |
+ Вr– |
|
H |
C—C |
H |
|
|||||
+ |
|
|
|
|
|
H Вr |
H |
|
Вr |
|
H |
циклический |
|
1,2-дибромэтан |
|||
ион бромония |
|
|
|
|
|
Следовательно, присоединение галогенов к алкенам происходит, как правило, стереоселективно, то есть пространственно избирательно.
В целом механизм реакции галогенирования алкенов можно представить следу-
ющим образом:
|
δ+ δ– |
|
|
|
|
|
|
|
|
C—C + Х– |
|
|
|
C—C |
X |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
C—C + X |
|
X |
|
|
|
C—C |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
Xδ+ |
|
|
|
X |
|
X |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Xδ– |
|
|
|
|
|
|
|
|
|
|
|
алкен |
галоген |
|
|
|
π-комплекс |
циклический |
|
|
вицинальный |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
ион галогенония |
дигалогеналкан |
|||||
Эта реакция широко используется в фармацевтическом анализе для качественного и количественного определения соединений, содержащих двойную углерод-угле- родную связь.
Присоединение галогеноводородов (гидрогалогенирование). Алкены присоеди-
няют по месту разрыва двойной связи галогеноводороды, образуя галогеналканы:
H2C—CH2 + HBr  CH3—CH2—Br
CH3—CH2—Br
бромэтан
Реакция с НI, НВг, НF протекает при комнатной температуре, взаимодействие с НСl требует нагревания.
Присоединение галогеноводородов к алкенам, как и присоединение галогенов, происходит по гетеролитическому электрофильному механизму. Внача-
δ+ |
|
δ– |
ле электронодефицитный атом водорода молекулы галогеноводорода (Н |
|
X ) |
|


аЛкены
155
и σ,π-сопряжения со стороны алкильных групп π-электронная плотность двойной связи смещена к более гидрогенизованному ненасыщенному атому углерода. Это определяет наиболее вероятное место присоединения протона:
|
|
|
|
|
Br |
|
|
|
|
δ– δ+ δ– |
|
|
|
СH3 |
|
C—CH2 + H—Br |
|
CH3—C—CH3 |
||
|
|
|||||
|
|
|
|
|
|
|
|
|
СH3 |
|
СH3 |
||
|
|
|
|
2-бром-2-метилпропан |
||
Влияние динамического фактора обусловлено тем, что из двух возможных вариантов присоединения протона к несимметричному алкену преимущественно реализуется тот, при котором в качестве промежуточного продукта присоединения образуется более устойчивый карбокатион. Более устойчивому карбокатиону отвечает переходное состояние с меньшей энергией, а это обеспечивает бóльшую скорость реакции. Делокализация положительного заряда, а следовательно, и устойчивость карбокатиона возрастают с увеличением числа алкильных групп, поэтому третичные карбокатионы устойчивее вторичных, а те, в свою очередь, устойчивее первичных (см. с. 122). Поэтому не трудно заметить, что присоединение НВr к 2-метилпропену будет протекать преимущественно по направлению а:
|
|
|
|
|
|
|
Br |
|
|
|
а |
+ |
|
Br– |
|
|
|
|
|
|
||||||
|
|
|
СH3—C—CH3 |
|
|
|
CH3—C—CH3 |
|
|
|
|
|
|
|
|||
СH3—C—CH2 |
H+ |
|
СH3 |
|
|
|
СH3 |
|
|
|
третичный карбокатион |
|
|
|
2-бром-2-метилпропан |
||
СH3 |
|
б |
+ |
|
Br– |
|
|
|
2-метилпропен |
|
|
СH3—CH—CH2 |
|
|
|
CH3—CH—CH2—Br |
|
|
|
|
|
|
||||
|
|
|
СH3 |
|
|
|
СH3 |
|
|
|
|
первичный карбокатион |
|
|
|
1-бром-2-метилпропан |
|
Следует отметить, что правило Марковникова соблюдается не всегда. Так, в присутствии пероксидов присоединение бромоводорода к несимметричным алкенам происходит по свободнорадикальному механизму с ориентацией против правила Марковникова:
H2O2 + 2HBr  2Br· + 2H2O
2Br· + 2H2O
|
|
|
а |
|
· |
|
|
HBr |
|
|
|
|
|
|
· |
|
СH |
—CH—CH |
Br |
|
CH —CH |
—CH Br + Br· |
|||
|
|
|
|
|||||||||
СH3—CH—CH2 |
Br |
|
3 |
2 |
|
|
|
3 |
2 |
2 |
|
|
|
|
б |
|
· |
|
|
HBr |
|
|
|
|
|
|
|
|
|
СH |
—CHBr—CH |
2 |
|
CH —CHBr—CH |
+ Br· |
|||
|
|
|
|
|
||||||||
|
|
|
|
3 |
|
|
|
3 |
|
3 |
|
|
Возникший на первой стадии реакции радикал брома присоединяется по месту двойной связи алкена к более гидрогенизованному атому углерода (направление а), так как при этом образуется более устойчивый радикал. Последний атакует новую молекулу НВr с образованием конечного продукта присоединения.
Присоединение концентрированной серной кислоты. Присоединение серной кислоты к алкенам протекает по ионному электрофильному механизму аналогич-



Глава 10
158
Концентрированные растворы калия перманганата окисляют алкены с разрывом двойной связи. В зависимости от структуры алкена в качестве продуктов окисления образуются кетоны и альдегиды, причем последние окисляются далее до карбоновых кислот:
СH3 |
|
KMnO4 |
СH3 |
|
O |
|
СH3 |
C—CH—СH3 |
|
СH3 |
C—O + |
C—CH3 |
|
|
||||||
|
|
|
H |
|||
|
2-метил-2-бутен |
|
ацетон |
|
уксусный альдегид |
|
|
|
|
|
|
|
[O] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3COOH |
|
|
|
|
|
|
уксусная кислота |
|
Озонирование алкенов. Алкены легко окисляются озоном. Реакция озонирования протекает по сложному механизму с образованием продуктов присоединения озона по месту разрыва двойной связи, называемых озонидами:
|
|
O |
|
O |
|
|
|
||
СH3—CH—CH2 + O3 |
|
CH3—CH СH2 |
||
|
||||
|
|
|
О |
|
пропен |
озонид |
|
||
Многие озониды взрывоопасны. При обработке цинком в уксусной кислоте озониды разлагаются, образуя карбонильные соединения (2 моль альдегида или 2 моль кетона или же 1 моль альдегида и 1 моль кетона в зависимости от структуры алкена):
O |
|
O |
Zn + CH3СOOH |
O |
O |
|
|
||||||
|
|
|
||||
CH3—CH СH2 |
CH3—С |
+ C—H + H2O |
||||
|
||||||
|
О |
|
H |
H |
||
озонид |
|
|
уксусный |
формальдегид |
||
|
|
|
|
альдегид |
|
|
Полученные карбонильные соединения могут быть идентифицированы, что позволяет использовать реакцию озонирования для определения положения двойной связи.
Поскольку озон реагирует с алкенами количественно (1 моль озона расходу-
ется на 1 моль алкена), эта реакция может также применяться для установления числа двойных углерод-углеродных связей в молекуле.
окисление алкенов кислородом и пероксикислотами. Кислород воздуха в при-
сутствии серебряного катализатора окисляет алкены при нагревании с образованием эпоксидов:
2H2C—CH2 + O2 |
Ag; 300 °C |
2H2C—CH2 |
|
|
O |
этилен |
|
этиленоксид; |
|
|
эпоксиэтан |
Реакция применяется в промышленности для получения этиленоксида (оксирана).
Аналогично алкены окисляются пероксикислотами (реакция Прилежаева). Так, при обработке алкенов пероксибензойной кислотой образуются эпоксиды:
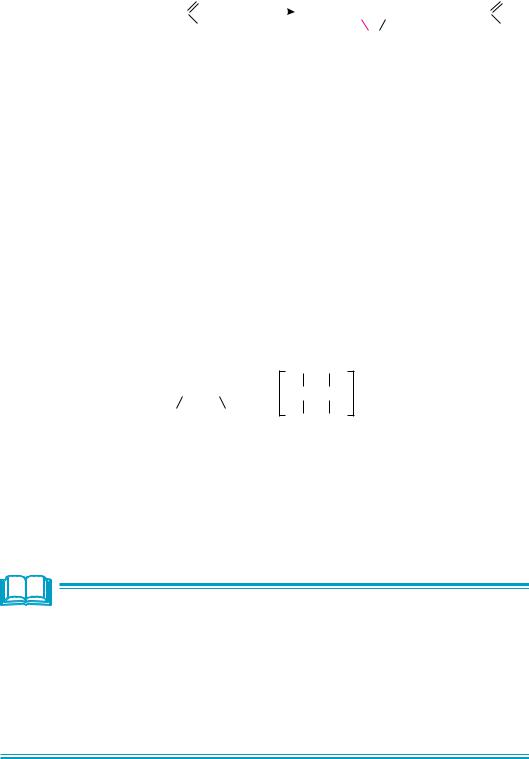
аЛкены |
|
|
|
|
159 |
|
|
|
|
|
|
|
+ C6H5—C O |
|
|
|
|
CH3—CH—СH2 |
|
CH3—CH—СH2 |
+ C6H5—C O |
||
|
|||||
|
O—O—H |
|
O |
|
OH |
|
|
|
|
|
|
пропен |
пероксибензойная |
пропиленоксид |
бензойная |
||
|
кислота |
|
|
кислота |
|
Реакция изучена в 1909 году российским химиком-органиком Н. А. Прилежаевым.
10.5.3. ПоЛимеризаЦиЯ аЛкеноВ
Полимеризацией называют процесс соединения друг с другом молекул низкомоле кулярных веществ (мономеров) с образованием высокомолекулярных соединений (полимеров).
В реакцию полимеризации могут вступать молекулы одного и того же мономера, а также молекулы двух и более разных мономеров.
Полимер, состоящий из одинаковых мономеров, называется гомополимером, а полимер, в состав которого входят два и более разных мономеров,— сополи-
мером.
Реакция получения сополимеров называется реакцией сополимеризации. Полимеризация алкенов представляет собой последовательное соединение
молекул алкена друг с другом вследствие разрыва двойной связи. В общем виде полимеризацию алкенов можно представить следующей схемой:
n 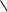 С—С
С—С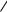
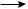 —С—С—
—С—С—
n
мономер |
полимер |
Число повторяющихся мономерных звеньев п называют степенью полимери-
зации.
В зависимости от степени полимеризации из одного и того же мономера можно получить вещества с разными свойствами. Процесс полимеризации осуществляется в присутствии катализаторов (инициаторов) и включает три основные стадии: зарождение цепи (инициирование), рост цепи, обрыв цепи.
В зависимости от структуры исходного мономера, природы инициатора и условий реакции (температура, давление) полимеризация алкенов может про-
синтетические полимеры и защита окружающей среды
Полимерные материалы широко используются в современной жизни. Общий ежегодный объем их производства достигает десятков миллионов тонн! Ученые, создав сверхпрочные и устойчивые полимеры, в настоящее время столкнулись с глобальной экологической проблемой их утилизации. Тонны отработанной тары, упаковочного материала, изготовленных на основе полимеров, не подвергаются разрушению в природе. Данный факт объясняется отсутствием у бактерий и грибов соответствующих ферментов, расщепляющих синтетические полимеры. Создание биоразлагаемых полимеров (см. в подразд. 27.2.2) на основе безотходных и безопасных для окружающей среды технологий является одной из важнейших задач, стоящих перед химической наукой.

Глава 10
160
исходить по радикальному и ионному (катионному) механизмам. Особым типом полимеризации является полимеризация в присутствии металлорганических со-
единений, получившая название «координационная полимеризация».
свободнорадикальная полимеризация. По радикальному механизму алкены
полимеризуются в присутствии пероксидных соединений, таких, как ацетила пер- O O O O
оксид CH3—C—O—O—C—CH3, бензоила пероксид C6H5—C—O—O—C—C6H5 и других, способных при высоком давлении и температуре распадаться на свобод-
ные радикалы. Эти свободные радикалы затем присоединяются к алкену с образованием новых радикалов. Далее происходит последовательное присоединение других молекул алкена. Растущая активированная цепь при радикальной полимеризации представляет собой свободный радикал. Обрыв цепи осуществляется чаще всего путем димеризации свободных радикалов. Механизм радикальной полимеризации этилена в присутствии ацетила пероксида можно представить следующим образом:
CH —C—O—O—C—CH |
|
p; t |
2CH |
—C—O· |
|||||
|
|
||||||||
3 |
|
|
|
|
3 |
|
|
3 |
|
O |
O |
|
|
|
O |
||||
H2C—CH2 + CH3—C—O· |
|
CH3—C—O—CH2—CH2· |
|
(зарождение цепи) |
|||||
|
|||||||||
O |
|
O |
|
|
|
|
|
||
СH3—COO—CH2—CH2· H2C=CH2
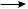 CH3—COO—CH2—CH2—CH2—CH2· (n–1)H2C=CH2
CH3—COO—CH2—CH2—CH2—CH2· (n–1)H2C=CH2 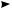
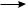 CH3—COO—( CH2—CH2—)—n CH2—CH2· (рост цепи)
CH3—COO—( CH2—CH2—)—n CH2—CH2· (рост цепи)
CH3—COO—( CH2—CH2—)n CH2—CH2· + ·CH2—CH2—( CH2—CH2—)—n COO—CH3 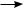
CH3COO—( CH2—CH2—)—n CH2—CH2
(обрыв цепи)
CH3COO—( CH2—CH2—)—n CH2—CH2
Таким способом в промышленности получают полиэтилен и полипропилен высокого давления.
катионная полимеризация. Катионная полимеризация алкенов инициируется протонными кислотами или кислотами Льюиса (АlС13, BF3 и др.). Реакционным центром растущей полимерной цепи является карбокатион. По ионному катионному механизму наиболее легко полимеризуются несимметрично построенные
алкены общей формулы RR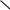 С—СH2, из которых образуются относительно ста-
С—СH2, из которых образуются относительно ста-
бильные промежуточные карбокатионы. В промышленности этот метод применяют для полимеризации изобутилена:

 CH
CH HOCl + HCl
HOCl + HCl
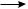 CH
CH