аЛкадиены
171
Молекулярная масса натурального каучука составляет в среднем 100 000—150 000.
В природе встречается также полиизопрен с транс-конфигурацией изопреновых звеньев, получивший название «гутта-
перча»:
СH3 СH3
|
··· |
С |
С |
СH2 |
СH2 |
С |
СH2 |
··· |
|
|
|
|
СH2 |
|
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
гуттаперча; |
|
|
|
|
|
|
|
|
|
|
|
транс-полиизопрен |
|
|
|
|
|
Гуттаперча, |
в отличие |
от натурального |
курт аЛьдер |
|
|
(1902—1958) |
|
|
каучука, не обладает эластичностью. |
|
|
|
|
Немецкий химик-органик. Ос- |
|
синтетический каучук. Большая потреб- |
|
новная область научных исследова- |
|
ность промышленности в каучуке и отсут- |
ний — органический синтез. Изучал |
|
ствие во многих странах природного сырья |
(1926) азодикарбоновый |
эфир под |
|
обусловили разработку синтетических спо- |
|
руководством Дильса. Данная работа |
|
собов его получения. |
|
|
|
|
|
привела к открытию ими (1928) одной |
|
Впервые |
в |
промышленном |
масштабе |
из важнейших реакций органической |
|
синтетический каучук получен в 1932 году |
химии — диеновый синтез. Установил |
|
возможность осуществления реакции, |
|
в бывшем СССР полимеризацией 1,3-бута- |
|
обратной диеновому синтезу (ретро- |
|
диена в присутствии металлического натрия |
диеновый распад). Открыл ен-синтез. |
|
(способ С. В. Лебедева). Полученный полимер |
Лауреат Нобелевской |
премии |
|
содержит примерно 70 % звеньев 1,2-присо- |
(1950, совместно с Дильсом). |
|
единения и 30 % звеньев 1,4-присоедине- |
|
|
|
ния. |
Из-за малого содержания фрагментов |
|
|
1,4-присоединения такой каучук уступает по своей эластичности натуральному. В последующие годы полимеризацией 1,3-бутадиена над металлорганическими катализаторами получен линейный, стереорегулярный бутадиеновый каучук с цис-конфигурацией мономерных звеньев, не уступающий по свойствам натуральному:
···—CH2 |
— |
CH2—CH2 |
CH2—CH2 |
|
— |
CH2—··· |
|
|
— |
|
С |
|
|
С C |
С |
C |
|
|
C |
H |
|
H H |
H |
H |
|
|
H |
бутадиеновый каучук; цис-полибутадиен
В настоящее время промышленность производит много видов синтетических каучуков с различными свойствами. Так, полимеризацией изопрена в присутствии комплексных катализаторов Циглера—Натты получают изопреновый каучук стереорегулярного строения, полимеризацией 2-хлор-1,3-бутадиена (хлоропрена) Н2С—CCl—СН—СН2 — хлоропреновый каучук. Получены также сополимеры 1,3-бутадиена со стиролом C6H5—CH—CH2 (бутадиен-стирольный каучук), с акрилонитрилом СН2—СН—СN (бутадиен-нитрильный каучук) и др.
Вулканизация каучука. Для придания каучуку повышенной прочности, эластичности, устойчивости к изменениям температуры и действию химических ре-
Глава 11
172
агентов его подвергают вулканизации. Процесс вулканизации состоит в обработке каучука серой при нагревании. В результате вулканизации происходит поперечное сшивание линейных молекул полимера за счет образования серных мостиков. При этом каучук превращается в эластичную массу, называемую резиной.
11.3.4. иденТиФикаЦиЯ соПрЯЖенных диеноВ
Аналогично алкенам наличие двойных связей в сопряженных диенах может быть доказано обычными реакциями на кратную связь (реакция с бромом и реакция с калия перманганатом). Если проба на кратную связь положительна, то идентификацию 1,3-диенов проводят по образованию кристаллических продуктов присоединения в реакции диенового синтеза с ангидридом малеиновой кислоты при нагревании:
|
|
|
СH2 |
|
|
С |
O |
|
HC |
HC |
|
|
+ |
O |
|
HC |
|
|
|
|
|
|
СH2 |
HC |
|
С |
O |
1,3-бутадиен |
малеиновый ангидрид |
цис-1,2,3,6-тетрагидрофталевый |
|
|
ангидрид |
В ИК-спектрах сопряженных диенов, по сравнению с алкенами, характерно смещение полосы валентных колебаний С—С-связи в длинноволновую область (1600—1620 см–1) и увеличение ее интенсивности. В УФ-спектрах сопряженных диенов наблюдается интенсивное поглощение в области 200—220 см–1. ПМР-спектры диенов не имеют существенных отличий от спектров алкенов.
11.3.5. оТдеЛьные ПредсТаВиТеЛи. Применение
1,3-Бутадиен (дивинил) н2с—сн—сн—сн2. Бесцветный газ с характерным запахом, при 20 °С существует преимущественно в виде транс-изомера. Хорошо растворяется в эфире и бензоле, нерастворим в воде. При температуре 420 °С самовоспламеняется. Применяется для получения синтетических каучуков, пла-
стиков, в синтезе алициклических соединений.
сн3
2-метил-1,3-бутадиен (изопрен) н2с—сн—с—сн2 . Бесцветная жидкость
(т. кип. 34,1 °С). Не растворяется в воде, хорошо растворим в большинстве углеводородных растворителей. В высоких концентрациях обладает наркотическим действием, в малых — раздражает слизистые оболочки дыхательных путей и глаз. Изопрен является основой многих природных соединений, таких как натуральный каучук, терпены, стероиды. Широко применяется в промышленности для получения изопренового каучука, душистых веществ, лекарственных средств.
Глава 12
АЛКИНЫ
Алкинами называют алифатические углеводороды, содержащие тройную угле родуглеродную связь.
Общая формула алкинов СnН2n–2.
Простейшим представителем этого ряда соединений является ацетилен С2Н2,
поэтому часто алкины называют ацетиленовыми углеводородами.
Ацетилен открыт Э. Деви (1836). Впервые синтезирован М. Бертло из угля и водорода (1862).
Таблица 12.1
Представители гомологического ряда алкинов
|
Соединение |
Название по номенклатуре |
|
|
|
|
систематической |
рациональной |
|
|
|
|
|
|
|
|
|
HC—CH |
Этин |
Ацетилен |
|
HC—C—CH3 |
Пропин |
Метилацетилен |
|
|
|
|
|
|
HC—C—CH2—CH3 |
1-Бутин |
Этилацетилен |
|
CH3—C—C—CH3 |
2-Бутин |
Диметилацетилен |
|
HC—C— |
CH—CH3 |
3-Метил-1-бутин |
Изопропилацетилен |
|
CH3 |
|
|
|
|
|
|
|
|
12.1. НОМЕНКЛАТУРА. ИЗОМЕРИЯ
По номенклатуре IUPAC названия алкинов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ин с указанием положения тройной связи в цепи углеродных атомов (см. табл. 12.1). Нумерацию главной углеродной цепи начинают с того конца, к которому ближе расположена тройная связь:
|
|
5 |
4 |
3 |
2 |
1 |
HC—CH |
СH3—C—CH |
СH3—СH—C—C—CH3 |
|
|
|
СH3 |
|
|
|
ýòèí |
ïðîïèí |
|
4-метил-2-ïåíòèí |
|
Наряду с номенклатурой IUPAС для простейших углеводородов часто применяют рациональные названия. Согласно рациональной номенклатуре, ацетиленовые углеводороды рассматривают как производные ацетилена, в молекуле которого атомы водорода замещены на углеводородные радикалы:
HC—C—CH3 |
HC—C—CH2—CH3 |
CH3—C—C—CH3 |
метилацетилен |
ýòèëацетилен |
диметилацетилен |
Глава 12
174
Для первого представителя гомологического ряда алкинов сохранилось тривиальное название «ацетилен».
Названия углеводородных остатков (радикалов) алкинов образуют путем добавления к названию углеводорода суффикса -ил:
HC—C— |
3 |
2 |
1 |
3 |
2 |
1 |
СH3—C—C— |
HC—C—СH2— |
ýòèíèë |
|
1-пропинèë |
|
2-пропинèë; |
|
|
|
|
|
пропаргèë |
Для алкинов характерна структурная изомерия, которая обусловлена различной структурой углеродной цепи (изомерия цепи) и различным положением трой-
ной связи (изомерия положения):
|
|
изомеры цепи |
|
|
|
|
|
|
|
|
|
|
|
|
|
HC—C—CH2—CH2—CH3 |
HC—C—CH—CH3 |
СH3—C—C—СH2—СH3 |
|
|
|
|
СH3 |
|
1-ïåíòèí |
3-метил-1-áóòèí |
2-ïåíòèí |
изомеры положения
12.2. СПОСОБЫ ПОЛУЧЕНИЯ
Алкины наиболее часто получают дегидрогалогенированием дигалогенозамещенных алканов и алкилированием ацетилена. Для получения ацетилена существует ряд специфических способов.
дегидрогалогенирование дигалогеналканов и галогеналкенов. Геминальные ди-
галогенозамещенные алканов (атомы галогена расположены возле одного атома углерода) и вицинальные дигалогеналканы (атомы галогена расположены возле двух соседних атомов углерода) в присутствии спиртового раствора натрия или калия гидроксида при нагревании отщепляют галогеноводород с образованием алкинов:
HBr
CH3—C—CH |
2NaOH(C2H5OH); t |
CH3—C—CH + 2NaBr + 2H2O |
|
|
|
|
|
|
H |
Br |
|
|
1,1-дибромпропан |
|
ïðîïиí |
CH3—CH— |
CH2 |
2NaOH(C2H5OH); t |
CH3—C—CH + 2NaBr + 2H2O |
|
Br |
Br |
|
|
1,2-дибромпропан |
|
ïðîïиí |
В аналогичных условиях образуют алкины также галогеналкены, содержащие атом галогена у атома углерода с двойной связью:
|
аЛкины |
|
|
175 |
|
|
|
|
|
|
NaOH(C2H5OH); t |
|
|
CH3—C—CH2 |
CH3—C—CH + NaCl + H2O |
|
|
|
Cl |
|
|
|
|
2-хлорпропен |
|
ïðîïиí |
алкилирование ацетилена. Алкилированием называют процесс введения алкильной группы в молекулу органического соединения. Данный способ позволяет получить из ацетилена его гомологи. С этой целью вначале при действии на ацетилен натрия амидом NaNH2 в жидком аммиаке или алкилмагнийгалогенидами (реактивами Гриньяра) в эфире получают натрия ацетиленид или алкинилмагнийгалогенид соответственно, которые затем обрабатывают галогеналканом:
NaNH2 |
|
HC—CNa |
C2H5—Br |
HC—C—С2H5 |
–NH |
3 |
|
–NaBr |
|
|
натрия |
|
|
1-бутин |
|
|
|
|
|
|
|
ацетиленид |
|
|
|
CH3MgI |
|
HC—CMgI |
CH3—I |
HC—C—СH3 |
–CH |
|
|
–MgI |
2 |
4 |
|
этинилмагний- |
|
пропин |
|
|
|
|
|
йîäèä
Получение ацетилена из метана (промышленный метод). При нагревании метана до 1500 °С образуется ацетилен:
Получение ацетилена из кальция карбида (промышленный метод). При взаимо-
действии кальция карбида с водой образуется ацетилен:
CaC2 + 2H2O 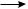 HC—CH
HC—CH + Ca(OH)2
+ Ca(OH)2
Этим способом получают основное количество ацетилена, используемого для сварочных работ.
12.3. ФИЗИЧЕСКИЕ СВОЙСТВА
По физическим свойствам три первых представителя гомологического ряда алкинов при нормальных условиях представляют собой газы, далее следуют жидкости (С5—C15), а начиная с углеводорода состава С16Н30 алкины являются твердыми веществами. Изменения температур плавления и кипения в гомологическом ряду алкинов подчиняются основным закономерностям, характерным для алканов и алкенов.
12.4. ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства алкинов обусловлены наличием в их cтруктуре тройной связи (см. с. 47 и 48). Атомы углерода, связанные тройной связью, находятся в состоянии sр-гибридизации. Тройная связь представляет собой сочетание одной σ-связи и двух π-связей, расположенных во взаимно перпендикулярных плоскостях (рис. 12.1).
Глава 12
176
|
180° |
|
|
|
|
0,106 íì |
|
C |
C |
|
H |
C C H |
H |
H |
à |
0,120 íì |
|
|
â |
|
á |
|
|
|
 H
H
Рис. 12.1. Строение молекулы ацетилена:
а — шаростержневая модель; б — геометрия молекулы; в — σ-связи; г — π-связи; д — атомно-орбитальная модель
Следовательно, для алкинов, как и для соединений с двойными связями, характерны реакции электрофильного присоединения за счет разрыва π-связей. Эти реакции протекают, как правило, в две стадии. После присоединения одной молекулы реагента алкин превращается в замещенный алкен, который может присоединять по месту разрыва π-связи вторую молекулу реагента. Однако вследствие большей электроотрицательности sр-гибридизованного атома углерода по сравнению с атомом углерода в sp2-гибридизации π-связи алкинов труднее вступают в химическое взаимодействие с электрофильными реагентами, чем π-связь алкенов. Поэтому алкины по сравнению с алкенами несколько менее активны в реакциях электрофильного присоединения. Кроме того, благодаря высокой электроотрицательности атома углерода в sр-гибридизации алкины с концевой тройной связью R—С—С—Н обладают слабой СН-кислотностью и способны замещать атом водорода на металлы и другие группы. Наконец, аналогично алкенам, алкины вступают также в реакции окисления, восстановления и полимеризации.
12.4.1. реакЦии ЭЛекТроФиЛьного ПрисоединениЯ (АЕ )
Наиболее важными реакциями электрофильного присоединения в ряду алкинов являются галогенирование и гидрогалогенирование.
галогенирование. Алкины довольно легко присоединяют по месту тройной связи хлор и бром. В реакцию может вступать одна или две молекулы галогена. В результате присоединения одной молекулы галогена образуется преимущественно транс-дигалогеналкен. Присоединение второй молекулы галогена идет труднее. При этом образуется тетразамещенный алкан и наблюдается обесцвечи-
вание характерной окраски брома (качественная реакция на кратную связь).
|
|
|
H |
Br |
|
Br |
Br |
|
HC—C—CH3 |
Br2 |
Br2 |
|
|
|
|
|
С—C |
CH3 |
HC |
—C—CH3 |
|
|
|
|
|
|
Br |
|
|
|
Br |
|
|
|
|
|
|
Br |
ïðîïиí |
транс-1,2-дибромïðîïåí |
1,1,2,2-тетрабромïðîïàí |

|
аЛкины |
|
|
|
|
|
|
|
177 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Механизм реакции аналогичен галогени- |
|
|
|
|
|
|
|
|
|
рованию алкенов (см. с. 152). |
|
|
|
|
|
|
гидрогалогенирование. |
Алкины могут |
|
|
|
|
присоединять одну или две молекулы га- |
|
|
|
|
логеноводорода (НСl, НВr) с образованием |
|
|
|
|
соответственно |
моногалогенозамещенных |
|
|
|
|
алкенов или геминальных дигалогеналканов |
|
|
|
|
(оба атома галогена находятся при одном |
|
|
|
|
атоме углерода). Присоединение протекает |
|
|
|
|
в соответствии с правилом Марковникова: |
|
|
|
|
HC—C—CH3 |
HBr |
|
H2C—C—CH3 |
HBr |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
михаил григорьевич кучероВ |
|
|
|
ïðîïиí |
2-бромпропен |
|
|
(1850—1911) |
|
|
|
|
|
Br |
|
|
|
|
|
Русский химик-органик. Основ- |
|
|
|
|
|
|
|
|
|
|
|
ные научные работы посвящены раз- |
|
|
|
CH3—C—CH3 |
|
|
|
витию органического синтеза. Осу- |
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
ществил синтез (1873) дифенила и его |
|
|
|
|
|
|
|
|
производных. Исследовал (1875) усло- |
|
|
|
2,2-дибромпропан |
|
|
|
|
вия превращения бромистого винила |
|
|
|
По механизму реакция аналогична гид- |
в ацетилен. Открыл (1881) реакцию |
|
|
|
каталитической гидратации ацетиле- |
|
рогалогенированию алкенов. |
новых углеводородов с образованием |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
карбонилсодержащих |
соединений. |
|
12.4.2. реакЦии нукЛеоФиЛьного |
Реакция превращения ацетилена в ук- |
|
сусный альдегид в присутствии солей |
|
|
|
ПрисоединениЯ (AN) |
|
|
|
ртути (реакция Кучерова) положена |
|
|
|
Алкины в отличие от алкенов вступают |
в основу промышленного получения |
|
в реакции нуклеофильного |
присоединения |
уксусного альдегида и уксусной кис- |
|
лоты. |
|
|
|
(A |
N |
). Способность алкинов взаимодейство- |
|
|
|
|
|
|
|
|
|
|
|
|
Русское физико-химическое обще- |
|
вать с нуклеофильными реагентами объяс- |
ство учредило (1915) премию имени |
|
няется повышенной электроотрицательнос- |
М. Г. Кучерова для начинающих ис- |
|
тью sp-гибридизованного атома углерода. |
следователей-химиков. |
|
|
Нуклеофильным присоединением ( AN) на-
зывают реакции присоединения, в которых атакующей частицей является нуклеофил (см. с. 119, 257).
гидратация (реакция Кучерова). Алкины в присутствии катализатора — солей ртути (II) взаимодействуют с водой. Присоединение происходит в соответствии
справилом Марковникова. В результате гидратации ацетилена образуется уксусный альдегид, гомологи образуют кетоны. Реакция гидратации алкинов открыта в 1881 году русским химиком М. Г. Кучеровым.
Гидратация алкинов протекает через стадию образования енолов — гидроксипроизводных углеводородов, содержащих гидроксильную группу у атома углерода
сдвойной связью (см. подразд. 22.3). Такие соединения являются неустойчивыми. В процессе образования они изомеризуются в более стабильные карбонильные
соединения — альдегиды или кетоны. Эта закономерность была установлена в 1877 году русским химиком А. П. Эльтековым и получила название «правило Эльтекова»:
Глава 12
178
HC—CH + HOH Hg2+, H+
александр Павлович ЭЛьТекоВ
(1846—1894)
Русский химик-органик. Окончил Харьковский университет (1868). Основные научные работы посвящены исследованию превращений углеводородов и кислородсодержащих производных — спиртов, эфиров. Открыл (1877) правило, согласно которому гидроксипроизводные углеводородов, содержащие гидроксильную группу при двойной углерод-углеродной связи, необратимо превращаются в изомерные предельные альдегиды
икетоны (правило Эльтекова). Разработал метод определения строения непредельных углеводородов. Открыл (1878) реакцию получения альдегидов
икетонов в результате нагревания соответствующих α- и β-дибромалканов с водой в присутствии свинца оксида (последнюю стадию называют перегруппировкой Эльтекова).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δ– |
O |
|
Hδ+ |
|
|
|
|
O |
|
|
|
H2С—C |
H |
|
|
|
|
|
СH3—С |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
åíîë |
|
|
|
|
|
|
|
|
|
|
|
уксусный альдегид |
HC—C—CH3 + HOH |
|
|
Hg2+, H+ |
|
|
|
|
|
|
|
|
|
|
пропин |
|
|
|
|
|
|
|
|
δ– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2С—C—СH3 |
|
|
|
|
|
СH3—С—СH3 |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
Hδ+ |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
åíîë |
|
|
|
|
|
|
|
|
|
|
|
|
ацетон |
Механизм реакции Кучерова:
δ+ δ+ HOH
HC—CH + Hg2+ 
 HC—CH
HC—CH
Hg2+
π-комплекс
|
H |
|
+ |
H |
|
|
С—C |
O |
H |
|
|
|
|
+ |
H |
|
|
|
|
|
|
|
|
–H |
+ |
|
|
|
|
Hg |
|
|
|
H |
O—H |
|
H+ |
+ С—C |
|
|
|
|
|
|
|
|
|
H |
–Hg |
2+ |
Hg |
|
|
H  С—C
С—C O—H
O—H
HH
|
кето-енольная |
|
H |
O |
|
|
H |
|
С—C |
|
|
|
|
|
таутомерия |
|
|
|
H |
H |
|
|
|
уксусный альдегид
Вначале тройная связь активируется в результате образования π-комплекса с ионами Hg2+, а затем происходит нуклеофильное присоединение молекулы воды.
Реакцию Кучерова широко используют в промышленности для получения из ацетилена уксусного альдегида.
Винилирование. Реакции присоединения по тройной связи алкинов, приводящие к образованию соединений общей формулы Н2С—СН—Х, называют реакциями винилирования. Винилирование алкинов протекает по механизму AN и катализируется солями ртути (ІІ) или меди (І).
аЛкины
179
|
|
|
R' OH |
H2С—С—OR' |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
простые виниловые эфиры |
|
|
|
R' 2 NH |
H2С—С—NR' 2 |
|
|
|
|
HC—C—R |
Hg2+ |
или Cu+ |
|
R |
|
|
|
виниламины |
|
|
|
|
|
O |
|
|
|
R' СOOH |
|
|
|
|
|
H2С—С—O—С—R' |
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
сложные виниловые эфиры |
|
|
|
HСN |
H2С—С—СN |
|
|
|
|
|
|
|
|
R |
|
|
|
|
замещенные акрилонитрилы |
Винилирование алкинов спиртами в присутствии твердого калия гидроксида изучено в 1887 году русским химиком А. Е. Фаворским (реакция Фаворского).
HC—C—CH3 + C2H5OH |
KOH; t ; p |
H2С—С—СH3 |
|
|
|
OC2H5 |
пропин |
|
2-этоксипропен |
12.4.3. реакЦии замещениЯ
Реакции замещения характерны для ацетилена и алкинов с концевой (терминальной) тройной связью R—С—СН.
образование ацетиленидов. Ацетилен и его гомологи с концевой тройной связью реагируют с натрия амидом NаNН2 в жидком аммиаке, аммиачным раствором серебра оксида Аg2O и меди (I) хлорида СuCl. В результате взаимодействия атом водорода метиновой группы —С—Н замещается на металл и образуются соли — ацетилениды (алкиниды).
|
HC—CH |
2Ag(NH3)2OH |
Ag—C—C—Ag |
|
|
|
|
|
|
|
|
–2NH4OH |
|
|
|
|
серебра ацетиленид |
|
|
|
|
|
|
|
|
|
HC—C—СH3 |
Cu(NH3)2Cl |
Cu—C—C—CH3 |
|
–NH4Cl |
|
|
|
|
меди (I) метилацетиленид |
|
|
|
|
|
|
NaNH2; NH3 |
(ж) |
+ – |
|
HC—C—R |
NaC—C—R |
|
–NH3 |
|
|
|
|
натрия R-ацетиленид; |
|
|
|
|
натрия алкинид
Алкиниды серебра представляют собой осадки белого цвета, а меди (I) — осадки красно-бурого цвета.
Реакции терминальных алкинов с растворами аммиакатов серебра и меди (I) является качественной на концевую тройную связь.
Аналогично протекает реакция с магнийорганическими соединениями (реактивы Гриньяра):
Глава 12
180
R—C—CH + C2H5—MgI
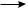 R—C—C—MgI + C2H6
R—C—C—MgI + C2H6
алкинилмагнийгалогенид
Металлические производные алкинов являются весьма реакционноспособными соединениями. Они легко вступают в реакцию нуклеофильного замещения с галогеналканами (см. с. 175), взаимодействуют с альдегидами и кетонами, образуя продукты присоединения по карбонильной группе:
|
|
|
R—C—C—MgI |
|
|
|
СH3—C—CH3 |
|
|
|
алексей евграфович ФаВорскиЙ |
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
(1860—1945) |
|
|
|
|
|
|
|
CH3 |
|
|
|
Русский химик-органик. Окончил |
|
|
|
|
|
|
|
|
|
|
|
|
R—C—C—С—OMgI |
|
HOH |
|
Петербургский университет (1882). |
|
|
|
|
|
|
|
|
|
|
|
|
–Mg(OH)I |
|
Один из основателей химии ацети- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
леновых углеводородов. Сформулиро- |
|
|
|
|
|
|
|
вал закономерности протекания про- |
|
|
|
|
|
|
|
CH3 |
|
|
|
цессов изомеризации в зависимости |
|
|
|
|
|
|
|
|
|
|
от строения реагентов и условий ре- |
|
|
R—C—C—С—OH |
|
|
|
|
|
|
|
|
акции (правило Фаворского). Открыл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1905) реакцию получения третичных |
|
|
|
|
|
|
|
CH3 |
|
|
|
ацетиленовых спиртов конденсацией |
|
Под действием хлороводородной кисло- |
|
ацетиленовых углеводородов с кар- |
|
|
бонильными соединениями (реакция |
ты ацетилениды разлагаются с выделением |
|
Фаворского). Разработал способ син- |
исходного алкина: |
|
|
|
|
|
|
|
|
|
теза диоксана, впервые им получен- |
R—C—CNa + HCl |
|
|
|
|
|
|
|
|
|
ного и описанного (1906). Первым |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
предложил синтез α-карбинолов аце- |
|
|
|
|
|
|
|
R—C—C—H + NaCl |
|
тиленового ряда на основе кетонов, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а также эфиров на основе ацетилена |
|
Эту реакцию применяют для выделения |
|
и спиртов. |
алкинов в чистом виде из смесей с другими |
|
Создатель научной школы хими- |
углеводородами. |
|
|
|
|
|
|
|
|
|
ков-органиков, лауреат Государствен- |
|
Замещение атомов водорода |
при sp-гиб- |
|
ной премии СССР (1941). |
|
|
ридизованном атоме углерода в ряду алкинов |
|
|
галогенами. Галогенирование ацетилена и его терминальных гомологов осуществляют при действии галогенов в щелочной среде:
HC—CH |
Br2; NaOH |
Br—C—CH |
Br2; NaOH |
Br—C—C—Br |
|
|
|
|
бромэтин |
|
дибромэтин |
12.4.4. реакЦии окисЛениЯ и ВоссТаноВЛениЯ
окисление алкинов. Алкины, подобно алкенам, легко окисляются. В качестве окислителей используют калия перманганат в нейтральной и щелочной среде, озон, рутения (VIII) оксид RuO4, селена (IV) оксид SeO2 и др. При окислении калия перманганатом в щелочной среде или озоном молекулы алкинов подвергаются расщеплению по тройной связи и образуются карбоновые кислоты:









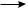 R—C—C—MgI + C2H6
R—C—C—MgI + C2H6

 С
С
 H
H + Ca(OH)
+ Ca(OH)
 H
H
 HC
HC