
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
изомериЯ органических соединениЙ |
|
|
|
|
|
|
81 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
что их старшинство последовательно убы- |
|
|
|
|
|
|
|
||||||||
вает по часовой стрелке, абсолютная кон- |
|
|
|
|
|
|
|
||||||||
фигурация обозначается буквой R (от лат. |
|
|
|
|
|
|
|
||||||||
Rectus — правый), если же старшинство за- |
|
|
|
|
|
|
|
||||||||
местителей убывает против часовой стрелки, |
|
|
|
|
|
|
|
||||||||
конфигурацию обозначают буквой S (от лат. |
|
|
|
|
|
|
|
||||||||
Sinister — левый). |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Для описания через R,S-систему обозна- |
|
|
|
|
|
|
|
||||||||
чения конфигураций стереоизомеров, изоб- |
|
|
|
|
|
|
|
||||||||
раженных с помощью проекционных фор- |
|
|
|
|
|
|
|
||||||||
мул Фишера, необходимо путем четного чис- |
|
|
|
|
|
|
|
||||||||
ла перестановок заместителей преобразовать |
|
|
|
|
|
|
|
||||||||
проекцию Фишера таким образом, чтобы |
|
|
|
|
|
|
|
||||||||
младший заместитель находился внизу. Если |
кристофер ингоЛьд (ингоЛд) |
||||||||||||||
при этом остальные три заместителя распо- |
|
(1893—1970) |
|
|
|||||||||||
ложены в порядке уменьшения старшинс- |
Английский |
химик. |
Основатель |
||||||||||||
тва по часовой стрелке, соединение относят |
физической |
органической |
химии. |
||||||||||||
к R-ряду, если против часовой |
|
стрелки — |
Изучал |
(1926—1933) |
электронную |
||||||||||
к S-ряду. Преобразуя указанным способом, |
структуру ароматических соединений. |
||||||||||||||
например, проекцию D-глицеринового аль- |
Развил теорию электронных смеще- |
||||||||||||||
дегида, видим, что по R,S-системе он имеет |
ний. Ввел представление об электро- |
||||||||||||||
R-конфигурацию: |
|
|
|
|
|
|
и нуклеофильных реагентах и реакци- |
||||||||
|
|
|
|
|
|
ях. Уточнил классификацию эффек- |
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
O |
|
|
|
|
|
|
тов электронных смещений, рассмот- |
||||||
|
C |
|
|
|
OH |
O |
рел их причины. Обобщил материалы, |
||||||||
|
H |
|
|
|
относящиеся к определению зависи- |
||||||||||
H |
|
≡ |
HOH2C |
|
|
||||||||||
|
OH |
|
C |
мости физических свойств и реакци- |
|||||||||||
|
CH2OH |
|
|
|
H |
|
H |
онной способности соединений от их |
|||||||
|
|
|
|
|
|
электронного |
строения. |
Провел |
ряд |
||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
R-глицериновый альдегид |
|
|
фундаментальных исследований |
ки- |
|||||||||
Следует помнить, что нечетное число пе- |
нетики реакций замещения. Совмест- |
||||||||||||||
но с В. Прелогом разработал R,S-сис- |
|||||||||||||||
рестановок заместителей в проекции Фише- |
тему обозначений пространственных |
||||||||||||||
ра приводит к обращению конфигурации: |
конфигураций. |
|
|
|
|
||||||||||
|
|
|
|
C |
O |
|
|
|
|
C |
O |
|
|
|
|
|
|
|
|
H |
|
|
обращение |
|
H |
|
|
|
|
||
|
|
|
H |
|
|
конфигурации |
HOH2C |
|
|
|
|
||||
|
|
|
|
OH |
|
|
|
OH |
|
|
|
|
|||
|
|
|
|
CH2OH |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
R-глицериновый |
|
|
|
S-глицериновый |
|
|
|
|||||
|
|
|
альдегид |
|
|
|
|
альдегид |
|
|
|
|
|||
Особую трудность представляет преобразование проекционных формул для соединений с несколькими хиральными центрами. В таких случаях R,S-система допускает использование непреобразованных проекционных формул. При этом, если в проекционной формуле Фишера младший заместитель расположен справа или слева от асимметрического центра, для описания конфигурации по R,S-сис- теме применяется обращенное правило, а именно — уменьшение старшинства заместителей по часовой стрелке придает хиральному центру S-конфигурацию, а против часовой стрелки — R-конфигурацию. Например, из четырех стерео-

Глава 5
82
изомеров 3-бром-2-бутанола первый имеет (2R,3R)-, второй — (2S,3S)-, третий — (2S,3R)-, четвертый — (2R,3S)-конфигурацию, которая обозначается в виде приставки к систематическому названию:
|
1CH |
3 |
|
|
CH |
3 |
|
|
CH |
3 |
|
CH |
3 |
||||||||
HO |
2 |
|
|
H |
H |
|
|
|
|
OH |
H |
|
|
|
|
OH |
HO |
|
|
|
H |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H |
|
|
Br |
Br |
|
|
|
|
H |
H |
|
|
|
|
Br |
Br |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
CH3 |
|
|
CH3 |
|
|
CH3 |
|
CH3 |
|||||||||||||
(2R,3R)-изомер |
(2S,3S)-изомер |
(2S,3R)-изомер |
(2R,3S)-изомер |
||||||||||||||||||
|
I. |
|
|
|
|
II. |
|
|
|
|
III. |
|
|
|
IV. |
|
|
||||
рацемические |
формы. В |
|
индивидуальном |
виде органические |
соединения |
||||||||||||||||
с хиральными молекулами образуются лишь в результате сложных биохимических процессов, протекающих в живых организмах с участием ферментов. При синтетических методах их получения, как правило, образуются равные количества левовращающего и правовращающего энантиомеров, составляющих так называемую рацемическую форму. Рацемическая форма не обладает оптической активностью. В газообразном и жидком агрегатных состояниях, а также в растворах рацемическая форма представляет собой идеальную смесь равного числа энантиомерных молекул, поэтому она имеет те же свойства, что и индивидуальные энантиомеры (температура кипения, показатель преломления, ИК-спектры).
В твердом состоянии рацемическая форма может существовать в виде смеси зеркально идентичных кристаллов индивидуальных энантиомеров, получившей название «рацемическая смесь», или представлять собой молекулярное соединение, кристаллы которого построены из строго чередующихся молекул лево-
иправовращающего изомера. Такая рацемическая форма называется рацемическим соединением, или рацематом. Рацематы отличаются от индивидуальных энантиомеров физическими свойствами (температурой плавления, растворимостью)
испектральными характеристиками (ИК-спектры в твердом состоянии). Так, температура плавления (+)-винной и (–)-винной кислоты равна 170 °С, а рацемическая винная кислота (виноградная) плавится при температуре 204—206 °С.
Причиной образования рацемической формы при возникновении хирального центра в молекуле являются тонкие различия в пространственном строении ахиральных молекул.
Если ахиральная молекула содержит при sр3-гибридизованном атоме углерода четыре или три одинаковых заместителя, то эти заместители эквивалентны, то есть их невозможно отличить друг от друга какими-либо физическими и химическими методами. Такие заместители имеют одинаковое пространственное расположение, их называют гомотопными.
Когда при sр3-гибридизованном атоме углерода имеется два одинаковых заместителя, их пространственное положение может быть в одних случаях эквивалентным, в других — неэквивалентным. В симметричном окружении такие два заместителя являются эквивалентными, то есть гомотопными. Так, в молекуле
дихлорметана СН2Сl2 атомы водорода имеют симметричное окружение, поэтому замещение любого из них на другой заместитель, например атом брома, приводит к идентичным продуктам.
изомериЯ органических соединениЙ
83
гомотопные атомы
|
Ha |
|
|
|
|
|
Ha |
|
|
|
Br |
|
||
Br |
|
Br2(hν) |
H |
|
Br2(hν) |
H |
|
|||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
||||||||
C |
Cl |
b C |
Cl |
b C |
Cl |
|||||||||
|
|
|
|
|
|
|
||||||||
Cl |
|
|
|
|
Cl |
|
Cl |
|||||||
|
|
|
|
|
|
|
|
|||||||
бромдихлорметан |
|
|
дихлорметан |
|
бромдихлорметан |
|||||||||
В несимметричном окружении два одинаковых заместителя имеют неэквивалентное пространственное положение. При замене одного из них на новую группу образуется продукт, пространственно не идентичный тому, который получается при замещении другого. Эти продукты по отношению друг к другу явля-
ются энантиомерами. Атомы или группы в молекуле, замещение которых приводит к образованию энантиомеров, называются энантиотопными. Так, в молекуле фтор-
хлорметана СН2FСl атомы водорода имеют несимметричное окружение, а вследствие этого — неэквивалентное пространственное положение. Они энантиотопны, поскольку при замещении одного из них, например, атомом брома образуется один энантиомер, тогда как при замене другого — другой энантиомер.
энантиотопные атомы
|
Ha |
|
|
|
|
|
|
Ha |
|
|
|
|
Br |
|
|
Br |
|
|
Br2(hν) |
H |
|
|
Br2(hν) |
H |
|
||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||
C |
|
|
b C |
|
|
b C |
|
||||||||
|
Cl |
|
|
|
|
Cl |
|
|
Cl |
||||||
F |
|
|
|
|
|
F |
|
|
F |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
S-бромфторхлорметан |
|
|
|
фторхлорметан |
|
R-бромфторхлорметан |
|||||||||
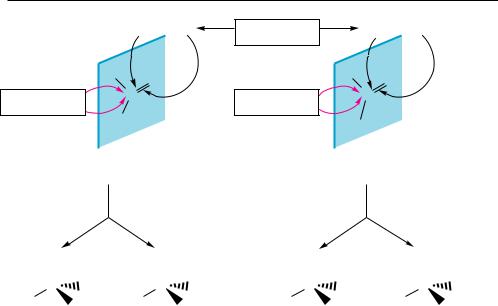
Эквивалентными и энантиотопными могут быть не только заместители при sр3-гибридизованном атоме углерода, но и стороны двойной связи sр2-гибридизо- ванного атома углерода в молекуле. В молекуле формальдегида (рис. 5.8), имеющего симметричное окружение карбонильной группы, атака ахиральным реагентом двойной связи с любой стороны приводит к одному и тому же продукту. Это свидетельствует о том, что стороны двойной связи в молекуле эквивалентны.
В ацетальдегиде (см. рис. 5.8) карбонильная группа имеет несимметричное окружение, поэтому при атаке ахиральным реагентом с двух разных сторон образуются пространственно не идентичные продукты. По отношению друг к другу они являются энантиомерами. Такие две стороны двойной связи в молекуле называются энантиотопными.
При взаимодействии с ахиральными реагентами энантиотопные заместители или стороны в молекуле подвергаются атаке с одинаковой скоростью, поэтому в результате реакции образуются равные количества энантиомеров, то есть рацемическая форма. Хиральными реагентами, включая и хиральные биохимические агенты типа ферментов, энантиотопные атомы, группы или стороны атакуются с разной скоростью, что приводит к образованию преимущественно или ис-
ключительно одного энантиомера. Реакции, протекающие с образованием исключительно или преимущественно одного из возможных стереоизомеров, называют стереоселективными.
Молекулы, содержащие энантиотопные атомы, группы или стороны, называют прохиральными, так как замена одного из энантиотопных заместителей группой,
Глава 5
84
Эквивалентные
стороны
À |
À |
Ахиральный |
À |
À |
|
|
|
реагент |
|
|
|
H |
Î |
|
H |
Î |
|
C |
Энантиотопные |
C |
|||
|
|
||||
H |
|
стороны |
H3Ñ |
|
|
|
|
|
|||
². |
|
|
²I. |
|
H |
|
|
H |
|
H |
|
|
H |
|
||||
|
|
À |
+ |
|
|
Ζ |
|
|
À |
+ |
|
|
Ζ |
C |
C |
C |
C |
||||||||||
H |
Ζ |
H |
|
|
À |
H3Ñ |
Ζ |
H3Ñ |
|
|
À |
||
|
|
Идентичные |
|
|
|
|
|
Энантиомерные |
|
|
|
||
|
|
молекулы |
|
|
|
|
|
молекулы |
|
|
|
||
Рис. 5.8. Эквивалентные стороны двойной связи в формальдегиде (І) и энантиотопные стороны в ацетальдегиде (ІІ)
отличающейся от трех остальных, а также присоединение новой группы по месту разрыва двойной связи приводит к образованию хиральной молекулы.
методы разделения рацемических форм на энантиомеры. Для разделения ра-
цемических форм на составляющие их энантиомеры применяют механический, биохимический и химический методы.
Механический метод можно использовать в тех случаях, когда образующие рацемическую форму энантиомеры кристаллизуются из раствора раздельно. При этом кристаллы лево- и правовращающего изомеров отличаются друг от друга по внешнему виду, как хиральный предмет отличается от своего зеркального изображения. Такие кристаллы могут быть разделены механически. Этим методом
в1848 году Луи Пастер впервые разделил на энантиомеры натрийаммониевую соль виноградной кислоты. Поскольку раздельная кристаллизация энантиомеров свойственна лишь некоторым рацемическим формам, метод механического разделения имеет ограниченное применение.
Биохимический метод основан на избирательном потреблении некоторыми микроорганизмами какого-либо одного из двух энантиомеров рацемической формы. В результате другой изомер может быть выделен из остатка в чистом виде. Этим методом в 1857 году Луи Пастер с помощью плесневого грибка Penicillium glaucum из рацемической винной кислоты (виноградной) получил (–)-винную кислоту. Применение биохимического метода разделения ограничено необходимостью поиска подходящего микроорганизма, а также тем, что не всякое вещество может потребляться микроорганизмами. Кроме того, один из энантиомеров
впроцессе разделения пропадает. Однако биохимический метод используют для промышленного получения L-α-аминокислот.

изомериЯ органических соединениЙ
85
Химический метод основан на превращении энантиомеров рацемической формы в диастереомеры с последующим их разделением и выделением индивидуальных энантиомеров. Диастереомеры получают взаимодействием рацемической формы с каким-либо оптически активным реагентом. Разделение рацемических форм химическим методом можно представить в общем виде следующей схемой:
рацемическая форма |
оптически активный реагент |
|
|
|
|
|
смесь диастереомеров |
||||||||||||||||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А + В |
|
С |
|
|
|
|
|
|
|
А · C + B · C |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
разделение |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
А · C |
|
|
B · C |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
индивидуальные |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
диастереомеры |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
выделение энантиомеров |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
–C |
|
|
|
|
–C |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
B |
|
||||||
|
|
|
|
|
|
|
|
|
индивидуальные энантиомеры |
||||||||||||||
При взаимодействии рацемической формы (А+В) с оптически активным реагентом (С) образуется смесь диастереомеров (А С) и (В С), которые в отличие от энантиомеров обладают разными физическими свойствами (температурой плавления или кипения, растворимостью и т. д.), на чем и основано их разделение. Для разделения твердых диастереомеров чаще всего используют разную растворимость (метод кристаллизации), для жидких — разную температуру кипения (метод перегонки). В последнее время широкое распространение получили хроматографические методы разделения диастереомеров. Действием на индивидуальные диастереомеры (А С) и (В С) других реагентов получают индивидуальные энантиомеры (А) и (В).
Практически наиболее часто диастереомеры получают реакцией солеобразования, то есть на смесь энантиомерных кислот действуют оптически активным основанием, а на смесь энантиомерных оснований — оптически активной кислотой.
Кроме рассмотренных методов разделения рацемических форм, применяются также хроматографические методы.
5.2.3. геомеТрическаЯ изомериЯ
Геометрическими изомерами называют вещества, имеющие одинаковый состав и последовательность связывания атомов в молекулах, но разное расположение заместителей в пространстве относительно плоскости двойной связи или плоскости цикла.
Появление данного вида изомерии обусловлено невозможностью свободного вращения вокруг двойной связи в молекуле и σ-связей, образующих циклы1.
1 Вокруг σ-связей цикла в зависимости от его размера возможны конформационные повороты, но в целом циклы представляют собой жесткие образования.
Глава 5
86
Геометрическая изомерия наблюдается в органических соединениях с двойной связью и алициклических соединениях.
геометрическая изомерия соединений с двойной связью. Она наиболее распро-
странена среди органических соединений, молекулы которых содержат двойную углерод-углеродную связь  С—С
С—С .
.
Геометрическая изомерия возможна лишь в том случае, когда у каждого из углеродных атомов, образующих двойную связь, находится два разных заместителя.
ClH С—С HCl |
ClI С—С HBr |
1,2-дихлорэтен |
2-бром-1-йод-1-хлорэтен |
Молекулы таких соединений могут существовать в виде двух пространственных изомеров, отличающихся друг от друга расположением заместителей относительно плоскости двойной связи (рис. 5.9).
Плоскость двойной связи
Ñl |
|
Ñ |
Í |
Í |
|
Ñ |
Ñl |
|
|
|
|
|
|
||
Ñl |
Ñ |
Í |
Ñl |
|
Ñ |
|
Í |
|
|
|
|
Рис. 5.9. Геометрические изомеры 1,2-дихлорэтена
Для обозначения конфигурации геометрических изомеров используют цис-
транс- и E,Z-систему. Цистранссистема обозначений конфигурации имеет огра-
ниченное применение. Ее можно использовать только тогда, когда связанные двойной связью углеродные атомы имеют одинаковые заместители. Если оди-
наковые заместители расположены по одну сторону от плоскости двойной связи, конфигурацию обозначают цис-, если по разные стороны — транс-:
H |
С—С |
H |
H |
С—С |
CH3 |
H3C |
CH3 |
H3C |
H |
||
|
цис-2-бутен |
|
транс-2-бутен |
||
Поэтому геометрическую изомерию называют еще цистрансизомерией. Когда углеродные атомы, образующие двойную связь, имеют все разные
заместители, как, например, в 1-бром-1-хлорпропене, применение цис-транс- системы становится невозможным. В таких случаях используют Е,Zсистему обозначений:
изомериЯ органических соединениЙ
87
17Cl |
1H |
17Cl |
6CH3 |
||
35 |
Br |
С—С 6 |
35 |
Br |
С—С 1 |
|
CH3 |
|
H |
||
(Z)-1-бром-1-хлорпропен |
(E)-1-бром-1-хлорпропен |
||||
Е,Z-система более универсальна и применима к геометрическим изомерам с любым набором заместителей. Е,Z-система обозначений конфигурации основана на определении по Кану—Ингольду—Прелогу (см. с. 79) старшинства заместителей у каждого из углеродных атомов двойной связи. Если при этом старшие заместители из каждой пары расположены по одну сторону от плоскости двойной связи, конфигурацию обозначают буквой Z (от нем. Zusammen — вместе), если по разные стороны — буквой Е (от нем. Еntgegen — напротив). Так, в приведенных изомерах 1-бром-1-хлорпропена старшим заместителем у одного из углеродных атомов является атом брома, у другого — группа —СН3. Следовательно, изомеру, в котором эти заместители расположены по одну сторону от плоскости двойной связи, соответствует Z-конфигурация, а изомеру, где они расположены по разные стороны,— E-конфигурация.
Следует отметить, что между цис-, транс- и Е,Z -системой обозначений не существует какой-либо взаимосвязи. В одном случае цис-изомер может быть E-изомером, а в другом — Z-изомером:
Cl |
Cl |
H3C |
CH3 |
Br |
С—С H |
H |
С—С H |
цис-1-бром-1,2-дихлорэтен; |
|
цис-2-бутен; |
|
(Е)-1-бром-1,2-дихлорэтен |
|
(Z)-2-бутен |
|
Геометрические изомеры с двойной углерод-углеродной связью обладают высокой устойчивостью, причем транс-изомеры более устойчивы, чем цис-изомеры. Превращение одного изомера в другой происходит в довольно жестких условиях (высокая температура, облучение ультрафиолетовым светом) и требует разрыва π-связи.
В виде геометрических изомеров могут существовать также соединения, молекулы которых содержат двойную связь  С—N— с разными заместителями
С—N— с разными заместителями
у атома углерода и двойную связь —N—N—. В этих случаях атомы при двойной связи имеют три или два заместителя. Роль «недостающего» заместителя в таких изомерах выполняет неподеленная электронная пара атома азота (
 ):
):
C H |
OH |
C H |
|
|
6 H5 |
С—N |
6 |
H5 С—N OH |
|
(Z)-оксим бензальдегида |
(E)-оксим бензальдегида |
|||
|
син-изомер |
|
|
анти-изомер |
C6H5 N N C6H5 |
C6H5 |
N—N |
||
|
— |
|
|
|
|
|
|
|
C6H5 |
(Z)-азобензол |
|
|
(E)-азобензол |
|
|
син-изомер |
|
|
анти-изомер |
Глава 5
88
Конфигурацию подобных изомеров первоначально обозначали префиксами син- и анти- (по аналогии с цис- и транс-). В настоящее время используют Е,Z -номенклатуру.
Стереоизомеры с двойной связью  С—N— и —N—N— обладают значитель-
С—N— и —N—N— обладают значитель-
но меньшей стабильностью, чем изомеры с двойной углерод-углеродной связью. Поскольку геометрические изомеры с двойной связью имеют одинаковую конфигурацию при одном из образующих двойную связь атомов и разную при другом, они по отношению друг к другу являются диастереомерами. Такие диастереомеры содержат π-связь, поэтому их называют πдиастереомерами. Молекулы
π-диастереомеров ахиральны, а потому не обладают оптической активностью.
геометрическая изомерия циклических соединений. Подобно двойной связи,
наличие цикла в молекуле препятствует свободному вращению вокруг образующих его σ-связей и тем самым создает возможность для существования геометрической изомерии. Такая изомерия возможна при наличии в цикле двух атомов углерода, каждый из которых имеет два разных заместителя. В этом случае два заместителя у разных углеродных атомов могут быть расположены по одну сторону от плоскости цикла1 — цис-изомер или по разные стороны — транс-изомер:
H |
H |
H |
СOOH |
||
HOOC |
СOOH |
HOOC |
H |
||
цис-1,2-циклопропандикарбоновая кислота |
транс-1,2-циклопропандикарбоновая кислота |
||||
СH3 |
СH3 |
СH3 |
H |
||
|
|
|
|
||
|
|
|
|
||
|
H |
H |
|
H |
СH3 |
|
|
|
|
||
цис-1,3-диметилциклогексан |
транс-1,3-диметилциклогексан |
||||
Для обозначения конфигурации геометрических изомеров циклических соединений Е,Z-систему не применяют.
В отличие от соединений с двойными связями, в циклических соединениях геометрическая изомерия неразрывно связана с оптической, поскольку замещенные атомы углерода в цикле являются асимметрическими.
Если в цикле у разных углеродных атомов имеются одинаковые пары заместителей, то есть асимметрические атомы углерода равноценны, то, подобно винной кислоте (см. с. 76), число оптических изомеров уменьшается от четырех до трех. Цис-изомер в этом случае имеет плоскость симметрии, а потому совместим со своим зеркальным изображением и не обладает оптической активностью (мезоформа). Транс-изомер не имеет плоскости симметрии и существует в виде двух энантиомеров:
H |
СOOH |
HOOC |
H |
H |
H |
* |
* |
|
* * |
* |
* |
HOOC |
H |
H |
СOOH |
HOOC |
СOOH |
|
зеркало |
|
|
|
|
энантиомеры 1,2-циклопропандикарбоновой кислоты |
мезоформа |
||||
1 При рассмотрении вопросов изомерии строение циклов принято считать плоским, хотя в действительности только трехчленные циклы имеют плоское строение.

изомериЯ органических соединениЙ
89
Если замещенные углеродные атомы в цикле не равноценны, как, например, в 2-бутил-1-циклопропанкарбоновой кислоте, то количество стереоизомеров соответствует формуле N = 2 n и равно четырем. В данном случае и цис-изомер, и транс-изомер существуют в виде двух энантиомеров:
HOOC |
С4H9 |
С4H9 |
СOOH |
* |
* |
* |
* |
H |
H |
H |
H |
энантиомеры цис-2-бутил-1-циклопропанкарбоновой кислоты |
|||
HOOC |
H |
H |
COOH |
* |
* |
* |
* |
H |
С4H9 |
С4H9 |
H |
энантиомеры транс-2-бутил-1-циклопропанкарбоновой кислоты
Геометрические изомеры имеют разные физические свойства (температуру плавления и кипения, растворимость и т. д.), спектральные характеристики и химические свойства. Такое различие в свойствах позволяет довольно легко установить их конфигурацию с помощью физических и химических методов.
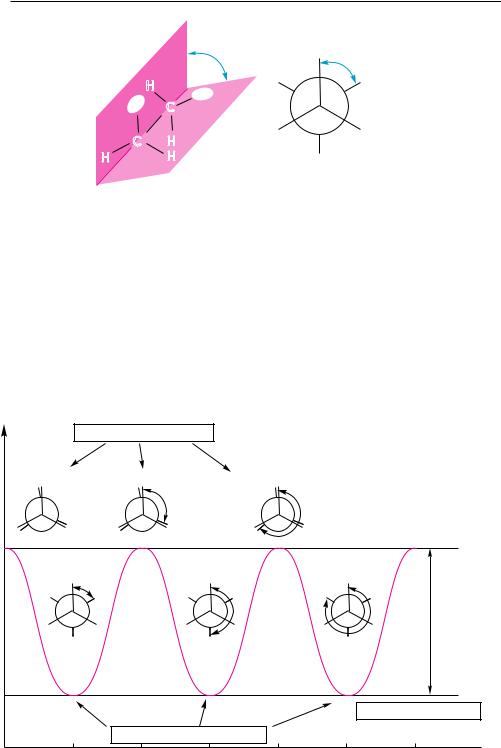
5.2.4. конФормаЦионнаЯ (ПоВороТнаЯ) изомериЯ
Конформационная изомерия обусловлена вращением отдельных фрагментов молекулы вокруг одинарных связей. В результате вращения молекула может принимать различные пространственные формы, называемые конформациями. Молекула этана вследствие вращения вокруг углерод-углеродной связи может принимать бесконечное множество конформаций, каждая из которых характеризуется определенным значением потенциальной энергии. Две крайние конформа-
ции называют заслоненной и заторможенной.
Для изображения конформаций на плоскости используют перспективные формулы и проекционные формулы Ньюмена:
HHH
H H H H
H H H H
H H H H H
H H H
заслоненная конформация этана
H
H H H H H
H
H H H H H
заторможенная конформация этана
В заслоненной конформации этана атомы водорода метильных групп, если смотреть вдоль углерод-углеродной связи, расположены друг за другом. В заторможенной — атомы водорода одной метильной группы максимально удалены от атомов водорода другой. Между заслоненной и заторможенной конформациями молекула в процессе вращения принимает множество скошенных конформаций. Поворот фрагментов молекулы вокруг одинарной связи характеризуется торсионным (двугранным) углом ϕ (рис. 5.10).
Изменение потенциальной энергии Е молекулы этана в зависимости от торсионного (поворотного) угла ϕ изображено на рис. 5.11.
Глава 5
90
|
|
ϕ |
Í ϕ |
|
Í |
Í |
Í |
Í |
Í |
|
|
Ñ |
|
||
|
|
||
Ñ |
Í |
Í |
Í |
Í |
Í |
|
Í |
|
|
|
|
|
à |
|
á |
Рис. 5.10. Торсионный (двугранный угол ϕ):
а — перспективная проекция; б — ньюменовская проекция
Максимальную потенциальную энергию имеет заслоненная конформация. При переходе от заслоненной конформации к заторможенной энергия постепенно уменьшается и становится минимальной в заторможенной конформации. Поскольку эта конформация для молекулы энергетически наиболее выгодна, большую часть времени молекула находится в заторможенной конформации. При дальнейшем вращении энергия снова увеличивается и достигает максимума в следующей заслоненной конформации. В конечном итоге при обороте на 360° молекула трижды принимает заслоненную и трижды заторможенную конформации.
Энергетическая неравноценность различных конформаций объясняется существованием в молекуле так называемого торсионного напряжения (напряжения
Å |
Заслоненные конформации |
|
|
|
|
|
|||
ÍÍ |
|
|
ÍÍ |
|
ÍÍ |
|
|
|
|
ÍÍ |
Í |
ÍÍ |
Í |
ÍÍ |
|
Í |
|
|
|
Í |
Í |
|
Í |
|
|
|
|||
|
Í |
|
|
Í |
|
Í |
|
|
|
Í |
Í |
|
Í |
Í |
|
Í |
Í |
êÄæ/ìîëü |
|
Í |
Í |
|
Í |
Í |
|
Í |
Í |
|
|
|
Í |
|
|
Í |
|
Í |
|
|
|
|
|
|
|
|
12 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Энергетический барьер |
||
|
|
Заторможенные конформации |
|
|
|
|
|
||
0 |
60 |
|
120 |
180 |
240 |
300 |
|
360 |
ϕ, ãðàä |
|
Рис. 5.11. Диаграмма потенциальной энергии конформаций этана |
|
|||||||
