304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
Глава 13
192
|
Í Í |
|
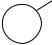
Вследствие взаимного отталкивания электрон- |
|
«банановая» |
|
|||
связь |
|
|
|
ных облаков углерод-углеродных связей макси- |
|
|
Ñ |
|
мальная электронная плотность перекрывающихся |
|
|
|
орбиталей атомов углерода в трехчленном цикле |
|
|
|
104° 60° |
|
расположена не по прямой, соединяющей центры |
|
|
|
связываемых атомов, а за пределами треугольника |
|
Í |
Ñ |
Ñ |
Í |
молекулы (рис. 13.2). |
Образующиеся при этом σ-связи отличаются от |
||||
Í |
|
|
Í |
обычных σ-связей. Они занимают промежуточное |
Рис. 13.2. Схема образования угле- |
положение между σ- и π-связями. Их называют |
|||
τ-(греч. «тау»)связями, или «банановыми» связями. |
||||
род-углеродных связей в молекуле |
Несмотря на то что перекрывание за пределами |
|||
|
циклопропана |
|
||
|
|
треугольника менее эффективно, образование ба- |
||
|
|
|
|
|
нановых связей для молекулы является выгодным процессом, поскольку в результате этого углы между связями, которые теоретически должны быть равными 60°, увеличиваются до 104°, что, следовательно, снижает угловое напряжение молекулы.
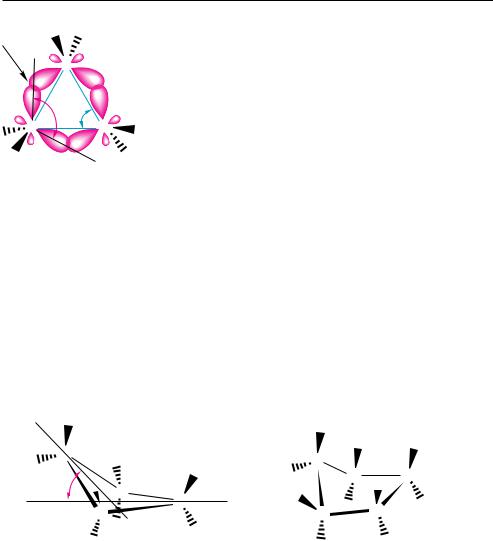
Четырехчленный цикл, в отличие от трехчленного, обладает все же незначительной гибкостью. Внутренние валентные углы в нем меньше искажены, чем в трехчленном, а следовательно, и угловое напряжение несколько ниже. Стремясь уменьшить торсионное напряжение в четырехчленном цикле, один из атомов углерода выходит из плоскости остальных трех атомов на угол 25—30°. Поэтому четырехчленный цикл не является плоским, его пространственная форма представлена на рис. 13.3, а.
|
Í |
|
|
|
|
Í |
|
|
|
|
|
|
|
|
|
Í |
|
Í |
Ñ |
|
Í |
|
|
Í |
|
|
|
Í |
Í |
Ñ |
|
|
|||
|
|
|
|
|||||
|
25–30° |
Í |
|
Ñ |
Í |
Ñ |
||
|
Ñ |
|
|
|||||
|
|
|
Ñ |
|
Í |
|
Í |
|
|
|
Ñ |
|
|
Ñ Í |
Ñ |
||
|
|
Í |
Í |
|
||||
|
|
Í |
|
|
|
Í |
||
|
|
|
|
Í |
|
|||
|
|
|
|
|
|
|||
|
|
|
à |
|
|
á |
|
|
Рис. 13.3. Пространственное строение молекул циклобутана (а) и циклопентана (б)
Еще большая гибкость характерна для пятичленного цикла. В отличие от трехчленного и четырехчленного, в пятичленном цикле практически отсутствует угловое напряжение (отклонение внутренних валентных углов от тетраэдрического составляет менее 1°). Однако в плоском пятичленном цикле связи С—Н находятся в заслоненной конформации, что создает значительное торсионное напряжение в молекуле. Стремясь уменьшить торсионное напряжение в пятичленном цикле, каждый из пяти углеродных атомов поочередно выходит из плоскости, в которой расположены четыре остальных атома углерода. При этом кольцо как бы находится в непрерывном волнообразном движении. Эта неплоская, осциллирующая структура получила название «конверт» (рис. 13.3, б). Несмотря на то что в конформации «конверт» несколько возрастает угловое напряжение, это
аЛиЦикЛические угЛеВодороды. ЦикЛоаЛканы
195
женными атомами водорода в положениях 3 и 5, что приводит к стерическому отталкиванию.
При наличии в молекуле нескольких заместителей преимущественно образуется конформация с максимально возможным числом групп в экваториальном положении.
13.6. ХИМИЧЕСКИЕ СВОЙСТВА
В химическом отношении циклоалканы во многом ведут себя подобно ал-
канам. Для них характерны реакции замещения, протекающие по радикальному механизму (SR):
+ Cl2 |
hν |
+ HCl |
|
|
|||
|
|
Cl |
|
циклопропан |
|
хлорциклопропан |
|
|
hν |
Br |
|
+ Br2 |
+ HBr |
||
|
|||
циклогексан |
|
бромциклогексан |
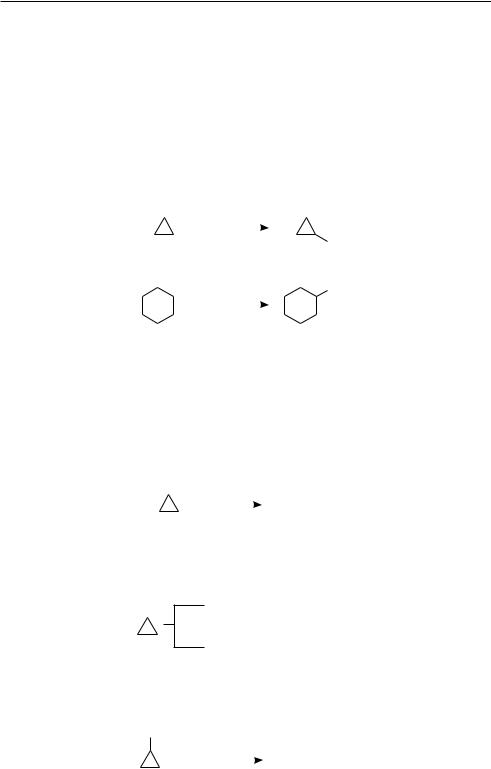
Циклоалканы с малыми циклами (циклопропан и циклобутан) проявляют своеобразные химические свойства, связанные с особенностью их строения (см. c. 191). Из-за большого углового и торсионного напряжений трехчленный цикл и, в меньшей степени, четырехчленный — являются неустойчивыми. Поэтому соединения, содержащие трех- и четырехчленные циклы, наряду с реакциями за-
мещения вступают также в реакции присоединения, сопровождающиеся раскрытием цикла. Циклопропан в присутствии катализаторов Ni, Рt и нагревании до 50 °С легко присоединяют водород:
|
H2; кат.; t |
СH3—СH2—СH3 |
|
|
|
циклопропан |
|
пропан |
Циклобутан присоединяет водород при более высокой температуре (200 °С). Аналогично протекает реакция циклопропана с галогенами и галогеноводо-
родами:
Br2 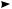 Br—СH2—СH2—СH2—Br
Br—СH2—СH2—СH2—Br
1,3-дибромпропaн
HBr 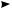 СH3—СH2—СH2—Br 1-бромпропaн
СH3—СH2—СH2—Br 1-бромпропaн
Присоединение галогеноводородов к алкилзамещенным циклопропана протекает в соответствии с правилом Марковникова.
СH3 |
|
Br |
|
+ HBr |
|
|
|
|
СH3—СH2—СH—СH3 |
||
|
|||
метилциклопропан |
|
2-бромбутaн |
|

196 |
Глава 13 |
|
|
|
Циклобутан с галогеноводородами не реагирует, а с галогенами — вступает
в реакцию замещения SR. |
|
|
Для циклоалканов и их производных характерны реакции сужения и расшире |
||
ния циклов. Реакции протекают в присутствии катализаторов кислот Льюиса: |
||
СH2—СH3 |
|
СH3 |
|
AlCl3; t |
|
этилциклобутан |
метилциклопентан |
|
13.7. ИДЕНТИФИКАЦИЯ ЦИКЛОАЛКАНОВ
Для идентификации циклоалканов, вследствие их высокой инертности (за исключением циклопропана, проявляющего ненасыщенный характер), обычно не применяют химические методы.
Как и алканы, циклоалканы поглощают УФ-излучение в области менее 200 нм, что позволяет использовать их в качестве растворителей для измерения электронных спектров других соединений.
ИК-спектры циклоалканов, кроме циклопропана и его производных, во многом схожи с ИК-спектрами алканов. В ИК-спектрах циклопропанового цикла имеются полосы поглощения в области 1050 и 1000 см–1, отвечающие деформационным колебаниям кольца и в области 3100—3010 см–1, характеризующие валентные колебания связей С—Н.
В ПМР-спектрах циклоалканов сигналы протонов цикла проявляются в той же области, что и у алканов. Некоторые особенности имеет трехчленный цикл, протоны которого поглощают излучения в сильном поле (0,1—0,6 млн–1).
13.8. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ. ПРИМЕНЕНИЕ
Циклопропан. Бесцветный газ (т. кип. –34,5 °С), хорошо растворим в органических растворителях, плохо растворим в воде. Легко воспламеняется, смеси с кислородом или азота (IV) оксидом взрывоопасны. Применяется в медицинской практике как средство для ингаляционного наркоза.
Циклопентан. Бесцветная жидкость (т. кип. 49,3 °С). Не растворяется в воде, растворим в органических растворителях, является хорошим растворителем для эфиров целлюлозы. Обладает наркотическим действием. Используют в органическом синтезе. Циклопентановое кольцо входит в состав важных биологически активных соединений — простагландинов (см. подразд. 37.3.1).
Циклогексан. Бесцветная жидкость (т. кип. 80,7 °С), не растворяется в воде, растворяется в органических растворителях. Циклогексан широко применяют в качестве растворителя, а также как исходное сырье для получения капролактама и адипиновой кислоты.
адамантан. Бесцветное кристаллическое вещество со слабым запахом камфоры. Температура плавления адамантана составляет 270 °С, но уже при комнатной температуре кристаллы возгоняются. Впервые получен из нефти в 1933 году.

аЛиЦикЛические угЛеВодороды. ЦикЛоаЛканы
197
Молекула адамантана содержит конденсированную систему, состоящую из трех циклогексановых колец, имеющих конформацию «кресло». Пространственное расположение углеродных атомов соответствует кристаллической решетке алмаза.
Некоторые производные адамантана нашли применение в медицинской практике как лекарственные средства, обладающие сильным противовирусным действием.
|
1-аминоадамантана гидрохлорид (мидантан). Применяется |
|
в медицине как препарат, обладающий противовирусным |
NH2·HCl |
действием (против вирусов гриппа типа А2), а также для ле- |
|
чения болезни Паркинсона. |
|
1-(1'-адамантил) этиламина гидрохлорид (реманта- |
|
дин) применяется в медицинской практике как про- |
CH—CH3·HCl тивовирусное средство. |
|
NH2 |
|

Глава 14
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ. ОДНОЯДЕРНЫЕ АРЕНЫ
Термин «ароматические» первоначально применяли для органических соединений, которые или сами имели приятный запах, или же выделялись из природных веществ, обладающих приятным запахом. В дальнейшем название сохранилось за большой группой органических соединений, проявляющих сходные
сбензолом свойства.
Кароматическим углеводородам относят соединения, молекулы которых содержат одно или несколько бензольных колец.
Взависимости от числа бензольных циклов, входящих в состав молекулы,
различают одноядерные (моноциклические) и многоядерные (полициклические) арены.
Многоядерные арены подразделяются на арены с конденсированными циклами (ан-
нелированные) и изолированными циклами.
14.1. ОДНОЯДЕРНЫЕ АРЕНЫ. СТРОЕНИЕ БЕНЗОЛА. АРОМАТИЧНОСТЬ
Простейшим представителем одноядерных ароматических углеводородов является бензол С6Н6.
Впервые бензол был получен Майклом Фарадеем в 1825 году из конденсированных остатков светильного газа, образующегося в процессе переработки каменного угля. Однако строение его молекулы в течение многих лет оставалось для химиков загадкой.
Несмотря на то что формула С6Н6 предполагает достаточно выраженный ненасыщенный характер, бензол, в отличие от непредельных соединений, оказался относительно инертным веществом. Так, он сравнительно устойчив к нагреванию и действию окислителей, практически не вступает в характерные для ненасыщенных соединений реакции присоединения. Напротив, для бензола более характерными оказались не свойственные непредельным соединениям реакции замещения.
Составу С6Н6 приписывались разные структурные формулы, но все они не объясняли в полной мере химических свойств бензола.
Важным этапом в установлении строения бензола явилась высказанная немецким химиком Фридрихом Августом Кекуле идея о циклическом строении его молекулы. В 1865 году Кекуле предложил формулу в виде цикла из шести атомов углерода с чередующимися простыми и двойными связями. Эта формула известна в органической химии как формула Кекуле:

аромаТические угЛеВодороды. одноЯдерные арены |
|
199 |
|||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||
H |
|
|
H |
|
|
|
|||||
С |
|
|
|
||||||||
C |
|
C |
≡ |
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
C |
|
C |
|
|
|
|
|
|
|||
H |
C |
H |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
H |
|
|
|
|
|
|
|||
Формула Кекуле предполагает равно- |
|
|
|
||||||||
ценность всех атомов углерода в молекуле, |
|
|
|
||||||||
что позже было подтверждено исследовани- |
|
|
|
||||||||
ями Альберта Ладенбурга (1874) и Эдуарда |
|
|
|
||||||||
Вроблевского (1878). |
|
|
|
майкл ФарадеЙ |
|
|
|||||
Вместе с тем в соответствии с формулой |
|
|
|||||||||
Кекуле бензол должен иметь два 1,2-дизаме- |
(1791—1867) |
|
|
||||||||
|
|
|
|||||||||
щенных изомера: |
|
|
|
Английский физик и химик, член Лон- |
|||||||
Х |
|
|
|
|
|
|
донского королевского общества |
(с 1824). |
|||
|
|
|
|
|
|
Учился самостоятельно. Научные иссле- |
|||||
|
|
|
Х |
|
|
Х |
дования начал в области химии. |
Открыл |
|||
|
|
|
|
|
(1825) бензол, изобутилен. Получил (1826) |
||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
α- и β-нафталинсульфокислоты и их соли. |
|||
|
|
|
|
|
|
|
Х |
Положил начало (1826) исследованиям |
|||
|
|
|
|
|
|
|
натурального каучука. Один из первых |
||||
|
|
|
|
|
|
|
|
||||
Экспериментально же было установле- |
изучал каталитические реакции. Впервые |
||||||||||
получил (1828) этилсерную кислоту при |
|||||||||||
но, что 1,2-дизамещенные бензолы не имеют |
взаимодействии этилена с серной кисло- |
||||||||||
изомеров положения, то есть они существу- |
|||||||||||
той. Установил (1833) количественные за- |
|||||||||||
ют в виде одного вещества. |
коны электролиза. Огромны его заслуги |
||||||||||
Для объяснения |
этого противоречия |
в области физики. Проводил исследования |
|||||||||
в 1872 году Кекуле выдвинул осцилляцион- |
по электромагнетизму. Создатель учения |
||||||||||
об электромагнитном поле. Ввел понятие |
|||||||||||
ную гипотезу, согласно которой три двойные |
«диэлектрическая проницаемость». |
||||||||||
связи в молекуле бензола не фиксированы, а непрерывно перемещаются (осциллируют) между двумя возможными положениями:
сновидение кекуле
Втечение почти 30 лет химики пытались разгадать строение соединения состава С6Н6. Моменты творческого прозрения иногда приходят во сне. Фридрих Кекуле (см. с. 21) во время работы над учебником (1861) неожиданно задремал. Ему приснились цепочки атомов углерода, переплетающиеся и сворачивающиеся, как змейки. Внезапно голова одной змеи схватила свой собственный хвост и образовала замкнутое кольцо. Впоследствии Кекуле высказал (1865) идею о циклическом строении молекулы.
Всвоей импровизированной речи на праздновании 25-й годовщины, посвященной
работе по циклической структуре бензола, он впервые сообщил о своем сновидении и подытожил: «Давайте учиться спать, и, возможно, тогда мы узнаем правду. Но при этом давайте остерегаться опубликовывать наши сновидения, пока они не будут проверены разбуженным разумом».

Глава 14
200
Правильно отражая некоторые свойства бензола, формула Кекуле тем не менее не согласовывалась с рядом установленных фактов. По-прежнему оставалось неясным, почему при наличии в молекуле трех двойных связей бензол проявляет значительную инертность в реакциях присоединения и гораздо более склонен
креакциям замещения, почему он устойчив к нагреванию и действию окислителей. Все это возвращало химиков к пересмотру структуры бензола.
Всоответствии с современными представлениями, основанными на данных квантовой химии и физико-химических исследований, молекула бензола представляет собой правильный плоский шестиугольник. Все углеродные атомы
находятся в состоянии sp2-гибридизации. Каждый атом углерода образует три σ-связи (одну С—Н и две С—С), лежащие в одной плоскости под углом 120° друг
кдругу (рис. 14.1, а) и предоставляет одну p-орбиталь для образования замкнутой сопряженной системы, электронная плотность которой равномерно распределена (делокализована) между углеродными атомами и сконцентрирована в основном над и под плоскостью σ-скелета молекулы (рис. 14.1, б ).
|
Í |
|
Í |
|
|
|
|
|
|
|
sð2 -ÀÎ |
||
|
|
|
|
|
|
|
|
|
|
атома углерода |
|||
|
Ñ |
Ñ |
|
120° |
|
|
|
|
|
|
|
|
|
|
Ñ |
120° Ñ |
|
|
|
|
|
|
|
|
|
||
Í |
Í |
|
|
|
|
|
|
|
|
|
|||
0,109 íì |
|
120° |
|
|
|
|
|
|
|
|
|
||
|
Ñ |
Ñ |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
0,139 íì |
|
|
|
|
|
|
|
|
s -ÀÎ |
|||
|
Í |
|
Í |
|
|
|
|
|
|
атома водорода |
|||
|
|
à |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π-облако |
|
|
Í |
Ñ |
Ñ |
Ñ |
Í |
Ñ |
|
|
Ñ |
Í |
|
|
|
|
|
Ñ |
|
Í |
Ñ |
Ñ |
|
|
|
|
||||
|
Í |
|
Í |
|
Í |
Í |
|
|
|
|
|
||
|
|
|
|
|
|
|
σ-связь |
|
|
||||
á
Рис. 14.1. Схема образования σ-связей (а) и замкнутой π-электронной системы (б) в молекуле бензола
Образование замкнутой сопряженной системы (ароматического секстета) является для молекулы бензола энергетически выгодным процессом. Экспериментально установлено, что сопряжение в цикле приводит к уменьшению энергии на 150,7 кДж/моль, то есть реально бензол оказался на 150,7 кДж/моль стабильнее, чем это можно было предположить, исходя из формулы Кекуле. Разность энергий реального состояния молекулы бензола и рассчитанной для гипотетической структуры — 1,3,5-циклогексатриена составляет энергию сопряжения, или энергию резонанса, и является причиной высокой устойчивости молекулы.
С позиций теории молекулярных орбиталей при перекрывании шести p-атомных орбиталей образуется шесть π-молекулярных орбиталей, из которых три — связывающие, а три — разрыхляющие π-МО. Каждая МО характеризуется

 CH
CH