
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
аЛиФаТические угЛеВодороды. аЛканы |
|
141 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ный < третичный атом углерода. Однако эта |
|
|||||||||||||
|
|
|||||||||||||
закономерность строго не выполняется. Ре- |
|
|
||||||||||||
гиоселективность галогенирования зависит |
|
|
||||||||||||
также от активности реагента (атома гало- |
|
|
||||||||||||
гена) и температуры. Чем активнее реагент, |
|
|
||||||||||||
тем ниже селективность реакции. Следова- |
|
|
||||||||||||
тельно, у алканов реакция бромирования |
|
|
||||||||||||
более селективна, чем хлорирования. Регио- |
|
|
||||||||||||
селективность галогенирования алканов воз- |
|
|
||||||||||||
растает при понижении температуры. |
|
|
||||||||||||
Радикальное йодирование алканов эндо- |
|
|
||||||||||||
термично и вследствие низкой реакционной |
|
|
||||||||||||
активности I• протекает с трудом. Реакция |
михаил иванович коноВаЛоВ |
|||||||||||||
обратима, так как образующийся йодоводо- |
||||||||||||||
род HI восстанавливает алкилйодид. |
(1858—1906) |
|||||||||||||
|
|
|||||||||||||
сульфохлорирование. Под действием се- |
Русский химик-органик. Ученик |
|||||||||||||
ры (IV) оксида и хлора в условиях УФ-облу- |
В. В. Марковникова. Окончил Мос- |
|||||||||||||
чения алканы образуют алкансульфонил- |
ковский университет (1884). Профес- |
|||||||||||||
хлориды (хлорангидриды алкансульфоновых |
сор Киевского политехнического уни- |
|||||||||||||
кислот, см. разд. 29.3): |
|
|
верситета с 1899 года, затем ректор |
|||||||||||
|
|
(1902—1904). |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
R—H + SO2+ Cl2 |
|
hν |
R—SO2Cl + HCl |
Основные научные работы по- |
||||||||||
|
|
священы изучению действия азотной |
||||||||||||
алкан |
|
|
|
|
|
|
|
|
|
|
алкансульфонил- |
кислоты на органические соединения. |
||
|
|
|
|
|
|
|
|
|
|
|
хлорид |
|||
|
|
|
|
|
|
|
|
|
|
|
Изучил нитрующее действие разбав- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Как и в случае галогенирования, реакция |
ленной азотной кислоты на алифа- |
|||||||||||||
сульфохлорирования |
алканов протекает по |
тические (реакция Коновалова), али- |
||||||||||||
цепному радикальному механизму (SR): |
циклические и жирноароматические |
|||||||||||||
углеводороды. Своей реакцией он, |
||||||||||||||
Cl··Cl |
|
hν |
|
|
|
Сl· + Сl· |
по словам Н. Д. Зелинского, «ожи- |
|||||||
|
|
|||||||||||||
R—H + Сl· |
|
|
|
|
|
R· + HCl |
вил химических мертвецов», какими |
|||||||
|
|
|
|
в то время считали парафиновые уг- |
||||||||||
|
|
|||||||||||||
R· + SO |
|
|
|
|
|
|
|
|
R—SO · |
леводороды. Разработал методы полу- |
||||
2 |
|
|
|
|
|
|
|
чения оксимов, альдегидов, кетонов |
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
и спиртов на основе нитросоедине- |
||
R—SO · |
|
|
|
|
|
|
|
|
|
R—SO |
Cl + Сl· и т. д. |
|||
+ Cl |
2 |
|
|
|
|
|
|
|
ний жирного ряда. |
|||||
|
|
|
|
|
|
|
||||||||
2 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
В результате реакции образуется смесь первичных и вторичных алкансульфонилхлоридов. Третичные сульфонилхлориды не образуются, очевидно, вследствие пространственных препятствий.
Реакция сульфохлорирования имеет важное значение в производстве синтетических моющих средств.
нитрование. Метод жидкофазного нитрования алканов, называемый реакцией Коновалова (1888), осуществляется с использованием разбавленной азотной кислоты (концентрация 10—20 %) при температуре 110—140 °С, нормальном или повышенном давлении:
R—H + HNO |
(разб.) |
t, p |
R—NO |
|
+ H |
O |
|
2 |
|||||
3 |
|
|
|
2 |
|
|
алкан |
|
|
нитроалкан |
|
|
|
Реакция протекает по свободнорадикальному механизму:

Глава 9
142
HO—NO2 t, p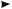 HO· + NO2·
HO· + NO2·
R—H + HO· 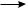 R· + H2O
R· + H2O
|
|
|
R· + HO—NO |
2 |
|
|
R—NO |
2 |
+ HO· |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Нитрование алканов характеризуется высокой региоселективностью: |
|
||||||||||||||||||
|
|
CH3 |
|
|
|
|
|
|
|
t, p |
|
|
|
|
CH3 |
|
|
|
|
CH |
—C—CH |
—CH |
|
+ HNO |
(разб.) |
CH |
—C—CH |
—CH |
|
+ H |
O |
||||||||
|
|
|
|||||||||||||||||
3 |
|
2 |
|
3 |
3 |
|
|
|
|
|
|
|
3 |
|
2 |
|
3 |
2 |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
||
изопентан |
|
|
|
|
|
|
|
|
2-метил-2-нитробутан |
|
|
|
|||||||
Концентрированная азотная кислота в обычных условиях не взаимодействует
салканами; при нагревании она действует главным образом как окислитель.
9.6.2.окисЛение аЛканоВ
Визбытке кислорода или на воздухе алканы сгорают с образованием углерода (IV) оксида и воды с выделением большого количества теплоты:
СН4 + 2О2 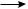 СO2 + 2Н2O + 882 кДж/моль
СO2 + 2Н2O + 882 кДж/моль
Окисление алканов кислородом воздуха в присутствии катализатора (солей марганца, хрома, свинца и др.) при температуре 150—200 °С приводит к образованию смеси продуктов, состоящей в основном из карбоновых кислот с различной длиной углеродной цепи, альдегидов, кетонов и спиртов. Реакция протекает по радикальному механизму и сопровождается разрывом углерод-углеродных связей. В качестве промежуточных продуктов окисления образуются органические гидропероксиды.
Схема окисления пропана:
|
|
|
|
|
|
|
t |
|
|
|
|
· |
|
|
|
O2 |
|
|
|
|
|
|
|
CH3—CH2—CH3 |
|||
CH |
—CH |
—CH |
|
|
|
|
|
CH |
—CH—CH |
|
|
|
CH |
—CH—CH |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
· |
|
|||||||||||||||
3 |
2 |
|
|
3 |
|
|
|
3 |
|
|
|
3 |
|
3 |
|
|
3 –CH3—CH—CH3 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O—O· |
|
|
|
|
|
|
|
|
|
CH —CH—CH |
|
|
|
|
CH —C O |
+ CH —OH + CH —C—CH |
|
+ H O |
|||||||||||||||||
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
3 |
|
|
|
|
|
3 |
|
|
|
3 |
|
H |
3 |
|
3 |
|
|
|
3 |
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
O—OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||||
|
|
гидропероксид |
|
|
|
|
|
уксусный |
|
|
|
|
метанол |
|
|
ацетон |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
альдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О2 |
|
|
|
|
|
О2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
CH3—C O |
|
|
H—C O |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
OH |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
уксусная |
|
|
|
|
муравьиная |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
|
|
|
кислота |
|
|
|
|
|
|
|
||||
Реакция окисления используется в промышленности для получения метанола, формальдегида, ацетальдегида и уксусной кислоты из пропана и бутана, а также высших жирных кислот из алканов с длиной цепи более 25 углеродных атомов.

аЛиФаТические угЛеВодороды. аЛканы
143
9.6.3. крекинг аЛканоВ
Крекинг — процесс термического расщепления алканов. Под действием высоких температур алканы разлагаются с разрывом связей С—С и С—Н. Одновременно протекают процессы дегидрирования, изомеризации и циклизации. Начальная температура распада алканов зависит от их строения и молекулярной массы. Чем больше молекулярная масса углеводорода, тем легче он расщепляется при нагре-
вании. Различают термический крекинг и каталитический крекинг. Термический крекинг проводят при температуре 800 °С и выше, каталитический — при температуре 450—550 °С в присутствии алюмосиликатных катализаторов (алюминия оксид Аl2О3 на силикагеле SiO2).
Наиболее устойчив к термическому разложению метан. В интервале температур 1400—1500 °С он подвергается распаду с образованием ацетилена:
2СН4 1400—1500 °С 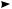 НC—СН + 3Н2
НC—СН + 3Н2
Этан разлагается при более низких температурах:
CH3—CH3 600—800 °С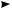 H2C—CH2 + Н2
H2C—CH2 + Н2
Высшие алканы в условиях термического крекинга разлагаются с образованием сложной смеси низших алканов и алкенов. Разрыв углеродной цепи молекулы может произойти в любом положении:
|
|
|
|
|
|
|
|
|
СH4 + H2С—CH—CH2—CH2—CH3 |
|
|
|
|
|
|
|
|
|
|
CH |
—CH |
—CH |
—CH |
—CH |
—CH |
|
t |
|
CH3—CH3 + H2С—CH—CH2—CH3 |
|
|
||||||||
|
|
|
|||||||
3 |
|
|
|
||||||
3 |
2 |
2 |
2 |
2 |
|
|
|
CH3—CH2—CH3 + H2С—CH—CH3 |
|
|
|
гексан |
|
|
|
|
|
||
|
|
|
|
|
|
|
CH3—CH2—CH2—CH3 + H2С—CH2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Термический крекинг протекает по радикальному механизму. При каталитическом крекинге расщепление углерод-углеродной связи сопровождается преимущественно изомеризацией н-алканов в алканы с разветвленной цепью:
2CH3—CH2—CH2—CH2—CH2—CH3 |
Al2O3; 500 °C |
|
|
CH3 |
|
гексан |
|
|
CH3—CH—CH—CH3 + CH3—C—СH2—CH3
CH3 CH3 |
CH3 |
2,3-метилбутан |
2,2-метилбутан |
В присутствии катализатора высшие алканы способны к циклизации с образованием ароматических углеводородов:
Cr2O3; Al2O3; 500 °C |
CH3 |
|
CH3—CH2—CH2—CH2—CH2—CH2—CH3 |
|
+ 4H2 |
|
||
гептан |
толуол |
|
Каталитический крекинг протекает по ионному механизму.

Глава 9
144
Крекинг-процесс имеет важное промышленное значение и широко используется для получения высокооктановых бензинов, непредельных и ароматических углеводородов.
9.7. ИДЕНТИФИКАЦИЯ АЛКАНОВ
Химические методы для идентификации алканов не используются. Алканы идентифицируют по физическим константам (температуры кипения и плавления, показатель преломления, удельное вращение для оптически активных веществ и др.) и спектральным характеристикам.
Алканы поглощают УФ-излучение в области менее 200 нм, поэтому жидкие алканы используют в качестве растворителей для измерения электронных спектров других веществ. Для ИК-спектров алканов характерны полосы поглощения
вобласти 3000—2850 см–1, отвечающие валентным колебаниям связей С—Н,
ив области 1470—1370 см–1, характеризующие деформационные колебания связей С—Н.
ВПМР-спектрах алканов разные по расположению протоны имеют близкие значения химических сдвигов (0,5—2 млн–1), что затрудняет интерпретацию ПМР-спектров.
Впоследние годы достигнуты большие успехи при идентификации алканов методом масс-спектрометрии.
9.8. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ. ПРИМЕНЕНИЕ
метан сн4. Бесцветный газ (н. у.), не имеющий запаха, малорастворимый в воде. Метан является основной составной частью природного газа. Он широко используется в качестве промышленного и бытового топлива, а также служит важным сырьем для химической промышленности. Из метана получают ацетилен, метиловый спирт, формальдегид, хлороформ, четыреххлористый углерод, газовую сажу и другие вещества.
Этан с2н6, пропан с3н8, бутан с4н10. Бесцветные газы (н. у.), без запаха. Пропан и бутан легко сжижаются, что позволяет использовать их в быту в качестве топлива (баллонный сжиженный газ). Данные алканы, подобно метану, широко используют в химической промышленности в качестве сырья для получения этилена, пропилена, бутадиена и других веществ, имеющих важное практическое значение.
Вазелиновое масло — бесцветная маслянистая жидкость, без запаха и вкуса, практически нерастворимая в воде. По химической структуре представляет собой смесь алканов состава С1—С15. Применяют в медицине как слабительное средство, в фармации — при изготовлении лекарственных форм, а также в парфю- мерно-косметической промышленности как компонент косметических кремов и мазей.
Вазелин — бесцветное или светло-желтого цвета однородное вещество, практически нерастворимое в воде. В химическом отношении представляет смесь жидких и твердых алканов состава С12—С25. Вазелин широко используют в фармации в качестве основы для приготовления мазей.

аЛиФаТические угЛеВодороды. аЛканы
145
Петролейный эфир — смесь жидких насыщенных алифатических углеводородов, главным образом разветвленного строения состава С5—С6. Получают путем отгонки легких фракций бензина. Используют как растворитель смол, жиров, эфирных масел и других неполярных веществ.
Парафин — белая твердая мелкокристаллическая масса, без запаха и вкуса, слегка жирная на ощупь, нерастворимая в воде. Температура плавления 45— 65 °С. Парафин состоит из смеси твердых алканов состава С19—С35. Применяют в фармации в качестве основы для приготовления мазей. В связи с большой теплоемкостью и низкой теплопроводностью парафин используют в медицине для лечения теплом (парафинотерапия).
озокерит (горный воск) — твердая воскообразная масса черного цвета. Температура плавления около 80 °С. Это ископаемое вещество нефтяного происхождения. По химической структуре представляет собой смесь высших алканов и алкенов, смол и минеральных масел. Как и парафин, озокерит применяют в медицине для лечения теплом при невралгиях, невритах, плекситах и других заболеваниях.

Глава 10
АЛКЕНЫ
Алкенами называют алифатические углеводороды, содержащие двойную углерод углеродную связь.
Общая формула алкенов CnH2n.
Родоначальником гомологического ряда алкенов является этилен (табл. 10.1), что обусловило еще одно их название « этиленовые углеводороды». Сохранилось также исторически сложившееся название «олефины» (маслообразующие), поскольку низшие гомологи этой группы соединений при взаимодействии с хлором или бромом образуют маслянистые жидкости.
Таблица 10.1
Представители гомологического ряда алкенов
|
Соединение |
Название по номенклатуре |
||
|
|
|
||
систематической |
тривиальной |
|||
|
|
|||
|
|
|
|
|
Н2С=СН2 |
Этен |
Этилен |
||
|
|
|
|
|
Н2С=СН—СН3 |
Пропен |
Пропилен |
||
|
|
|
|
|
Н2С=СН–СН2—СН3 |
1-Бутен |
α-Бутилен |
||
|
|
|
|
|
СН3—СН=СН—СН3 |
2-Бутен |
β-Бутилен |
||
|
|
|
|
|
Н2С=С—СН3 |
2-Метилпропен |
Изобутилен |
||
СН3 |
||||
|
|
|||
|
|
|
|
|
Н2С=СН—СН2—СН—СН2 |
1-Пентен |
α-Амилен |
||
|
|
|
|
|
СН3—СН=СН—СН2—СН3 |
2-Пентен |
β-Амилен |
||
|
|
|
|
|
10.1. НОМЕНКЛАТУРА
Согласно правилам IUPAС названия алкенов образуют от названий соответствующих алканов, заменяя суффикс -ан на -ен с указанием положения двойной связи в цепи углеродных атомов (см. табл. 10.1).
Н2С—СН2 |
Н2С—СН—СН3 |
СН3—СН—СН—СН3 |
этен |
пропен |
2-бутен |
При построении названий алкенов по заместительной номенклатуре IUPAС используют следующие правила:
1. Выбирают самую длинную углеродную цепь, включающую двойную связь
(главная углеродная цепь).

аЛкены
147
2.Углеродные атомы главной цепи нумеруют, начиная с того конца цепи,
ккоторому ближе расположена двойная связь.
3.Составляют название алкена, перечисляя вначале в алфавитном порядке углеводородные заместители с указанием их положения в главной цепи, затем называют углеводород, которому соответствует главная углеродная цепь. Перед названием углеводорода через дефис ставят цифру (локант), указывающую положение двойной связи (номер первого из двух углеродных атомов, образующих двойную связь).
|
|
|
4 |
3 |
2 |
1 |
|
|
|
|
|
|
|
|
|
СН3—СН2—СН—СН2 |
|
|
|
|
|||
|
|
|
|
|
|
1-бутен |
|
|
|
|
|
1 |
2 |
3 |
4 |
СН3 |
|
|
2 |
3 |
4 |
5 |
|
|
|
|
|||||||||
СН3—СН—СН—С—СН3 |
СН3—СН2—С—СН2— |
СН—СН3 |
|||||||||
|
|
|
5 |
|
6 |
|
1 |
|
СН3 |
|
|
|
|
|
СН2—СН3 |
|
СН2 |
|
|
||||
|
4,4-диметил-2-гексен |
|
|
4-метил-2-этил-1-пентен |
|
||||||
Для низших членов гомологического ряда алкенов применяют также тривиальные названия — этилен, пропилен, бутилен и так далее (см. табл. 10.1), причем название первого представителя — этилен — принято правилами IUPAС как более предпочтительное, чем этен.
Название одновалентных углеводородных радикалов, образованных из алкенов, составляют путем добавления к названию алкена суффикса -ил:
Н2С—СН— |
3 |
2 |
1 |
3 |
2 |
1 |
СН3—СН—СН— |
Н2С—СН—СН2— |
|||||
этенил |
|
1-пропенил |
|
2-пропенил |
||
Некоторые радикалы имеют также тривиальные названия:
Н2С—СН— СН3—С—СН2 Н2С—СН—СН2—
винил |
изопропенил |
аллил |
10.2. ИЗОМЕРИЯ
Для алкенов характерна структурная и геометрическая изомерия. Структурная изомерия алкенов обусловлена различной последовательностью
связывания атомов углерода в молекуле (изомерия цепи) и различным положением двойной связи при одном и том же углеродном скелете (изомерия положения). Такой вид изомерии возможен, начиная с бутена С4Н8, который может существовать в виде трех структурных изомеров:
изомеры цепи
H2C—CH—CH2—CH2—CH3 H2C—CH—CH—CH3 СH3—CH—CH—СH2—СH3
|
|
СH3 |
|
|
1-ïåíòеí |
3-метил-1-áóòеí |
2-ïåíòеí |
||
|
|
|
|
|
|
изомеры |
положения |
|
|
|
|
|
||
|
|
|
|
|

Глава 10
148
Кроме того, в ряду алкенов имеет место геометрическая, или так называемая цис-транс-изомерия, что обусловлено различным расположением атомов или групп в пространстве относительно плоскости двойной связи (см. с. 86). Так, 2-бутен может существовать в виде двух пространственных изомеров — цис- (два одинаковых заместителя при атомах углерода двойной связи расположены по одну сторону от плоскости π-связи) и транс- (два одинаковых заместителя расположены по разные стороны относительно плоскости π-связи):
H3C C |
C CH3 |
H3C C |
— |
C H |
— |
|
|
|
|
H |
H |
H |
|
CH3 |
цис-2-бутен |
транс-2-бутен |
|||
Если у атомов углерода, связанных двойной связью, имеется три или четыре разных заместителя, используют Е,Z-систему обозначений конфигурации геометрических изомеров (см. с. 86):
H3C |
CH2CH3 |
H3C |
CH2CH2CH3 |
|
C—C |
|
C—C |
CH3CH2 |
CH2CH2CH3 |
CH3CH2 |
CH2CH3 |
Z-3-метил-4-этил-3-гептен |
Е-3-метил-4-этил-3-гептен |
||
Как видно, 3-метил-4-этил-3-гептен может иметь Z-конфигурацию (старшие заместители при атомах углерода с двойной связью расположены по одну сторону относительно плоскости π-связи) и Е-конфигурацию (старшие заместители расположены по разные стороны относительно плоскости π-связи).
E,Z-Система является более универсальной и используется для обозначения геометрических изомеров с различным набором заместителей.
10.3. СПОСОБЫ ПОЛУЧЕНИЯ
В небольших количествах алкены встречаются в некоторых месторождениях нефти и природного газа, откуда могут быть выделены в чистом виде. Как отмечалось ранее (см. разд. 9.6.3), алкены образуются также при термическом крекинге высших алканов.
Большинство методов синтеза основаны на элиминировании (отщеплении) атомов или атомных групп от молекул алканов, галогеналканов и спиртов.
дегидратация предельных спиртов. Предельные спирты при нагревании с сильными минеральными кислотами — серной или фосфорной — отщепляют молекулу воды и образуют соответствующие алкены:
СН2—СН2 H2SO4; t 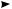 Н2С—СН2 + Н2O
Н2С—СН2 + Н2O
НOН
этанол |
этилен |
Механизм реакции приведен в подразд. 22.1.5.
В промышленности дегидратацию осуществляют при пропускании паров спирта над катализатором — алюминия оксидом Аl2О3 при температуре 300—400 °С:

аЛкены
149

Глава 10
150
дегалогенирование дигалогеналканов. Дигалогеналканы с атомами галогена у соседних атомов углерода при действии цинка или магния в водно-спиртовом растворе отщепляют два атома галогена, образуя алкены:
СН3— |
|
СН—СH—СН3 + Zn |
|
СH3—СН—СH—СН3 + ZnBr2 |
|
||||
|
|
|||
|
|
|
|
|
Br Br |
|
|
||
2,3-дибромбутан |
2-бутен |
|||
дегидрирование алканов (промышленный метод). При температуре 300—500 °С
в присутствии катализаторов (мелкораздробленный никель, хрома (III) оксид Cr2O3 и др.) алканы отщепляют водород, образуя алкены:
СН3—СН2—СН3 |
Ni |
СH3—СН—СН2 |
+ H2 |
|
|||
пропан |
|
пропен |
|
селективное гидрирование алкинов. В присутствии катализаторов с пониженной активностью (Fе, частично дезактивированные «отравленные» солями тяжелых металлов Pd и Pt) алкины селективно (избирательно) присоединяют водород с образованием алкенов:
НС—С—СН3 |
H2; Pd/PbCO3 |
H2С—СН—СН3 |
|
||
ïðîïиí |
|
пропен |
10.4. ФИЗИЧЕСКИЕ СВОЙСТВА
Первых четыре представителя гомологического ряда алкенов подобно алканам при нормальных условиях — газы, далее следуют жидкости (С5—С17), затем — твердые вещества.
Все алкены практически нерастворимы в воде, хорошо растворяются в органических растворителях.
Температуры кипения алкенов неразветвленного строения, как правило, выше, чем их изомеров с разветвленной цепью углеродных атомов. Цис-изомеры по сравнению с транс-изомерами имеют обычно более высокие температуры кипения и более низкие температуры плавления.
10.5. ХИМИЧЕСКИЕ СВОЙСТВА
Главной структурной особенностью, определяющей реакционную способность алкенов, является наличие в их молекуле двойной углерод-углеродной связи. Атомы углерода, связанные двойной связью, находятся в состоянии sp2-гиб- ридизации. Двойная связь (см. с. 47) представляет собой сочетание ковалентных σ-связи и π-связи, из которых π-связь менее прочная. Электронная плотность π-связи расположена симметрично выше и ниже плоскости, в которой лежат σ-связи sp2-гибридизованных атомов углерода (рис 10.1).
Благодаря такому расположению электроны π-связи легче поляризуются по сравнению с электронами σ-связи. Вследствие высокой поляризуемости и низкой энергии образования π-связи алкены довольно легко вступают в реакции присоединения, протекающие с разрывом π-связи. В большинстве случаев такие реакции идут по ионному механизму и начинаются с атаки электрофильным ре-

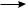 СН
СН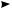
 СH
СH