
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
химическаЯ сВЯзь |
|
|
|
|
|
|
|
|
|
|
|
41 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3.1 |
||
строение электронных оболочек атомов водорода, углерода, азота и кислорода |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Элемент |
|
|
|
|
|
|
Тип орбиталей |
|
|
|
|
Электронная |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1s |
2s |
2px |
2py |
2pz |
конфигурация |
|||||||||||
|
||||||||||||||||
|
|
|
||||||||||||||
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
1s |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
1s22s22p2 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
1s22s22p3 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
1s22s22p4 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
с противоположными спинами. При этом атомные орбитали сохраняют свою индивидуальность, а пара электронов локализуется в пространстве между ядрами атомов. Применение метода ВС для описания молекулы сводится к составлению максимального числа так называемых резонансных структур и рассмотрению реальной молекулы как гибрида данных структур.
Резонансными, или граничными, называют структуры, отличающиеся только расположением электронов.
Например, молекулу водорода Н—Н можно представить как гибрид граничных структур Н+Н– 
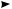 Н–Н+ (
Н–Н+ (
 — обозначение резонанса). Теория резонанса применяется в основном для качественной оценки реакционной способности органических соединений.
— обозначение резонанса). Теория резонанса применяется в основном для качественной оценки реакционной способности органических соединений.
Вметоде МО тоже исходят из допущения, что ковалентная связь образуется
врезультате перекрывания одноэлектронных АО. Однако, в отличие от метода ВС, атомные орбитали здесь не сохраняют своей индивидуальности, а вместо них образуется такое же количество орбиталей нового типа, называемых молекулярными орбиталями (МО). Из двух АО образуется две МО, из четырех — четыре, из шести — шесть и т. д. Молекулярные орбитали отличаются от атомных тем, что электронные облака окружают ядро уже не одного атома, а двух или нескольких. Для образования МО необходимо, чтобы атомные орбитали имели близкие энергии, одинаковую симметрию относительно линии связи в молекуле и достаточную для перекрывания протяженность в пространстве. На рис. 3.3 представлена схема образования ковалентной связи в молекуле водорода.
Emax
Энергия
Emin
σ (разрыхляющая МО) |
|
|
|
|
|
|
|
|
|
|
|
|
σ (разрыхляющая МО) |
||||||||
ÀÎ |
ÀÎ |
|
|
ÀÎ |
ÀÎ |
|
|
|||
|
|
|
|
|||||||
|
|
|
|
|||||||
1s |
|
|
|
|
|
|
|
|
|
|
1s |
H |
|
|
|
|
|
|
H |
||
σ (связывающая МО) |
|
|
σ (связывающая МО) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H—H
Рис. 3.3. Схема образования ковалентной связи Н–Н
Глава 3
42
Как видно, перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей. Одну из них, имеющую более низкую энергию, чем исходные АО, называют связывающей орбиталью, другую, которая обладает более высокой энергией, чем образующая ее АО, называют разрыхляющей, или антисвязывающей, орбиталью. Заполнение молекулярных орбиталей электронами происходит аналогично заполнению атомных, то есть по принципу Паули и в соответствии с правилом Гунда. Вначале электроны занимают более низкие по энергии связывающие орбитали, что приводит к образованию химической связи между атомами. Молекулярная разрыхляющая орбиталь в основном состоянии остается вакантной. Ее заполнение электронами происходит при возбуждении молекулы, что ведет к разрыхлению связи и распаду молекулы на атомы. Таким образом, согласно методу МО образование ковалентной связи представляется как переход двух электронов с атомных орбиталей на связывающую молекулярную орбиталь.
Наряду со связывающими и разрыхляющими МО существуют несвязывающие молекулярные орбитали, на которых располагаются неподеленные пары электронов.
3.2.1. гиБридизаЦиЯ аТомных орБиТаЛеЙ
Согласно квантово-механической теории химической связи число образуемых атомом ковалентных связей определяется количеством одноэлектронных атомных орбиталей, то есть количеством неспаренных электронов. Однако в действительности атомы некоторых элементов образуют большее число ковалентных связей по сравнению с количеством неспаренных электронов в основном состоянии. Так, атом углерода в основном состоянии имеет два неспаренных электрона, но, как известно, в органических соединениях он образует четыре ковалентные связи. Это можно объяснить, если представить, что один из 2s-электронов переходит на вакантную 2рz-орбиталь:
1s |
2s |
2px |
2py |
2pz |
|
|
1s |
2s |
2px |
2py |
2pz |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
основное состояние атома углерода |
|
возбужденное состояние атома углерода |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В таком состоянии, называемом возбужденным, атом углерода имеет четыре одноэлектронные орбитали. Поскольку валентные орбитали углерода неравноценны (одна — s, а три — р), то и ковалентные связи, образованные с их участием, не должны быть эквивалентными. В действительности же, например, в молекуле метана СН4 все четыре ковалентные связи С—Н равноценны. Для объяснения этого факта в квантово-механической теории химической связи введено математически обоснованное понятие о гибридизации атомных орбиталей.
Сущность гибридизации заключается в том, что из нескольких различных по форме и близких по энергии атомных орбиталей образуется такое же число одинаковых по форме и энергии гибридных орбиталей. Например, при взаимодействии одной s- и трех р-атомных орбиталей образуются четыре гибридные орбитали.

химическаЯ сВЯзь
43
По форме гибридная орбиталь отличается как от s-, так и от р-орбиталей, представляя собой несимметричную объемную восьмерку: . Гибридные орбитали являются атомными орбиталями, но возникают они только в процессе образования химической связи и не отражают реальной структуры свободного атома. В результате перекрывания большей доли гибридной орбитали с атомными орбиталями других атомов образуется ковалентная связь. По сравнению с негибридизованными гибридные орбитали более выгодны геометрически и в результате большего перекрывания с орбиталями других атомов образуют более прочные связи.
Для атома углерода характерны три типа гибридизации с участием s- и р-ор- биталей: sр3-, sр2- и sр-гибридизация. Каждому из этих видов соответствует определенное валентное состояние атома.
sр3-гибридизация атома углерода (первое валентное состояние). При sр3-гибри-
дизации из одной s- и трех р-орбиталей образуются четыре качественно новые, равноценные sр3-гибридные орбитали, направленные в пространстве под углом 109° 28′ (от центра правильного тетраэдра к его вершинам). Поэтому sр3-гибриди-
зацию называют еще тетраэдрической.
Исходя из схемы, приведенной на рис. 3.4, можно условно представить, что доля s-облака в гибридных sр3-орбиталях равна 1/4. В первом валентном состоянии атом углерода образует только простые ковалентные связи.
z |
y |
|
z |
|
y |
|
z |
|
y |
|
z |
|
y |
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|||||||
|
|
+ |
|
|
|
+ |
|
|
|
+ |
|
|
|
|
x |
|
|
x |
|
|
x |
|
|
x |
|||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2s-орбиталь |
|
2px-орбиталь |
|
2py-орбиталь |
|
2pz-орбиталь |
|||||||
à
109° 28′ |
z |
|
sp3 |
y |
|
||||
|
|
|||
|
|
|
|
|
|
|
|
|
sp3 x |
sp3 |
|
|
sp |
3 |
|
|
|
|
|
четыре sp3- |
|
гибридные орбитали |
||
á
Рис. 3.4. Строение атома углерода в sр3- гибридизации:
а — схема образования гибридных sр3-орбиталей; б — взаимное расположение орбиталей при sр3-гибридизации
sр2-гибридизация атома углерода (второе валентное состояние). sр2-Гибриди-
зация осуществляется в результате взаимодействия одной s- и двух р-орбиталей (рх, pу). В результате образуются три эквивалентные sр2-гибридные орбитали, которые лежат в одной плоскости под углом 120°. Поэтому sр2-гибридизацию называют еще тригональной. Оставшаяся негибридизованной рz-орбиталь расположена в плоскости, перпендикулярной к плоскости гибридных орбиталей (рис. 3.5).

Глава 3
44
|
|
|
|
|
|
|
|
z |
z |
y |
|
z |
y |
|
z |
y |
y |
|
|
|
120° |
|||||
|
x |
+ |
|
x |
+ |
|
x |
x |
2s-орбиталь |
|
2px-орбиталь |
|
2py-орбиталь |
òðè sp2-гибридные орбитали |
|||
|
|
|
|
|
|
à |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
z |
y |
|
|
|
|
|
90° |
|
2pz |
|
|
|
|
|
|
|
|
sp2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sp2 |
sp2 |
x |
|
|
|
|
|
|
|
120° |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3.5. Строение атома углерода |
|
|
|
|
|
|
|
|
|
в sр2-гибридизации: |
|
2 |
|
+ pz-орбиталь |
|
а — схема образования гибридных sр2-орбиталей; |
|||
òðè sp -орбитали |
|
|
б — взаимное расположение орбиталей |
|||||
|
|
|
á |
|
|
|
|
при sр2-гибридизации |
|
|
|
|
|
|
|
|
|
аллотропные модификации углерода
В свободном состоянии углерод существует в трех аллотропных модификациях — алмаз, графит, фуллерены, которые отличаются структурой кристаллической решетки.
алмаз |
графит |
фуллерен С60 |
Прочную структуру алмаза определяет тетраэдрическая конфигурация sp3-гибридизо- ванных атомов углерода. Алмаз — октаэдрический кристалл. Имеет наибольшую твердость среди всех природных веществ. Шлифуется только собственным порошком. Ограненные алмазы называют бриллиантами. Алмаз не проводит электрический ток. При температуре 1500 °С превращается в графит.
Тригональная конфигурация sp2-гибридизованных углеродных атомов определяет плоскую гексагональную решетку графита. Слои гексагональных структур удерживаются за счет слабых вандерваальсовых сил. Графит мягок, легко расщепляется на слои, оставляя след на твердой поверхности. Проводит электрический ток, сублимируется при температуре выше 3800 °С. Среди продуктов возгонки графита была обнаружена третья модификация углерода — фуллерены (см. с. 222).
химическаЯ сВЯзь
45
Условно доля s-облака в sр2-гибридных орбиталях равна 1/3. Атом углерода в sр2-гибридизации образует двойную связь.
sр-гибридизация атома углерода (третье валентное состояние). sр-Гибриди-
зация возникает в результате слияния одной s- и одной р-орбиталей (рх). При этом образуются две sр-гибридные орбитали, расположенные друг к другу под углом 180о. Отсюда sр-гибридизацию называют линейной. Негибридизованные рy- и рz-орбитали расположены во взаимно перпендикулярных плоскостях и под прямыми углами к sр-гибридным орбиталям (рис 3.6).
z  y z
y z  y
y 
|
+ |
|
|
x |
x |
||
|
|||
2s-орбиталь |
|
2px-орбиталь |
à
z90° y
90° |
pz |
py |
|
||
|
|
|
|
|
|
sp |
|
x |
|
sp |
äâå sp-гибридные и py-, pz-орбитали
á
z 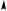 y
y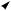

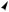 x
x
180° äâå sp-гибридные орбитали
Рис. 3.6. Строение атома углерода
вsр-гибридизации:
а— схема образования гибридных sр-орбиталей;
б— взаимное расположение орбиталей при sр-гибридизации
Доля s-облака в гибридных sр-орбиталях равна 1/2. Атом углерода в состоянии sp-гибридизации образует тройную связь.
Следует отметить, что наряду с тремя предельными вариантами гибридизации s- и р-орбиталей существует много промежуточных типов. Для экспериментальной оценки характера гибридной орбитали с успехом используют ЯМР-спектро- скопию.
3.2.2.коВаЛенТные σ- и π-сВЯзи
Взависимости от способа перекрывания атомных орбиталей различают ковалентные связи двух типов: σ- (греч «сигма») связи и π- (греч «пи») связи.
σСвязью называют одинарную ковалентную связь, образованную в результате перекрывания атомных орбиталей вдоль линии, соединяющей ядра двух связываемых атомов (σ-перекрывание) (рис 3.7).
Возникающие при этом молекулярные орбитали называют соответственно σ-МО (связывающая молекулярная орбиталь) и σ*-МО (разрыхляющая молекулярная орбиталь) (см. рис. 3.3). Максимальная электронная плотность при σ-пе- рекрывании находится на оси, соединяющей ядра двух связываемых атомов.
В большинстве органических соединений σ-связи образуются преимущественно за счет перекрывания гибридных sр3-, sр2- и sр-орбиталей, которые

46 |
|
|
|
|
|
|
|
|
Глава 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
à |
á |
|
|||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
â |
ã |
|
|||||||
Рис. 3.7. Схема перекрывания атомных орбиталей при образовании σ-связи:
а — тип s–s; б — тип s–p; в — тип s–sp3; г — тип sp3–sp3
являются более выгодными энергетически и обеспечивают более эффективное перекрывание (рис. 3.8). В молекуле этана σ-связи С—Н образуются в результате осевого s—sр3-перекрывания, а σ-связь С—С — за счет sр3–sр3-перекрывания орбиталей. Поскольку максимальная электронная плотность при σ-перекрывании сосредоточена в пространстве между ядрами атомов, σ-связь обладает большой прочностью.
H
H
H
s-AO атома водорода
H |
|
|
H |
|
H |
|
|
|
|
H |
|
|
|
|
|
|
H |
|
H |
|
|
||
|
|
|
sp3-AO атома углерода
H
H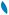
H
σ-перекрывание
HH
σσ
H σ C σ C σ H
σσ
HH
Рис. 3.8. Образование σ-связей в молекуле этана СH3—CH3
Наряду с перекрыванием атомных орбиталей вдоль оси, соединяющей ядра атомов, существует так называемое боковое перекрывание атомных орбиталей. В нем принимают участие только параллельно расположенные р-атомные орбитали.
Боковое перекрывание р-орбиталей называют π-перекрыванием, а образующуюся связь — π-связью (рис. 3.9).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π*- |
орбиталь |
||||
|
|
|
(разрыхляющая) |
|||||
π-перекрывание |
|
|
||||||
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π-орбиталь (связывающая)
Рис. 3.9. Схема перекрывания атомных орбиталей при образовании π-связи

химическаЯ сВЯзь
47
В результате π-перекрывания двух р-атомных орбиталей образуются две молекулярные π-орбитали, одна из которых называется π-связывающей МО, другая — π*-разрыхляющей МО. В основном состоянии оба электрона занимают связывающую π-орбиталь, что приводит к образованию π-связи. Максимальная электронная плотность π-связи сконцентрирована в двух областях — выше
иниже оси, соединяющей ядра атомов. Поэтому π-связь является менее прочной, чем σ-связь. Образуется π-связь только между атомами, которые находятся в sp2-
иsр-гибридном состоянии (рис. 3.10).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
à |
|
|
á |
|||||||||||||
Рис. 3.10. Образование π-связи в молекуле этилена H2C=CH2:
а— атомно-орбитальная модель этилена; б — π-связь
Вмолекуле этилена (рис. 3.10, 10.1) атомы углерода находятся в sp2-гибриди-
зации. σ-Перекрывание трех гибридизованных орбиталей каждого из атомов углерода приводит к уже рассмотренным σ-связям (две С—Н и одну С—С). π-Пере- крывание двух негибридизованных р-орбиталей дает углерод-углеродную π-связь.
Витоге между атомами углерода образуется двойная связь, которая представляет собой сочетание σ- и π-связей. При этом π-связь расположена в плоскости, перпендикулярной плоскости σ-связи.
Аналогично образуется π-связь между атомами, находящимися в sp-гибриди- зованном состоянии.
pz |
pz |
|
|
py |
py |
a |
á |
Рис. 3.11. Образование π-связей в молекуле ацетилена:
а— атомно-орбитальная модель ацетилена; б — π-связи
Вмолекуле ацетилена (рис. 3.11, 12.1) углеродные атомы находятся в sp-гиб- ридизации и образуют между собой тройную связь, которая состоит из одной

Глава 3
48
σ- и двух π-связей. σ-Связь возникает за счет перекрывания sр-гибридизованных орбиталей, а четыре р-орбитали образуют две π-связи, расположенные во взаимно перпендикулярных плоскостях.
В зависимости от количества электронных пар, принимающих участие в образовании химической связи между двумя атомами, различают простые и кратные ковалентные связи. Простые связи, их еще называют одинарными, представлены всегда σ-связью. В состав кратных связей наряду с σ-связью входит также π-связь.
Различают двойные и тройные кратные связи.
3.2.3. осноВные харакТерисТики коВаЛенТноЙ сВЯзи
длина связи. Длиной связи называют расстояние между центрами связанных в молекуле атомов. Для определения длины связи применяют дифракцию рентгеновских лучей, дифракцию электронов и спектроскопические методы. Поскольку атомы в молекуле находятся в постоянном колебательном движении, длины связей являются приближенными величинами. В табл. 3.2 приведены длины наиболее распространенных ковалентных связей.
|
|
|
|
|
|
|
|
Таблица 3.2 |
|
|
|
длины химических связей |
|
|
|
||
|
|
|
|
|
|
|
|
|
Связь |
|
Длина |
|
|
Связь |
|
Длина |
|
|
|
|
|
|
|
|
||
° |
нм |
|
пм |
° |
нм |
пм |
||
|
|
|
||||||
|
А |
|
|
А |
||||
Сsp3—H |
1,11 |
0,111 |
|
111 |
C—N |
1,16 |
0,116 |
116 |
Сsp3—Сsp3 |
1,54 |
0,154 |
|
154 |
C—F |
1,39 |
0,139 |
139 |
Сsp2=Сsp2 |
1,34 |
0,134 |
|
134 |
C—Cl |
1,78 |
0,178 |
178 |
Сsp—Сsp |
1,20 |
0,120 |
|
120 |
C—Br |
1,93 |
0,193 |
193 |
C—O |
1,43 |
0,143 |
|
143 |
C—I |
2,14 |
0,214 |
214 |
|
|
|
|
|
|
|
|
|
C=O |
1,21 |
0,121 |
|
121 |
O—H |
0,96 |
0,096 |
96 |
|
|
|
|
|
|
|
|
|
C—N |
1,47 |
0,147 |
|
147 |
N—H |
1,01 |
0,101 |
101 |
|
|
|
|
|
|
|
|
|
C=N |
1,28 |
0,128 |
|
128 |
S—H |
1,30 |
0,130 |
130 |
|
|
|
|
|
|
|
|
|
В химической литературе длины связей чаще приводятся в ангстремах (А° ) или нанометрах (нм). В международной системе единиц (СИ) в качестве единицы длины связи применяют пикометры, сокращенно пм (1 нм = 10 А° = 1000 пм). Как видно из приведенных данных (табл. 3.2), длина связи зависит от природы и типа гибридизации атомов, образующих связь. Чем больше s-характер атомов углерода, тем прочнее связь между ними. Чаще всего это объясняют увеличением s-характера гибридной орбитали и увеличением площади перекрывания орбиталей.
Энергия связи. Энергией связи называют энергию, выделяющуюся при образовании химической связи между двумя свободными атомами, или же энергию, которую необходимо затратить на разъединение двух связанных атомов.
Образование связи всегда сопровождается выделением, а ее разрыв — затратой определенного количества энергии. Энергия, необходимая для гомолитического (А·|·В) расщепления отдельной связи в молекуле, называется энергией диссоциации связи. Поскольку энергия диссоциации зависит от структуры молекулы, для

химическаЯ сВЯзь
49
характеристики энергии связи обычно используют средние значения энергии диссоциации. Энергию связи выражают в килоджоулях на моль (кДж/моль) или в килокалориях на моль (ккал/моль). Значение энергии связи служит мерой ее прочности. В табл. 3.3 приведены значения энергии связей, наиболее распространенных в органических соединениях.
|
значения энергии ковалентных связей* |
|
Таблица 3.3 |
|||
|
|
|
||||
Связь |
Энергия |
Связь |
Энергия |
|||
|
|
|
|
|||
кДж/моль |
ккал/моль |
кДж/моль |
ккал/моль |
|||
|
|
|||||
|
|
|
|
|
|
|
Сsp3—H |
414 |
99 |
C—N |
890 |
213 |
|
Сsp3—Сsp3 |
347 |
83 |
C—F |
427 |
102 |
|
Сsp2=Сsp2 |
610 |
146 |
C—Cl |
339 |
81 |
|
Сsp—Сsp |
836 |
200 |
C—Br |
284 |
68 |
|
C—O |
368 |
88 |
C—I |
213 |
51 |
|
C=O |
724 |
173 |
O—H |
464 |
111 |
|
C—N |
305 |
73 |
N—H |
389 |
93 |
|
C=N |
598 |
143 |
S—H |
339 |
83 |
|
|
|
|
|
|
|
|
* Значения Е приведены при t = 25 °C.
Сравнение данных табл. 3.2 и 3.3 показывает, что с увеличением s-характера
связи ее длина уменьшается, а прочность |
возрастает. Двойные связи коро- |
че и прочнее соответствующих одинарных, |
а тройные — двойных. Но вместе |
с тем энергия двойной связи меньше удвоенной, а тройной — утроенной энергии одинарной связи. Это означает, что σ-связь прочнее π-связи. Проанализировав элементы в пределах группы периодической системы (например, связь С–На1), можно увидеть, что при движении сверху вниз длина связи увеличивается, а прочность — уменьшается.
Полярность связи. Полярностью связи называют неравномерное распределение электронной плотности связи, обусловленное различной электроотрицательностью атомов.
Электроотрицательность — это способность атома притягивать электроны.
Она зависит от эффективного заряда ядра атома и вида гибридизации атомных орбиталей. Наиболее известна шкала электроотрицательности, составленная американским химиком Лайнусом Карлом Полингом (табл. 3.4).
Таблица 3.4
Электроотрицательность элементов по шкале Полинга
Атом |
H |
S |
Csp3 |
I |
Csp2 |
Br |
Cl |
N |
Csp |
O |
F |
Электроотрицательность |
2,1 |
2,5 |
2,5 |
2,6 |
2,8 |
2,8 |
3,0 |
3,0 |
3,2 |
3,5 |
4,0 |
|
|
|
|
|
|
|
|
|
|
|
|
В соответствии с данными табл. 3.4 электроотрицательность атома углерода возрастает при переходе от sp3- к sp-гибридному состоянию, что объясняется уве-
личением s-характера орбиталей.

Глава 3
50
Полярная ковалентная связь образуется между атомами с различной электроотрицательностью, а также между атомами с одинаковой электроотрицательностью, но которые в свою очередь связаны с атомами, имеющими другую электроотрицательность (см. подразд. 4.1):
|
|
δ+ |
δ– |
|
|
′ |
|
δ+ |
δ– |
|||
|
|
|
|
δ+ |
|
|||||||
|
CH3 |
Cl |
|
|
CH3 |
CH2 |
|
Cl |
||||
|
|
|
|
|||||||||
|
|
хлорметан |
|
|
|
хлорэтан |
|
|||||
Лайнус карл ПоЛинг |
В |
молекуле |
хлорэтана |
атом |
хло- |
|||||||
ра поляризует |
не только |
связь С—С1, но |
||||||||||
(1901—1994) |
||||||||||||
и связь С—С. |
|
|
|
|
|
|
|
|
||||
Американский химик и физик, |
|
|
|
|
|
|
|
|
||||
Количественно полярность связи выра- |
||||||||||||
общественный деятель. Главное на- |
жается значением дипольного момента, кото- |
|||||||||||
учное достижение — учение о хими- |
рый обозначают буквой (греч. «мю»). |
|||||||||||
ческой связи (1931—1934). Разработал |
Дипольный |
момент |
равен |
произведению |
||||||||
метод направленных валентных свя- |
||||||||||||
расстояния между «центрами тяжести» по- |
||||||||||||
зей, представления о гибридизации |
ложительных и отрицательных зарядов на их |
|||||||||||
и перекрывании атомных орбиталей, |
||||||||||||
значение. |
|
|
|
|
|
|
|
|
|
|||
концепцию электроотрицательности |
|
|
|
|
|
|
|
|
|
|||
атомов и частично-ионного характера |
Обычно дипольный момент молекул вы- |
|||||||||||
связи. Его монография «Природа хи- |
ражают в единицах Дебая (D). В единицах |
|||||||||||
мической связи» (1939) является ше- |
СИ его выражают |
в |
аттокулоннанометрах |
|||||||||
девром химической литературы. Со- |
(аК · |
нм). 1D = 3,33564 · 10–3 аК · нм. Ди- |
||||||||||
здал (1931—1933) теорию резонанса. |
польный момент — векторная величина. Для |
|||||||||||
В области биохимии высказал идею |
большинства ковалентных связей дипольный |
|||||||||||
о спиральном строении полипептидной |
||||||||||||
момент равен 0—3D, сильно полярные связи |
||||||||||||
цепи. Изучал строение ДНК, антител, |
||||||||||||
имеют 4—7D, ионные — свыше 10D. Мо- |
||||||||||||
природу иммунологических реакций. |
лекулу, состоящую из трех и более атомов, |
|||||||||||
Дважды лауреат Нобелевской премии: |
||||||||||||
в области химии (1954) и борьбы про- |
рассматривают как систему нескольких ди- |
|||||||||||
тив ядерных испытаний (1962). |
полей. Измерить дипольный момент каждой |
|||||||||||
|
отдельной |
связи в |
такой |
молекуле |
невоз- |
|||||||
можно. Можно измерить только суммарный дипольный момент молекулы (результирующий диполь), который представляет собой сумму векторов дипольных моментов отдельных связей. Зная дипольный момент молекулы и значение углов между направлением связей, можно определить дипольные моменты отдельных связей путем разложения по правилу параллелограмма. Суммарный дипольный момент молекулы зависит не только от числа и природы полярных связей, но и от взаимного расположения их в пространстве. Например, молекула тетрахлорметана ССl4 содержит четыре связи С—С1 с дипольным моментом 1,46 D каждая, а в целом соединение не имеет диполя ( = 0), так как происходит взаимная компенсация дипольных моментов отдельных связей. Молекула же хлорметана СН3—С1 имеет дипольный момент 1,86 D, обусловленный в основном полярностью связи С—С1.
Наличие диполя оказывает существенное влияние на физические и химические свойства вещества. Температуры кипения полярных соединений выше,
