
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
кЛассиФикаЦиЯ и номенкЛаТура органических соединениЙ
31
третичный атом углерода |
|
|
|
вторичный атом углерода |
|
|
|
|
|
|
|
|
|
|
СН3—СН—СН2—СН3 СН3
первичные атомы углерода
СН3 |
СН3 |
CH3—CH2—CH2—CH2— СН3—С—СН2— СН3—СН2—СН—СН3 СН3—С— |
|
СН3 |
СН3 |
первичные радикалы |
вторичный радикал третичный радикал |
Названия и структурные формулы некоторых углеводородных радикалов приведены в табл. 2.3.
|
|
|
|
|
|
|
Таблица 2.3 |
|
|
|
|
названия углеводородных радикалов |
|
||
|
|
|
|
|
|
||
Структурная формула |
Название |
Структурная формула |
Название |
||||
|
|
|
|
|
|
|
|
|
CH3— |
|
метил |
НC—C— |
этинил |
||
|
|
|
|
|
|
|
|
CH3—CH2— |
|
этил |
HС—C—CH2— |
2-пропинил |
|||
|
|
|
|
|
|
|
|
CH3—CH2—CH2— |
|
пропил |
—CH2— |
метилен |
|||
|
|
|
|
|
|
|
|
CH3 |
CH— |
|
изопропил |
—CH2—CH2— |
этилен |
||
CH3 |
|
|
|
|
|
|
|
CH3—CH2—CH2—CH2— |
бутил |
—CH2—CH2—CH2— |
триметилен |
||||
|
|
|
|
|
|
|
|
CH3 |
CH—CH2— |
|
изобутил |
CH3—CH= |
этилиден |
||
CH3 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН —СH—СН — СН |
|
втор-бутил |
CH3 |
C= |
изопропилиден |
||
|
|
||||||
3 |
|
2 |
3 |
|
CH3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|
|
|
|
|
СН3—С— |
|
трет-бутил |
C6H5— |
фенил |
|||
|
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
H2C=CH— |
|
винил; этенил |
C6H5—CH2— |
бензил |
|||
|
|
|
|
|
|
|
|
H2C=CH—CH2— |
|
аллил; |
C6H5—CH= |
бензилиден |
|||
|
2-пропенил |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3—CH=CH— |
|
1-пропенил |
C6H5—C— |
бензилидин |
|||

Глава 2
32
Определив родоначальную структуру, проводят нумерацию атомов углерода таким образом, чтобы старшая группа получила по возможности меньший номер. Если соединение не имеет старшей группы, предпочтение при нумерации (возможны меньшие номера) отдают положениям кратных связей, а в их отсутствие — заместителям.
Наконец, составляют название соединения в целом, соблюдая следующую по-
следовательность: вначале в алфавитном порядке указывают функциональные группы (кроме старшей) и углеводородные радикалы (префикс), затем приводят название родоначальной структуры (корень), в конце — указывают кратные связи и старшую функциональную группу (суффикс):
название |
= |
|
Префикс |
|
+ |
|
Корень |
|
+ |
|
Суффикс |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Функциональные группы |
|
Родоначальная |
|
|
Старшая |
||||||||||
|
|
|
(кроме старшей); |
|
|
|
структура |
|
функциональная |
||||||||
|
|
углеводородные радикалы |
|
(главная углеродная |
|
|
группа; |
||||||||||
|
|
(в алфавитном порядке) |
|
цепь или цикл) |
|
кратные связи |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Двойная связь в названии обозначается суффиксом ен, тройная — ин. Положение заместителей и кратных связей указывают цифрами или буквами (локантами). При наличии в молекуле нескольких одинаковых заместителей или кратных связей для их обозначения применяют множительные приставки: ди (два), три (три), тетра (четыре), пента (пять) и т. д.
Родоначальная структура |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
Старшая |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
5 |
4 |
3 |
2 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
СН3—СН—СН—СН—С |
|
|
|
|
функциональная |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
OH |
|
группа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
СН3 |
OН |
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Заместители |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Локанты |
|
|
|
|
|
Множительный префикс |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
- 2,4 - |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
3 |
гидрокси |
ди |
|
метил |
|
пентан |
|
овая |
|
кислота |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Префикс |
|
|
|
|
Корень |
|
|
Суффикс |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(функциональная |
(родоначальная |
|
|
(старшая |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
группа |
|
|
|
|
|
структура) |
|
|
функциональная |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
и углеводородные |
|
|
|
|
|
|
|
|
группа) |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
радикалы) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Радикалофункциональная номенклатура. Для некоторых органических соеди-
нений номенклатура IUPAC, наряду с заместительным, предусматривает ради- кало-функциональный вариант составления названий. В основе этих названий

кЛассиФикаЦиЯ и номенкЛаТура органических соединениЙ
33
лежит название функционального класса (спирт, эфир, кетон и др.), которому предшествуют наименования углеводородных радикалов:
СН3—СН2—ОН |
СН3—СН3—О—СН2—СН3 |
|||
этиловый спирт |
диэтиловый эфир |
|||
О |
Н2С=СН—СН2—Сl |
|||
|
|
|
||
СН3—С—СН3 |
||||
|
||||
диметилкетон |
аллилхлорид |
|||
Если соединение содержит несколько функциональных групп, то аналогично заместительной номенклатуре старшая из них определяет принадлежность к классу, который кладут в основу названия, остальные указывают в префиксах. Для обозначения родоначальной структуры чаще применяют тривиальные названия. В качестве локантов в радикало-функциональной номенклатуре обычно используют буквы греческого алфавита α, β, γ, δ и так далее, причем буквой α обозначают ближайший от старшей функциональной группы атом углерода, β — второй, γ — третий и т. д.
γ β α |
β α |
H2N—СН2—СН2—СН2—OН |
Cl—СН2—СН2—С—N |
γ-аминопропиловый спирт |
β-хлорэтилцианид |
Рассмотренные в настоящей главе основные принципы номенклатуры органических веществ являются лишь кратким пояснением к многочисленным названиям и номенклатурным правилам, изложенным в последующих разделах учебника, посвященных конкретным классам соединений.

Глава 3
ХИМИЧЕСКАЯ СВЯЗЬ
Изучение органической химии значительно упростилось благодаря развитию теории химической связи. На основании существующих представлений о природе химической связи и электронной структуре молекул стало возможным объяснить реакционную способность органических соединений, понять и запомнить фактический материал химии.
3.1. ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
В1916 году немецкий ученый Вальтер Коссель и американский ученый Гильберт Льюис Ньютон предложили электронную теорию химической связи, которая явилась важным этапом в развитии теории строения. Согласно электронной теории, химическая связь рассматривается как результат взаимодействия внешних электронных оболочек (валентных электронов) атомов. Учитывая химическую инерт-
ность благородных газов, их внешние электронные оболочки (для гелия — двухэлектронная, для неона, аргона и т. п.— восьмиэлектронная) считают наиболее устойчивыми к взаимодействию. Стремление атомов других элементов связываться друг с другом обусловлено неустойчивостью их валентных оболочек. Поэтому каждый атом, образуя химическую связь, принимает, отдает или обобществляет валентные электроны таким образом, чтобы его внешняя электронная оболочка соответствовала конфигурации инертных газов. Такой принцип заполнения валентных оболочек получил название «октетное правило», или «правило октета».
Взависимости от способа образования различают два основных типа химической связи — ионную и ковалентную.
ионная связь образуется между атомами, которые значительно отличаются по электроотрицательности. Электронная конфигурация инертного газа достигается
вданном случае путем переноса электрона к более электроотрицательному атому. В результате образуются противоположно заряженные ионы, которые электростатически притягиваются друг к другу. Поэтому ионную связь называют еще
электровалентной:
Na +
+  Cl
Cl
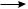 Na+Cl–
Na+Cl–
В приведенном примере ион натрия обладает электронной конфигурацией неона, а ион хлора — конфигурацией аргона.
Соединения с ионной связью имеют высокие температуры плавления, хорошо растворяются в полярных растворителях, в водных растворах диссоциируют на ионы. Их растворы и расплавы проводят электрический ток.
ковалентная связь является основным типом химической связи в органи-
ческих соединениях. Она образуется между атомами, равными или близкими

химическаЯ сВЯзь
35
по электроотрицательности. Электронная конфигурация инертного газа в данном случае достигается за счет обобществления валентных электронов и формирования одной или нескольких общих электронных пар:
HH
 C
C + 4H
+ 4H
 H
H C
C H — H—C—H
H — H—C—H
HH
метан
В результате обобществления валентных электронов углерода и водорода образуются четыре электронные пары, которые являются общими для данных атомов. Углеродный атом при этом приобретает конфигурацию неона, а атомы водорода — конфигурацию гелия. Каждая из обобществленных пар электронов составляет ковалентную связь, которая обозначается в виде валентного штриха (—).
При образовании ковалентной связи между атомами с одинаковой электроотрицательностью общая электронная пара располагается симметрично по отношению к центрам обоих атомов. Такая связь называ-
ется ковалентной неполярной:
H3C CH3 — H3C—CH3
CH3 — H3C—CH3
этан
ковалентная неполярная связь
Если в образовании ковалентной связи участвуют атомы с различной электроотрицательностью, общая пара электронов смещается к атому с большей электроотрицательностью. В этом случае связь называют
ковалентной полярной:
δ+ δ–
H3C  Cl — H3C
Cl — H3C Cl
Cl
хлорметан
ковалентная полярная связь
Полярную ковалентную связь изображают в виде стрелки ( ), направленной к более электроотрицательному атому. Буквой δ (греч. «дельта») условно обозначают дробные (частичные) заряды на атомах. Символ δ+
), направленной к более электроотрицательному атому. Буквой δ (греч. «дельта») условно обозначают дробные (частичные) заряды на атомах. Символ δ+
альфред Бернхард ноБеЛь
(1833—1896)
Шведский инженер-химик, изобретатель и промышленник. Родился в Стокгольме, в Швеции. В 1843— 1850 годах жил в Петербурге, где его отец занимался разработкой и выпуском торпед и мин для подводных лодок. С 1850 года изучал химию в Германии, Франции, Италии и США. Изобретения связаны с производством взрывчатых веществ (динамит, баллистит и др.). В последние годы жизни проводил исследования в области электрохимии, оптики, биологии.
Полученные 355 патентов сделали его состоятельным человеком. Он никогда не был женат и после смерти все свое состояние ($ 9 200 000) завещал для учреждения премий тем, кто «принес неоценимую пользу человечеству».
Он завещал, чтобы вся сумма была инвестирована, а ежегодный доход должен быть разделен на пять равных частей, которыми будут награждены люди, внесшие значительные вклады в области химии, физики, физиологии, медицины и литературы, или человек, проделавший самую большую работу для достижения равенства среди наций, разоружения, проведения конгрессов, посвященных проблеме мира во всем мире. Нобель также в качестве особого условия оговаривал, что премия должна присуждаться кандидатам любой национальности, что каждая премия может быть разде-
Глава 3
36
лена не более чем между тремя кандидатами и не может быть присуждена посмертно.
Нобель завещал, чтобы премии присуждали следующие организации:
вобласти химии и физики — Королевская академия наук Швеции, в области физиологии или медицины — Каролинский институт в Стокгольме,
вобласти литературы — Шведская академия, за мир — комитет в составе 5 человек, избранных Норвежским парламентом. Обсуждение проходит втайне, и апелляции по поводу решений не допускаются. Первая награда была вручена в 1901 году. В 1969 году шведский Центральный банк учредил премию в области экономики в честь Альфреда Нобеля. Лауреат этой премии выбирается Королевской академией наук Швеции. 10 декабря — в годовщину смерти А. Нобеля в Стокгольме проходит церемония вручения премий; премия за мир вручается в г. Осло.
 N
N + 3H
+ 3H
отражает пониженную, а δ– — повышенную электронную плотность.
В зависимости от числа общих электронных пар, возникающих между атомами при образовании связи, различают простые
и кратные ковалентные связи. Простые пред-
ставлены одной, кратные — двумя или тремя парами электронов:
простая ковалентная связь
H C
C C
C H — H——C—С——H
H — H——C—С——H
ацетилен
кратная ковалентная связь
Атомы азота, кислорода, серы, галогенов и некоторых других элементов при образовании ковалентных связей формируют октетную оболочку обобществлением не всех внешних электронов. Часть электронов не участвует в образовании химических связей.
Эти электроны называют необобществленными, неподеленными или n-электронами:
HH

 N
N H —
H —  N——H
N——H
H
H
|
неподеленные электроны |
|
||
|
|
|
||
CH3—O—H CH3—S—H |
CH3—Cl |
|||
метанол |
метантиол |
хлорметан |
||
Донорноакцепторная связь представляет собой разновидность ковалентной связи. Если ковалентная связь образуется путем обобществления пары электронов по одному от каждого атома, то донорно-акцепторная — за счет двух электронов, предоставляемых одним из атомов. При этом атом, поставляющий пару электронов в общее пользование, называют донором, а атом, принимающий элект-
роны,— акцептором. Донор должен иметь пару неподеленных электронов. Акцептором может быть протон или другой атом, у которого не хватает до образования октета двух электронов.
По донорно-акцепторному механизму, например, протекает образование иона аммония, гидроксония и др.:
H |
|
H |
|
H |
|
+ |
|||
|
|
|
|||||||
|
|
|
|
||||||
|
|
|
H—N+—H — |
|
|
|
|
|
|
H—N + H+ |
|
|
H—N—H |
|
|
||||
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
H |
|
|
|||
донор акцептор |
ион аммония |
химическаЯ сВЯзь
37
Поскольку пара электронов атома азота ушла на образование связи с протоном и стала общей для двух атомов, азот приобретает положительный заряд. Образовавшаяся в ионе аммония по донорно-акцепторному механизму ковалентная связь ничем не отличается от трех остальных связей.
Донорно-акцепторную связь называют еще координационной, поскольку при ее образовании происходит процесс координации неподеленной электронной пары.
Частным случаем донорно-акцепторной связи является семиполярная связь. Она образуется при взаимодействии атомов, имеющих неподеленные электронные пары (доноры), с электронейтральными частицами, которые содержат секстет электронов (акцепторы). В результате образования координационной связи атомдонор приобретает положительный заряд, а атом-акцептор — отрицательный. В итоге эти два атома оказываются связанными двояко: ковалентной связью и ионной. Ниже приведены примеры образования семиполярной связи в молекулах триметиламин-N-оксида и нитробензола:
|
|
СH3 |
|
|
СH3 |
|
|
|
СH3 |
|
|||||
|
|
|
|
|
|
|
|
|
+ |
|
– |
|
|
+ |
|
СH3—N + О |
|
|
СH3—N |
|
O |
|
— |
CH3—N—O– |
|||||||
|
|
|
|||||||||||||
|
|
СH3 |
|
|
СH3 |
|
|
|
СH3 |
|
|||||
|
триметиламин |
|
|
|
|
|
триметиламин-N-оксид |
|
|||||||
|
|
|
— |
|
|
|
|
|
+ |
О |
|
+ |
О |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
С |
H —N O + О |
|
|
С |
H —N |
O– — |
С |
H —N |
|
||||||
6 |
5 |
|
|
|
6 |
|
5 |
|
|
6 |
5 |
О– |
|||
нитрозобензол |
|
|
|
|
|
|
|
нитробензол |
|
|
|||||
Несмотря на то что в семиполярных связях наряду с ковалентной связью имеется и ионное взаимодействие, соединения, построенные по этому типу, не проводят электрический ток. Семиполярную связь принято обозначать следующим образом:
+ |
О |
О |
R—N |
или R—N |
|
|
О– |
О |
Водородная связь образуется в результате электростатического взаимодействия между активными атомами водорода в молекуле и атомами с неподеленной электронной парой (—O—, —N—, —F , реже —S—, —Cl
, реже —S—, —Cl ) в этой же или в другой молекуле.
) в этой же или в другой молекуле.
Активными называют атомы водорода, связанные в молекуле сильно полярной ковалентной связью, например:
—O H,
H,  N
N H, —S
H, —S H и др.
H и др.
Графически водородную связь обозначают тремя точками:
—N H
H
 N—
N—  N
N H
H
 O
O
водородная связь
Энергия водородной связи (10—40 кДж/моль) по сравнению с энергией ковалентной связи (340—360 кДж/моль) невелика.
Глава 3
38
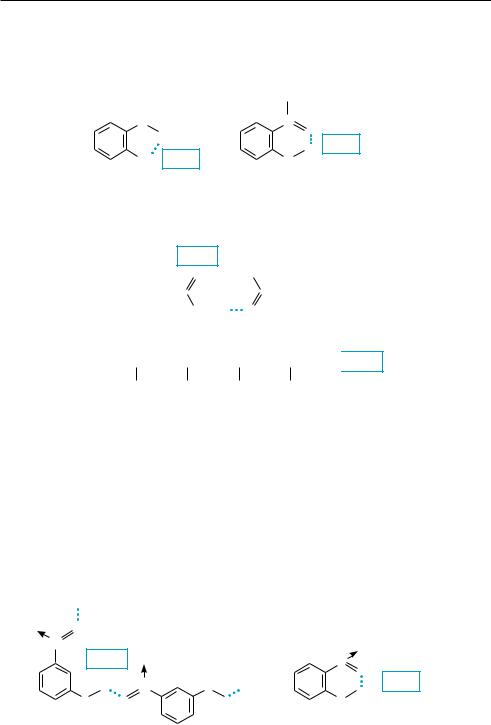
Различают внутримолекулярные и межмолекулярные водородные связи. Внутри-
молекулярные водородные связи (ВВС) возникают в пределах одной молекулы с образованием пяти-, шестиили семичленных хелатообразных структур (от лат. chela — клешня):
|
H |
|
|
O |
С O |
||
H |
|
H BBC |
|
Cl BBC |
O |
||
|
|||
о-хлорфенол |
салициловый альдегид |
||
Межмолекулярые водородные связи (МВС) возникают между двумя или несколькими молекулами с образованием димеров или ассоциатов:
MBC
О
 H—O
H—O
H3C—C |
C—CH3 |
О—H |
O |
димер уксусной кислоты

 O—H
O—H
 O—H
O—H
 O—H
O—H
 O—H
O—H

 MBC
MBC
C2H5 C2H5 C2H5 C2H5
ассоциат этилового спирта
Наличие водородных связей оказывает влияние на физические (температура кипения и плавления, растворимость, вязкость, спектральные характеристики) и химические свойства органических соединений. Межмолекулярная водородная связь способствует повышению температуры кипения, а часто и температуры плавления вещества. Температура кипения этилового спирта С2Н5ОН (78 °С) за счет образования ассоциатов значительно выше, чем диметилового эфира СН3—О—СН3 (–24 °С), имеющего одинаковую с ним молекулярную массу, но не способного образовывать водородную связь. Аналогично более высокая температура плавления м-нитрофенола (97 °С) и п-нитрофенола (114 °С) по сравнению с о-нитрофенолом (45 °С) объясняется образованием межмолекулярной водородной связи.
OO
N |
O |
|
N O |
MBC |
|
||
|
|
|
O |
H |
N |
O |
BBC |
O O |
|
H |
O H |
м-нитрофенол |
|
o-нитрофенол |
|
tïë = 97 °Ñ |
|
tïë = 45 °Ñ |
|
Образование водородной связи между растворенным веществом и растворителем (если это возможно) значительно увеличивает растворимость вещества.

химическаЯ сВЯзь |
|
|
|
39 |
||
|
|
|
|
|
||
Водородная связь, особенно внутримоле- |
|
|||||
|
|
|||||
кулярная, оказывает влияние на конформа- |
|
|
||||
цию молекул и скорость протекания хими- |
|
|
||||
ческих реакций. |
|
|
|
|
|
|
Установить |
наличие |
водородной |
свя- |
|
|
|
зи можно с помощью методов ИК-, КР- |
|
|
||||
и ЯМР-спектроскопии. Например, в инф- |
|
|
||||
ракрасных спектрах гидроксилсодержащих |
|
|
||||
соединений (спирты, фенолы) наблюдается |
|
|
||||
полоса поглощения свободной ОН-группы |
|
|
||||
в области 3650—3590 см–1, если же эта груп- |
|
|
||||
па участвует в образовании водородной свя- |
|
|
||||
зи, полоса поглощения проявляется в облас- |
Эрвин ШрЁдингер |
|||||
ти 3400—3200 см–1. |
|
|
||||
Водородные связи играют важную роль |
(1887—1961) |
|||||
в протекании |
различных биохимических |
Австрийский физик-теоретик. Один из |
||||
процессов в организме, в частности они оп- |
создателей квантовой механики. Разрабо- |
|||||
ределяют пространственную структуру бел- |
тал теорию движения микрочастиц — вол- |
|||||
новую механику, в основу которой поло- |
||||||
ков, полисахаридов, участвуют в образова- |
жил выведенное им (1926) волновое урав- |
|||||
нии двойной спирали ДНК и др. |
|
нение. Уравнение Шрёдингера описывает |
||||
|
|
|
|
энергию молекулы любого химического |
||
|
|
|
|
соединения в соответствии с волновой |
||
|
|
|
|
функцией, характеризующей распределе- |
||
3.2. КВАНТОВО-МЕХАНИЧЕСКИЕ |
ние электронной плотности в поле атом- |
|||||
ОСНОВЫ ТЕОРИИ ХИМИЧЕСКОЙ СВЯЗИ |
ных ядер. |
|||||
Лауреат Нобелевской премии по физи- |
||||||
|
|
|
|
|||
Современная |
теория |
химической |
связи |
ке (1933, совместно с П. Дираком). |
||
|
|
|||||
базируется на квантово-механическом рассмотрении молекулы как системы из электронов и атомных ядер. Квантово-механический подход к изучению химических систем основан на решении волнового уравнения Эрвина Шрёдингера НΨ=ЕΨ, где Н — оператор Гамильтона, Е — полная энергия системы, Ψ (греч. «пси») — волновая функция.
Уравнение Шрёдингера описывает энергию молекулы любого соединения в соответствии с волновой функцией, характеризующей распределение электронной плотности в поле атомных ядер. Решение уравнения сводится к нахождению волновой функции Ψ, зависящей от пространственных координат и спиновых переменных всех электронов. Квадрат модуля волновой функции [Ψ]2 определяет вероятность обнаружения электрона в «точке» пространства, а сама функция Ψ описывает орбиталь.
атомные орбитали
Атомной орбиталью (АО) называют область пространства, внутри которой вероятность нахождения электрона максимальна.
Согласно квантовой теории состояние любого электрона в атоме описывается четырьмя квантовыми числами: п, l, т, s. Первые три числа характеризуют атомную орбиталь: главное квантовое число п определяет энергетический уровень орбитали,
побочное квантовое число l — геометрическую форму орбитали, магнитное кван-

Глава 3
40
товое число т — ориентацию различных атомных орбиталей в пространстве. Спиновое квантовое число s описывает вращение электрона вокруг собственной оси.
Из курса неорганической химии студентам известны геометрические формы s-, р-, d- атомных орбиталей (рис. 3.1).
Рис. 3.1. Геометрическая форма s-, р-, d- атомных орбиталей
Атомные орбитали s-типа имеют сферическую симметрию. Существуют три одинаковые по энергии р-АО гантелеобразной формы, отличающиеся друг от друга ориентацией в пространстве: рх, pу, рz (рис. 3.2).
z |
|
y |
|
|
z |
|
y |
|
z |
|
|
y |
|||||
|
|
|
|||||||||||||||
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
x |
|
|
|
|
|
x |
|
|
|
|
|
|
x |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
узловая |
|
|
|
|
|
|
px-орбиталь |
|
py-орбиталь |
область |
|
pz-орбиталь |
||||||||||||
Рис. 3.2. Ориентация р-атомных орбиталей по осям координат
Каждая р-орбиталь имеет узловую область, в которой вероятность нахождения электрона равна нулю. Существует пять атомных орбиталей d-типа с более сложной геометрической формой.
Согласно принципу Паули на одной орбитали может находиться не более двух электронов, и эти электроны должны иметь противоположные спины (условно обозначается 
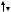

 ).
).
Заполнение атомных орбиталей электронами осуществляется в порядке возрастания энергий: 1s < 2s < 2р < 3s < 3р < 4s < 3d и т. д.
Атомную орбиталь, не занятую электронами, называют вакантной (условно обозначается 
 ).
).
Всоответствии с правилом Гунда заполнение орбиталей с одинаковой энергией (так называемых вырожденных орбиталей) происходит в таком порядке, что вначале каждая орбиталь заселяется одним электроном, и эти электроны должны иметь параллельные спины, затем происходит окончательное заполнение орбитали электронами с антипараллельными спинами.
Втабл. 3.1 приведены электронные конфигурации элементов, наиболее часто встречаемых в органической химии.
Ковалентная связь. Для описания ковалентной связи с позиций квантовой механики используют метод молекулярных орбиталей (МО) и валентных связей (ВС). Оба метода представляют собой математические приемы приближенного решения уравнения Шрёдингера применительно к молекуле.
Согласно методу ВС (теория резонанса) ковалентная связь рассматривается как результат перекрывания атомных орбиталей, несущих по одному электрону
