
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf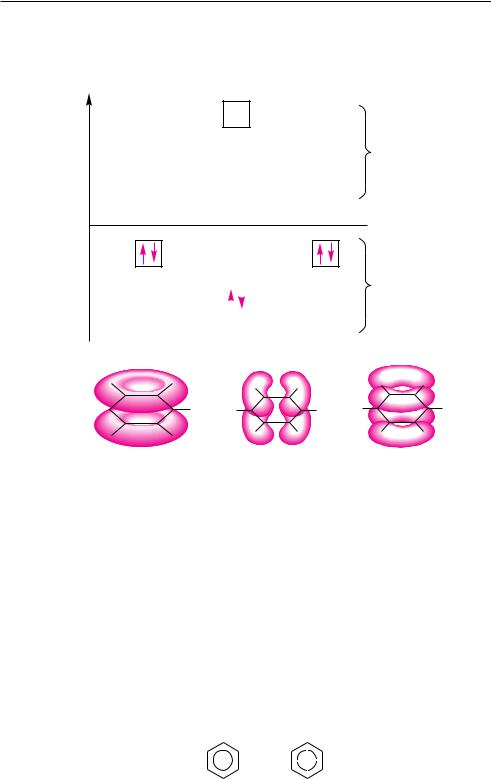
аромаТические угЛеВодороды. одноЯдерные арены
201
определенной энергией и может быть заполненена двумя электронами с антипараллельными спинами. В основном состоянии шесть π-электронов занимают три связывающие π-МО, которые обладают более низкой энергией. Высокоэнергетичные разрыхляющие π*-МО остаются незаполненными (рис. 14.2).
E
|
|
|
|
π6 |
|
|
|
Разрыхляющие |
|
|
|
|
|
|
|
|
|
|
π -ÌÎ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
π4 |
|
π5 |
||||||
|
|
|
π2 |
|
|
|
|
|
|
|
|
|
|
π3 |
|
|
Cвязывающие |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π-ÌÎ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
π1 |
|
|
|
|
|
|
|
|
|
|
|
|
Í |
|
Í |
|
|
|
|
Í |
|
Í |
|
|
Í |
Í |
|
|||
Í |
+ |
|
Í |
|
Í |
|
|
– |
– |
Í Í |
|
– |
Í |
|||||
|
|
|
|
|
+ |
+ |
|
|
|
|||||||||
– |
|
|
+ Í |
|||||||||||||||
|
Í |
|
Í |
|
|
|
|
Í |
|
Í |
|
|
Í |
|
||||
|
|
|
π1 |
|
|
|
|
|
|
|
|
π2 |
|
|
|
π3 |
|
|
Рис. 14.2. Энергетические уровни шести π-молекулярных орбиталей бензола и схематическое изображение трех связывающих π-МО (π1, π2 и π3)
Повышенная устойчивость молекулы бензола определяется энергией низшей π1-МО, в которой π-электронное облако охватывает все углеродные атомы цикла (рис. 14.2). В результате сопряжения все углерод-углеродные связи в молекуле бензола выравнены.
Таким образом, в бензольном кольце нет простых и двойных связей. На каждую углерод-углеродную связь, помимо двух σ-электронов, приходится электронная плотность одного π-электрона. Такую связь называют ароматической. Если длина простой связи C—C в алканах составляет 0,154 нм, длина двойной связи в алкенах — 0,134 нм, то длина углерод-углеродной связи в молекуле бензола равна 0,139 нм, то есть является промежуточной между длиной одинарной и двойной связи.
Делокализация π-электронной плотности и выравненность связей в бензольном кольце графически изображается в виде окружности внутри правильного шестиугольника:
или

Глава 14
204
6 5 4 3 2 1
CH3—CH2—CH—CH2—CH—CH3  CH3
CH3
2-метил-4-фенилгексан
Изомерия гомологов бензола обусловлена разным строением, положением и количеством заместителей в бензольном кольце.
Однозамещенные гомологи бензола не имеют изомеров положения, поскольку все атомы углерода в бензольном кольце равноценны. Вместе с тем для них характерна изомерия, связанная с разной структурой заместителя:
CH2—CH2—CH3 H3C—CH—CH3
пропилбензол |
изопропилбензол |
Дизамещенные бензолы существуют в трех изомерных формах, имеющих разное положение заместителей в бензольном кольце (изомеры положения):
CH3 |
CH3 |
CH3 |
||||
|
CH3 |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||
1,2-диметилбензол; |
1,3-диметилбензол; |
1,4-диметилбензол; |
||||
о-ксилол |
м-ксилол |
п-ксилол |
||||
Тризамещенные бензолы с одинаковыми заместителями в бензольном кольце также имеют три изомера положения:
CH3 |
CH3 |
CH3 |
||||
|
CH3 |
|
|
CH3 |
|
|
|
CH3 |
|
|
H3C |
|
CH3 |
|
|
|
|
|||
|
|
|
|
|||
|
|
CH3 |
|
|
||
1,2,3-триметилбензол |
1,2,4-триметилбензол 1,3,5-триметилбензол; |
|||||
|
|
|
|
|
мезитилен |
|
Для гомологов бензола также характерна изомерия, обусловленная разным чис-
лом заместителей в бензольном кольце:
CH2—CH3 CH3
CH3
ýòèëбензол |
о-диметилбензол; |
|
о-ксилол |
аромаТические угЛеВодороды. одноЯдерные арены
205
14.3. СПОСОБЫ ПОЛУЧЕНИЯ
14.3.1. Природные исТочники
Основными природными источниками ароматических углеводородов являются нефть и каменный уголь.
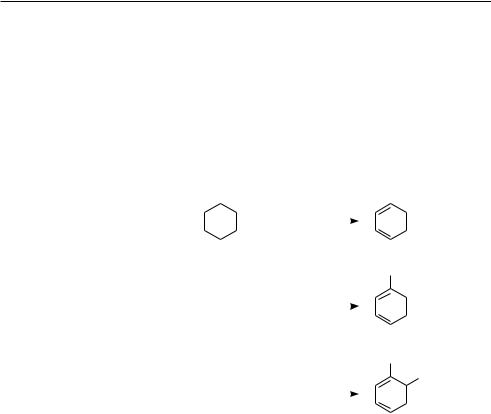
Получение из нефти. В сырой нефти содержится небольшое количество ароматических углеводородов. Поэтому с целью увеличения их массовой доли нефть подвергают так называемой ароматизации, то есть нагревают при высокой температуре и давлении в присутствии катализаторов. При этом протекают процессы дегидрирования, изомеризации и циклизации. Ниже приведены схемы некоторых типичных реакций:
|
300 °Ñ; Pt |
|
+ 3H2 |
|
|
|
|
|
|
|
|
циклогексан |
|
бензол |
|
|
500 °Ñ; Cr2O3/Al2O3 |
CH3 |
|
CH3CH2CH2CH2CH2CH2CH3 |
|
+ 4H2 |
|
|
|||
|
|
||
|
|
||
гептан |
|
толуîë |
|
|
|
CH3 |
|
|
500 °Ñ; Cr2O3/Al2O3 |
|
CH3 |
CH3CH2CH2CH2CH2CH2CH2CH3 |
|
+ 4H2 |
|
|
|
||
|
|
||
октан |
|
о-ксилол |
|
Врезультате ароматизации исходное сырье, содержащее около 10 % аренов
и65 % алканов, превращается в продукт, включающий 50—65 % аренов. Важный вклад в изучение процессов, протекающих при ароматизации
нефти, внесли известные ученые Николай Дмитриевич Зелинский, Борис Александрович Казанский, Альфред Феликсович Платэ и др.
Получение из каменного угля. При нагревании каменного угля без доступа воздуха до 1000—1300 °С образуется кокс, коксовый газ и каменноугольная смола. В 1 м2 коксового газа содержится около 30 г бензола и 10 г толуола. Каменноугольная смола представляет собой сложную смесь органических соединений. Подвергая ее фракционной перегонке, получают одноядерные ароматические углеводороды (бензол, толуол, ксилолы), многоядерные арены (нафталин, антрацен), фенолы, гетероциклические соединения и др. Всего из каменноугольной смолы выделено свыше 120 индивидуальных веществ.
14.3.2. синТеТические меТоды ПоЛучениЯ
Циклотримеризация алкинов. При нагревании в присутствии активированного угля или комплексных никельорганических катализаторов алкины образуют бензол и его гомологи (см. с. 182).
Взаимодействие смеси алкил- и арилгалогенидов с металлическим натрием (реак ция Вюрца—Фиттига). При обработке металлическим натрием смеси галогеналканов и галогенаренов образуются гомологи бензола:

Глава 14
206
|
|
Br |
|
|
|
C2H5 |
|
|
+ 2Na + Br—C2H5 |
|
|
|
+ 2NaBr |
|
|
|
||||
|
|
|
||||
бромбензол |
|
|||||
бромэтан |
|
этилбензол |
||||
Данная реакция является частным случаем реакции Вюрца применительно к аренам. В качестве побочных продуктов в процессе реакции Вюрца—Фиттига образуются алканы, а также бифенил и его гомологи:
2 —Br + 2Na
—Br + 2Na 
 + 2NaBr
+ 2NaBr
дифенил
2CH3—CH2—Br + 2Na  CH3—CH2—CH2—CH3 + 2NaBr
CH3—CH2—CH2—CH3 + 2NaBr
бутан
алкилирование ароматических углеводородов по Фриделю—крафтсу. Реакция Фриделя—Крафтса (1887) представляет собой общий метод получения гомологов бензола, основанный на взаимодействии ароматических углеводородов с алкилирующими агентами — галогеналканами, алкенами и спиртами (см. алкилирование по Фриделю—Крафтсу, с. 210).
14.4. ФИЗИЧЕСКИЕ СВОЙСТВА
В обычных условиях бензол и низшие члены гомологического ряда являются жидкостями, обладающими сильным специфическим запахом (табл. 14.1).
|
|
|
|
|
|
Таблица 14.1 |
|
|
Физические характеристики низших гомологов бензола |
|
|||
|
|
|
|
|
|
|
|
Соединение |
|
Температура, °С |
|
d 20 |
|
|
|
|
плавления |
|
кипения |
4 |
|
|
|
|
|
||
Бензол |
|
|
5,5 |
|
80,1 |
0,8790 |
Толуол |
|
|
–95,0 |
|
110,6 |
0,8669 |
о-Ксилол |
|
|
–25,0 |
|
144,4 |
0,8802 |
м-Ксилол |
|
|
47,9 |
|
139,1 |
0,8641 |
п-Ксилол |
|
|
13,3 |
|
138,4 |
0,8610 |
Кумол |
|
|
–96,0 |
|
152,4 |
0,8618 |
Мезитилен |
|
|
–44,7 |
|
164,7 |
0,8651 |
п-Цимол |
|
|
–67,9 |
|
177,1 |
0,8573 |
Стирол |
|
|
–30,6 |
|
145,2 |
0,9060 |
|
|
|
|
|
|
|
Все ароматические углеводороды нерастворимы в воде и хорошо растворяются в органических растворителях. Многие из них являются хорошими растворителями для других органических веществ. Из-за высокого содержания углерода ароматические углеводороды горят сильно коптящим пламенем. Бензол очень ядовит. Систематическое вдыхание его паров вызывает лейкемию.
аромаТические угЛеВодороды. одноЯдерные арены
207
14.5. ХИМИЧЕСКИЕ СВОЙСТВА
Реакционная способность бензола и его гомологов определяется, главным образом, наличием в структуре замкнутой π-электронной системы, которая является областью повышенной электронной плотности молекулы и способна притягивать положительно заряженные частицы — электрофилы. Поэтому ароматические уг-
леводороды, как и алкены, обладают нуклеофильным характером. Однако арены,
в отличие от ненасыщенных соединений, при взаимодействии с электрофильны-
ми реагентами более склонны не к реакциям присоединения, а замещения, поскольку при этом сохраняется их ароматическая система. Эти реакции называют реакция ми электрофильного замещения SЕ.
Реакции присоединения для аренов менее характерны, так как они приводят к нарушению ароматичности. С трудом вступают ароматические углеводороды и в реакции окисления.
14.5.1. реакЦии ЭЛекТроФиЛьного замещениЯ (SЕ)
Бензол и его гомологи сравнительно легко вступают в реакции электрофильного замещения. Электрофильная частица, атакующая π-электронную систему бензольного кольца, может быть представлена положительно заряженным ионом Е+ или частью нейтральной молекулы, имеющей центр с пониженной
δ+ δ–
электронной плотностью Е  Х (см. c. 119). Образование электрофильных частиц для участия в реакции возможно различными способами — под действием π-электронной системы бензольного кольца, катализатора, растворителя и др.
Х (см. c. 119). Образование электрофильных частиц для участия в реакции возможно различными способами — под действием π-электронной системы бензольного кольца, катализатора, растворителя и др.
Несмотря на большое разнообразие электрофильных реагентов и ароматических систем, подавляющее большинство реакций электрофильного замещения в ароматическом ряду рассматривается в рамках единого общего механизма.
При атаке электрофильной частицей π-электронной системы бензольного кольца сначала в результате электростатического взаимодействия образуется неустойчивый π-комплекс:
+ E+ 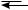
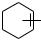
 E+
E+
π-комплекс
π-Комплекс представляет собой координационное соединение, в котором бензольное кольцо является донором электронов, а электрофил — акцептором. Образование π-комплекса является быстрой и обратимой стадией реакции. Ароматичность бензольного кольца при этом не нарушается. Во многих случаях π-комплекс удалось обнаружить при помощи электронных спектров поглощения. Поглощая некоторое количество энергии, π-комплекс превращается затем в σ-комплекс (карбокатион). В отличие от π-комплекса, в σ-комплексе электрофильная частица образует ковалентную связь с одним из атомов углерода бензольного кольца за счет двух его π-электронов. При этом происходит нарушение ароматической системы бензольного цикла, так как один из атомов углерода переходит из состояния sp2- в состояние sp3-гибридизации. Оставшиеся четыре π-электрона бензольного кольца делокализованы между пятью атомами углерода.
Строение σ-комплекса можно представить в виде резонансного гибрида структур I, II, III, но чаще его изображают структурой IV:


 H
H E
E  H
H 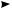
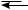 H
H
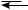 H
H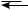
 H
H
 SO
SO +
+  HBr + FeBr
HBr + FeBr