многоЯдерные арены с конденсироВанными БензоЛьными ЦикЛами
231
ложение 1, которое является орто-положением по отношению к имеющемуся заместителю и α-положением нафталинового цикла:
OH |
|
|
NO2 |
HNO3 |
(êîíö.); H2SO4 (êîíö.) |
OH |
|
|
|
|
–H2O |
|
β-нафтол |
|
|
1-нитро-2-нафтол |
Если в нафталиновом цикле находится электроноакцепторный заместитель, то за счет –I- или –М-эффектов он дезактивирует в целом нафталиновое ядро по отношению к электрофильному замещению, но в большей степени дезактивируется кольцо, с которым связан заместитель. Поэтому новый заместитель вступает в соседнее кольцо. Учитывая повышенную реакционную способность α-положе- ний, замещение происходит преимущественно в положения 5 и 8:
À
7 |
8 |
1 |
2 |
7 |
8 |
1 |
À |
2 |
6 |
5 |
4 |
3 |
6 |
5 |
4 |
3 |
В большинстве случаев при электрофильном замещении образуется смесь изомеров:
NO2 |
|
|
|
NO2 |
NO2 NO2 |
HNO3 |
(êîíö.); H2SO4 |
(êîíö.) |
+ |
|
|
|
–H2O |
|
|
|
|
|
|
|
α-нитронафталин |
|
|
|
NO2 |
|
|
|
|
1,5-динитронафталин |
1,8-динитронафталин |
SO3H |
|
|
|
SO3H |
NO2 |
HNO3 (êîíö.); H2SO4 (êîíö.) |
SO3H |
|
|
+ |
|
|
–H2O |
|
|
|
|
|
|
|
β-нафталин- |
|
|
|
NO2 |
|
|
|
|
5-нитро-2-нафталин- |
8-нитро-2-нафталин- |
сульфокислота |
|
|
|
сульфокислота |
сульфокислота |
Всвязи с особенностью реакции сульфирования при высоких температурах
ипродолжительном нагревании сульфогруппа направляется преимущественно в β-положения соседнего кольца (положения 6 и 7):
SO3H |
|
SO |
H |
HO S |
SO |
H |
H2SO4 |
(êîíö.); 160 °Ñ |
3 |
+ |
3 |
3 |
|
|
|
|
|
|
–H2O |
|
|
|
|
|
HO3S |
|
|
|
|
|
β-нафталин- |
|
2,6-нафталин- |
|
|
2,7-нафталин- |
|
сульфокислота |
|
дисульфокислота |
|
|
дисульфокислота |
|
Глава 15
232
15.1.6. оТдеЛьные ПредсТаВиТеЛи. Применение
нафталин. Бесцветное кристаллическое вещество с характерным запахом, обладает высокой летучестью, т. пл. 80,3 °С. Хорошо растворяется в органических растворителях, плохо — в воде. Нафталин используется в производстве фталевого ангидрида, тетралина, декалина, красителей, лекарственных средств. Применяется в качестве инсектицида.
2-метилнафталин. Бесцветное кристаллическое вещество с т. пл. 34,4 °С. Хорошо растворяется в органических растворителях, плохо — в воде. 2-Метил- нафталин используют главным образом для получения лекарственного препарата «Викасол» (синтетический витамин К). С этой целью вначале 2-метилнафталин окисляют хрома (VI) оксидом, а затем действием NaHSO3 получают водорастворимое производное:
|
O |
CH3 |
CH3 |
|
CrO3; CH3COOH |
2-метилнафталин |
O |
2-метил-1,4-нафтохинон |
Викасол повышает свертываемость крови.
O
натрия 2,3-дигидро- 2-метил-1,4-нафтохинон-2-сульфонат; викасол
15.2. АНТРАЦЕН
Антрацен впервые выделен из каменноугольной смолы в 1832 году французскими химиками Ж. Дюма и О. Лораном.
|
|
|
α |
γ |
α |
|
|
Молекула антрацена состоит из трех линейно конденсиро- |
|
|
|
|
|
ванных бензольных циклов. Нумерацию углеродных атомов |
|
β |
7 |
8 |
9 |
1 |
2 |
β |
|
проводят как показано в структурной формуле. |
|
β |
6 |
5 |
10 |
4 |
3 |
β |
Положения 1, 4, 5, 8 в молекуле антрацена называют |
|
|
|
α |
γ |
α |
|
|
|
|
|
|
|
α-положениями, 2,3,6,7- β-, а 9,10- γ- или µ-(мезо — средний) |
|
|
|
|
|
|
|
|
положениями.
15.2.1.сПосоБы ПоЛучениЯ
Впромышленности антрацен получают из антраценовой фракции каменноугольной смолы. Антрацен может быть получен и синтетически.
алкилирование бензола по Фриделю—крафтсу 1,1,2,2-тетрабром-этаном:

многоЯдерные арены с конденсироВанными БензоЛьными ЦикЛами
233
Восстановление 9,10-антрахинона:
O
[H]
–2H2O
O
9,10-антрахинон
15.2.2. сТроение. химические сВоЙсТВа
Молекула антрацена плоская. Все атомы углерода находятся в sp2-гибридиза- ции. Число π-электронов (14 электронов) соответствует правилу ароматичности Хюккеля. Вместе с тем электронная плотность в молекуле антрацена распределена еще более неравномерно, чем в нафталине. Энергия сопряжения антрацена (351,5 кДж/моль) значительно меньше утроенной энергии сопряжения бензола (3 · 150,5 = 451,5 кДж/моль). Поэтому антрацен обладает меньшей ароматичностью, чем нафталин, и значительно меньшей, чем бензол. Антрацен по сравнению с нафталином в большей степени склонен к реакциям присоединения и окисления. Реакции электрофильного замещения для антрацена протекают легко, но во многих случаях они сопровождаются образованием промежуточных продуктов присоединения, которые могут быть выделены в индивидуальном виде. Наиболее реакционноспособны в антрацене мезо-положения (положения 9 и 10).
Антрацен легко восстанавливается водородом в момент выделения и окисляется концентрированной азотной кислотой с образованием соответственно 9,10-дигидроантрацена и 9,10-антрахинона:
H |
H |
O |
|
|
9,10-дигидроантрацен |
9,10-антрахинон |
Реакции электрофильного замещения, в частности галогенирование и нитрование, протекают по положению 9. При взаимодействии с хлором или бромом сначала образуются продукты присоединения в положениях 9 и 10, которые при нагревании отщепляют галогеноводород, превращаясь в 9-галогенантрацены:
Br
H Br
H Br
9,10-дибром-9,10-дигидроантрацен 9-бромантрацен
NO2
HNO3 (CH3COOH)
–H2O
9-нитроантрацен
Глава 15
234
В результате сульфирования антрацена серной кислотой при нагревании образуется смесь 1- и 2-антраценсульфокислот, которые являются более устойчивыми изомерами, чем 9-антраценсульфокислота.
|
SO3H |
H2SO4; t |
SO3H |
–H2O |
+ |
|
1-антраценсульфокислота 2-антраценсульфокислота
Антрацен применяется главным образом в производстве антрахинона и красителей.
15.3. ФЕНАНТРЕН
Фенантрен является структурным изомером антрацена. Его молекула состоит из трех конденсированных ангулярно бензольных циклов. Структурную формулу фенантрена представляют двояко:
|
|
5 |
6 7 |
|
9 |
10 |
|
|
|
|
8 |
8 |
1 |
3 |
4 |
|
|
|
|
2 |
1 |
10 |
9 |
7 6 |
5 |
4 |
3 2 |
Нумерацию углеродных атомов в молекуле фенантрена проводят, как показано в структурной формуле.
Получают фенантрен главным образом из антраценовой фракции каменноугольной смолы. Известны также синтетические методы получения фенантрена и его гомологов.
По физическим свойствам фенантрен представляет собой бесцветное кристаллическое вещество (т. пл. 101 °С), нерастворимое в воде, легко растворимое
ворганических растворителях. Бензольные растворы фенантрена обладают голубой флуоресценцией.
По строению и реакционной способности фенантрен во многом сходен с антраценом. Как и антрацен, он является ароматическим соединением, однако ароматический характер фенантрена выражен несколько сильнее. Так, энергия сопряжения фенантрена (387 кДж/моль) на 35,5 кДж/моль выше, чем у антрацена.
Фенантрен так же, как и антрацен, легко вступает в реакции электрофильного замещения, восстановления и окисления. Наиболее активными являются положе-
ния 9 и 10. Химическая связь между С-9 и С-10 в фенантрене весьма напоминает двойную, поэтому при электрофильном замещении в отдельных случаях образуются промежуточные продукты присоединения, которые могут быть выделены
виндивидуальном виде:
9,10-дибром-9,10-дигидрофенантрен 9-бромфенантрен
При нитровании фенантрена азотной кислотой в среде уксусной кислоты образуется 9-нитрофенантрен.
многоЯдерные арены с конденсироВанными БензоЛьными ЦикЛами
235
Каталитическое гидрирование фенантрена приводит к образованию 9,10-ди- гидрофенантрена, при окислении — образуется 9,10-фенантренхинон:
2H (CuO/Cr2O3)
ÑÍÑ2 Í2
9,10-дигидрофенантрен
[O]; CrO3
–H2O
O
O
9,10-фенантренхинон
Сам фенантрен не нашел широкого технического применения. Однако его частично или полностью гидрированные производные входят в состав многих природних соединений, обладающих физиологической активностью — стероидов (см. разд. 37.3.2.), алкалоидов (см. разд. 33.6.) и др. Так, в основе стероидов лежит скелет стерана, который представляет собой конденсированную систему, состоящую из полностью гидрированного фенантренового ядра (пергидрофенантрена) и циклопентана:
стеран;
циклопентанопергидрофенантрен
фенантрен
à
бензо[a]антрацен
хризен
Промутагены
В ряду конденсированных аренов выявлена многочисленная группа промутагенов, то есть веществ, которые, подвергшись метаболизму в живом организме, приобретают мутагенную активность. Высоко их содержание в каменноугольной смоле, автомобильных выхлопных газах, табачном дыму и др.
В 1933 году осуществлен синтез одного из наиболее опасных канцерогенов — бензо[a]пирена. Попадая в организм, это соединение подвергается ферментативному расщеплению с образованием бензо[a]пирена дигидроксиэпоксида.
Наличие в структуре продукта окисления высокореакционного трехчленного цикла с атомом кислорода (см. Оксиран, подразд. 31.1.3) предопределяет взаимодействие с азотистыми основаниями, входящими
|
|
в состав ДНК. Как |
O |
|
следствие, |
проис- |
|
ходят серьезные |
[O]; H2O |
|
нарушения |
про- |
à |
|
цесса деления кле- |
HO |
|
ток и генетическо- |
|
OÍ |
го кода организма. |
|
|
|
бензо[a]пирен |
бензо[a]пирена |
|
дигидроксиэпоксид |
|
|
Глава 16
МНОГОЯДЕРНЫЕ АРЕНЫ С ИЗОЛИРОВАННЫМИ БЕНЗОЛЬНЫМИ ЦИКЛАМИ
К многоядерным аренам с изолированными циклами относят углеводороды, со-
держащие два или более бензольных цикла, соединенных между собой либо σ-свя- зью, либо через алифатическую углеродную цепь.
Наиболее важными представителями этой группы соединений являются бифе-
нил, дифенилметан и трифенилметан.
16.1. БИФЕНИЛ
Молекула бифенила содержит два бензольных кольца, соединенных σ-связью. Для обозначения положения заместителей в молекуле бифенила используют цифровые локанты и обозначения о-(орто-), м-(мета-) и п-(пара-) соответственно. Углеродные атомы каждого бензольного кольца нумеруют отдельно, начиная с атома углерода, посредством которого осуществляется связь со вторым циклом:
3 |
2 |
1′2′ 3′4′ |
H3C |
CH3 |
4 |
1 |
5 |
6 |
6′ 5′ |
|
бифенил |
|
4,4′-диметилбифенил; |
|
|
|
|
n,n′-диметилбифенил |
Наличие заместителей в положениях 2,6,2′,6′ часто обозначают в названии как
орто-, в положениях 3,5,3′,5′ — мета-, в 4,4′ — пара-.
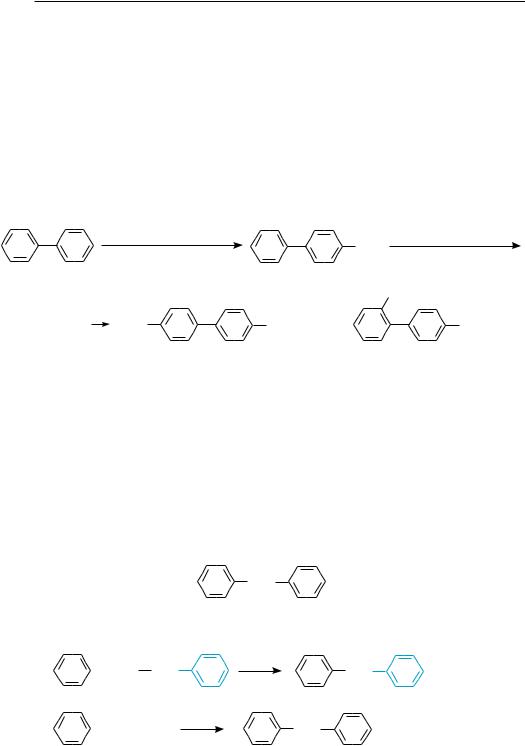
16.1.1.сПосоБы ПоЛучениЯ
Внебольшом количестве бифенил содержится в каменноугольной смоле.
Существует ряд синтетических способов получения бифенила:
дегидрирование бензола
нагревание йодбензола в присутствии порошка меди (реакция Ульмана):
|
2 |
I |
2Cu; 200—250 °C |
|
–2CuI |
|
|
|
16.1.2. сТроение. химические сВоЙсТВа
Два бензольных кольца в молекуле бифенила соединены между собой σ-свя- зью, длина которой (0,148 нм) несколько меньше длины углерод-углеродной связи в алканах (0,154 нм). Уменьшение длины σ-связи обусловлено мезомерным
многоЯдерные арены с изоЛироВанными БензоЛьными ЦикЛами 237
взаимодействием π-электронов бензольных колец, которое, как известно, наиболее эффективно при планарном расположении циклов.
Однако вследствие взаимного отталкивания атомов водорода в положениях 2 и 2′ мезомерное взаимодействие между бензольными циклами в бифениле за-
труднено:
H H
21 1′2′
1′2′
По данным электронографических исследований в газовой фазе бензольные кольца бифенила расположены под углом 45° друг к другу. Следовательно, вокруг σ-связи в молекуле бифенила возможно свободное вращение. При отсутствии в орто-положениях заместителей барьер вращения невелик. Но если в орто-по- ложениях обеих бензольных колец содержатся объемные заместители, то из-за пространственных препятствий свободное вращение вокруг σ-связи, соединяющей два цикла, становится невозможным и бензольные ядра располагаются во взаимно перпендикулярных плоскостях:
COOH Br
 Br HOOC
Br HOOC
Если хотя бы в одном из бензольных колец в орто-положениях имеются одинаковые заместители, то такая молекула имеет плоскость симметрии, а следовательно, она ахиральна:
плоскость
симметрии
NO2 HOOC
COOH HOOC
Но если в орто-положениях каждого бензольного ядра молекулы бифенила имеются разные заместители, молекула не имеет плоскости симметрии и становится хиральной, что, как известно, обусловливает появление оптической изомерии. Так, 6,6′-динитродифеновая кислота существует в виде двух энантиомеров:
COOH O2N |
NO2 HOOC |
NO2 HOOC |
COOH O2N |
Зеркальные изомеры в ряду бифенила можно рассматривать как конформеры, ставшие стабильными вследствие пространственных препятствий вращению.
Глава 16
238
Вид пространственной изомерии, обусловленный ограничением свободного вращения вокруг простой связи, называется атропоизомерией (от греч. ατροπο — нет поворота).
Для проявления атропоизомерии необязательно наличие четырех заместителей в орто-положениях, иногда достаточно трех или даже двух объемных групп.
Химические свойства бифенила аналогичны свойствам моноядерных аренов.
Фенильные группы проявляют по отношению друг к другу слабые электронодонорные свойства. Поэтому в реакции электрофильного замещения (галогенирование, нитрование и др.) бифенил вступает несколько легче, чем бензол, образуя преимущественно пара- и орто-замещенные продукты. В монозамещенных бифенила при электрофильном замещении новый заместитель вступает в незамещенное ядро:
HNO3 (êîíö.); H2SO4 (êîíö.) |
|
NO2 |
HNO3 (êîíö.); H2SO4 (êîíö.) |
–H2O |
|
–H2O |
|
|
|
4-нитробифенил |
|
|
|
|
|
NO2 |
O2N |
NO2 + |
|
NO2 |
4,4′-динитробифенил |
|
2,4′-динитробифенил |
Бифенил — бесцветное кристаллическое вещество (т. пл. 71 °С) со слабым своеобразным запахом, малорастворим в воде, хорошо растворяется в органических растворителях.
Применяется в смеси с дифениловым эфиром в качестве высокотемпературного теплоносителя для обогревания химических реакторов и других установок. Производные бифенила используют в производстве красителей.
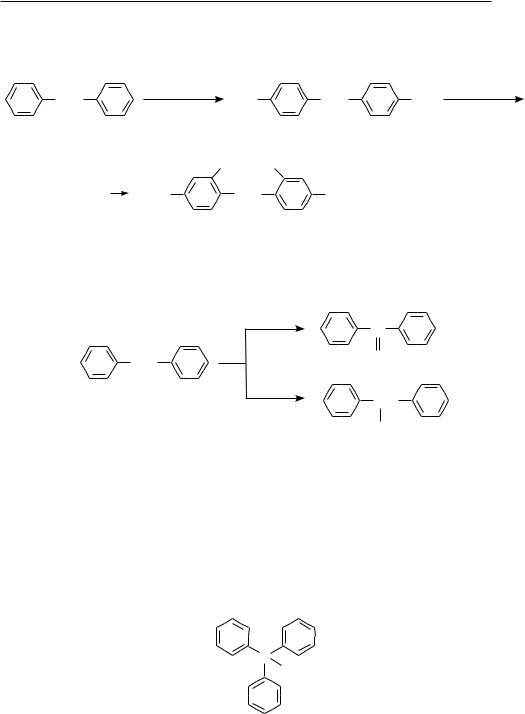
16.2. ДИФЕНИЛМЕТАН
В молекуле дифенилметана два бензольных цикла связаны через метиленовую группу:
3 |
2 |
CH2 |
1′2′ 3′4′ |
4 |
1 |
5 |
6 |
6′ 5′ |
Дифенилметан может быть получен алкилированием бензола бензилхлоридом или дихлорметаном в условиях реакции Фриделя—крафтса:
|
+ Cl CH2 |
|
AlCl3 |
CH2 |
+ HCl |
|
|
|
2 |
+ CH2Cl2 |
AlCl3 |
|
CH2 |
+ 2HCl |
|
|
Реакционная способность дифенилметана обусловлена наличием в его структуре бензольных циклов и активной метиленовой группы.
многоЯдерные арены с изоЛироВанными БензоЛьными ЦикЛами 239
С участием бензольных колец дифенилметан вступает в характерные для аренов реакции электрофильного замещения, образуя 4,4′-дизамещенные и 2,4,2′,4′- тетразамещенные продукты:
|
HNO3 (êîíö.); |
|
|
HNO3 (êîíö.); |
|
H2SO4 (êîíö.) |
|
|
H2SO4 (êîíö.) |
CH2 |
–H2O |
O2N |
CH2 |
NO2 –H2O |
|
|
|
4,4-динитродифенилметан |
|
|
|
NO2 O2N |
|
|
O2N |
CH2 |
NO2 |
|
2,4,2′,4′-тетранитродифенилметан
В молекуле дифенилметана вследствие электроноакцепторного действия фенильных групп приобретают подвижность атомы водорода метиленовой группы. В результате метиленовая группа легко окисляется, а при галогенировании водородные атомы замещаются на атом галогена:
CH2 |
O |
бензофенон |
Br2 |
CH |
–HBr |
|
Br |
|
дифенилбромметан |
Дифенилметан представляет собой бесцветное кристаллическое вещество (т. пл. 26—27 °С) со слабым приятным запахом, нерастворим в воде, растворим в этаноле. Используется в парфюмерной промышленности в качестве отдушки мыл (запах герани).
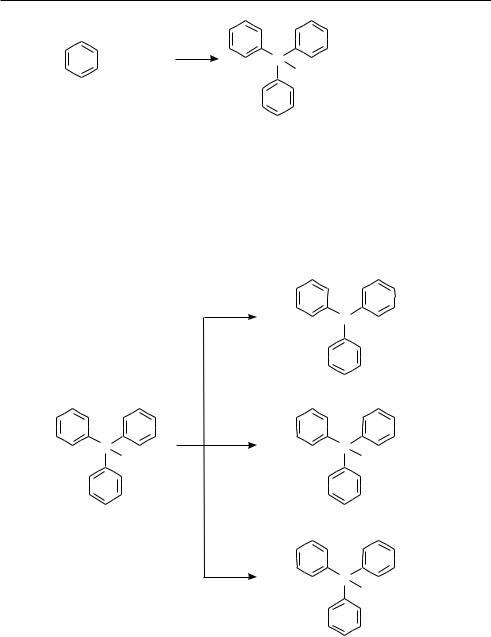
16.3. ТРИФЕНИЛМЕТАН
Молекула трифенилметана содержит три бензольных цикла, связанных через метиновую группу:
4′ |
3′ 2′ |
2 3 |
4 |
5′ |
6′ 1′ |
1 6 |
5 |
|
C |
H |
|
6′′1′′2′′ 5′′ 4′′3′′
Нумерацию углеродных атомов в каждом цикле проводят отдельно, начиная с атома углерода, связанного с метиновой группой.
Трифенилметан получают алкилированием бензола хлороформом в условиях реакции Фриделя—крафтса:
Глава 16
240
3 |
+ CHCl3 |
AlCl3 |
C |
+ 3HCl |
|
|
|
|
H |
По химическим свойствам трифенилметан во многом напоминает дифенилметан. Для него характерны реакции электрофильного замещения с участием бензольных циклов, которые идут главным образом в пара-положения.
Вследствие электроноакцепторного действия трех фенильных групп в молекуле трифенилметана приобретает подвижность атом водорода метиновой группы. Данный атом водорода легко замещается на металлы и галогены, за счет метиновой группы трифенилметан окисляется. Так, при действии натрия амида в жидком аммиаке трифенилметан образует трифенилметилнатрий, при взаимодействии с хлором дает трифенилхлорметан, при окислении — образует трифенилметанол (трифенилкарбинол):
NaNH2 |
– |
+ |
–NH3 |
C |
|
Na |
|
трифенилметилнатрий |
Cl2 |
C |
|
–HCl |
Cl |
|
|
трифенилхлорметан
[O]
C ÎH
трифенилметанол
Трифенилметилнатрий имеет ионное строение. Его молекула состоит из катиона натрия и трифенилметил-аниона. Эфирные растворы трифенилметилнатрия проводят электрический ток.
Атом галогена в молекуле трифенилхлорметана и гидроксильная группа
вмолекуле трифенилметанола под влиянием электроноакцепторных свойств трех бензольных колец проявляют высокую подвижность (активность). Так, трифенилхлорметан в жидком SO2 (растворитель с высокой диэлектрической постоянной)
вприсутствии AlCl3 подвергается ионизации с образованием трифенилметил-



 1′2′
1′2′ Br HOOC
Br HOOC