многоЯдерные арены с изоЛироВанными БензоЛьными ЦикЛами 241
катиона. Аналогично происходит ионизация трифенилметанола в концентрированной серной кислоте:
C |
+ AlCl3 |
SO2 (æèäê.) |
+ |
+ AlCl4– |
|
|
|
C |
|
|
Cl |
|
|
|
|
|
|
трифенилхлорметан |
|
|
|
|
|
|
C |
+ H SO |
(êîíö.) |
+ |
+ HSO– |
+ H |
O |
2 4 |
|
C |
4 |
2 |
|
OH |
|
|
|
|
|
|
трифенилметанол
Способность трифенилметильной группы образовывать устойчивые карбокатионы и карбанионы обусловлена участием бензольных циклов в делокализации положительного или отрицательного заряда иона за счет сопряжения:
δ+ |
δ+ δ+ |
δ+ |
δ− |
δ− δ− |
δ− |
|
+ |
|
|
– |
|
δ+ |
C |
δ+ |
δ− |
C |
δ− |
|
δ+ |
δ+ |
δ− |
|
δ− |
|
δ+ |
|
|
δ− |
|
трифенилметил-катион |
трифенилметил-анион |
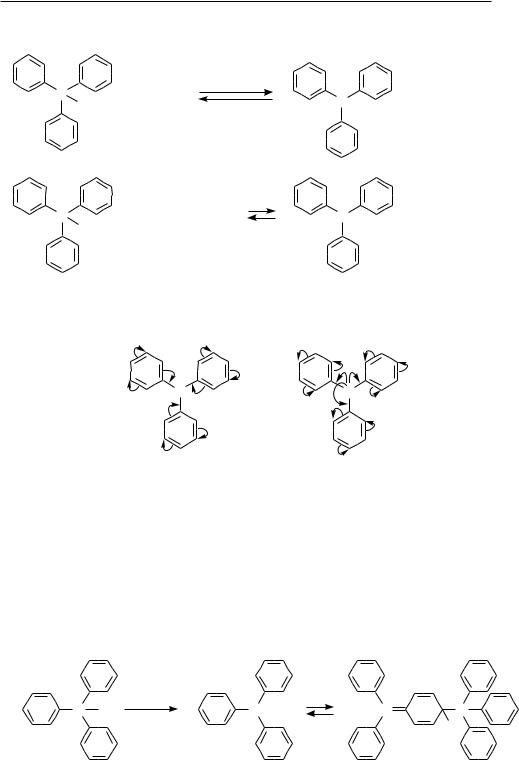
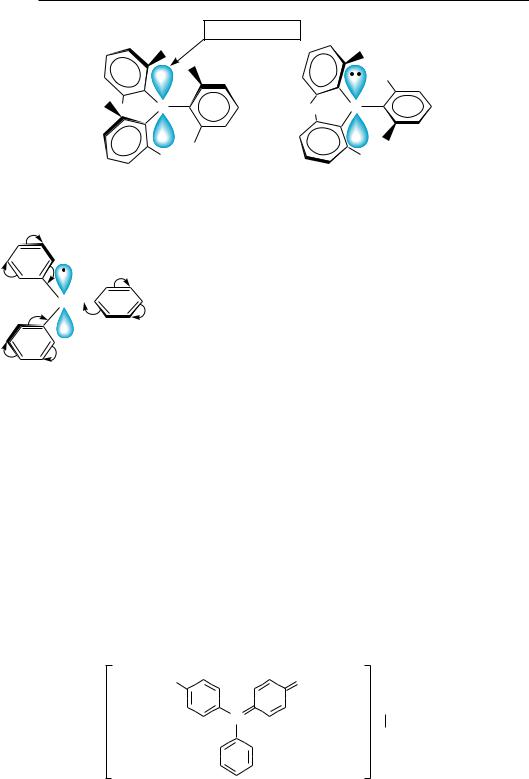
Однако, несмотря на то, что центральный атом углерода в трифенилметил-ка- тионе и трифенилметил-анионе находится в sp2-гибридизации, указанные ионы имеют не плоскостную, а пропеллерообразную структуру, в которой бензольные циклы вывернуты из плоскости на 30—40°. Такое размещение бензольных колец в пространстве связано со стерическим взаимодействием атомов водорода в орто- положениях (рис. 16.1).
Именно поэтому сопряжение центрального атома углерода с каждым ядром несколько меньше, чем можно было бы ожидать при плоскостной структуре.
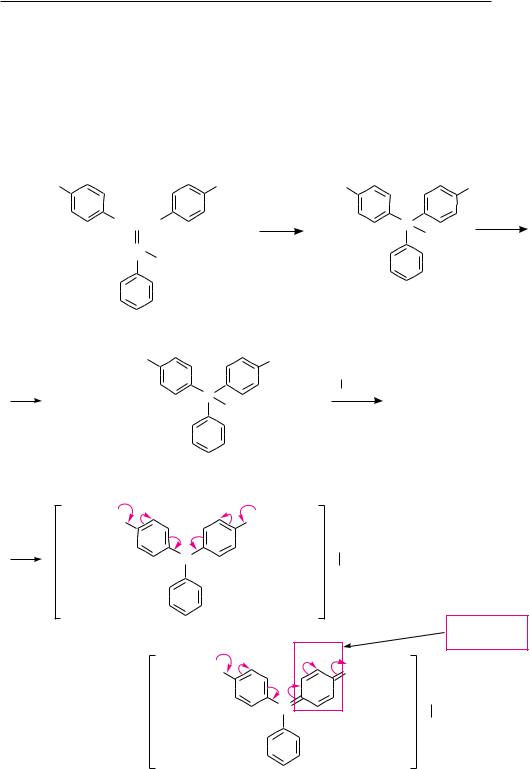
При обработке трифенилхлорметана цинком, натрием или мелкораздробленным серебром в бензольном растворе образуется свободный трифенилметильный радикал, находящийся в равновесии со своим димером:
2 |
C Cl |
Zn |
2 |
C. |
C |
C |
–ZnCl2 |
|
|
|
|
|
|
H |
трифенил- |
трифенилметил- |
производное |
хлорметан |
радикал |
циклогексадиена |
Глава 16
242
|
|
|
Вaкантная p-AO |
|
|
H |
H |
|
H |
|
|
|
H |
|
|
|
|
H H |
C |
|
H H |
C |
|
H H |
|
H H |
|
a |
|
|
á |
Рис. 16.1. Пространственное строение трифенилметил-катиона (а) и трифенилметил-аниона (б)
|
δ(.) |
|
|
|
|
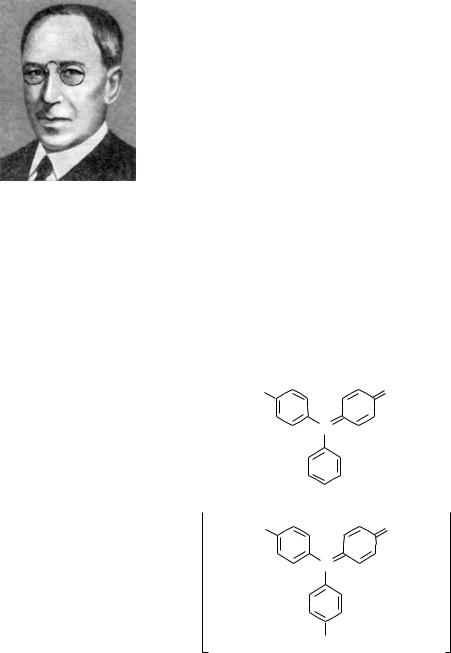
Впервые свободный трифенилметил-радикал был |
|
|
δ(.) |
|
получен в 1900 году американским химиком Мозесом |
|
|
|
Гомбергом при изучении химических свойств трифе- |
|
|
|
δ(.) |
|
|
δ(.) |
|
|
нилхлорметана. Это был первый из радикалов, выде- |
|
C |
|
|
δ(.) |
ленный в свободном виде. Причина столь высокой |
|
|
|
|
|
δ(.) |
δ(.) |
устойчивости трифенилметил-радикала по сравнению |
|
|
|
|
|
|
|
с алкильными радикалами состоит в значительной |
|
|
δ(.) |
|
делокализации неспаренного электрона по всем бен- |
|
δ(.) |
|
|
|
|
зольным ядрам. |
|
|
|
|
|
|
Трифенилметил-радикал является очень реакци- |
онноспособным веществом: на воздухе легко окисляется, образуя трифенилметила пероксид (C6H5)3C—O—O—C(C6H5)3, с металлическим натрием — трифенилметилнатрий (C6H5)3C–Na+, с йодом — йодтрифенилметан (C6H5)3C—І.
Трифенилметильный катион, анион и радикал имеют характерную окраску: трифенилметил-катион — красно-оранжевую, трифенилметил-анион – красную, а свободный трифенилметил-радикал — желтую. Появление окраски в указанных ионах и свободном радикале обусловлено наличием в их структуре достаточно длинной сопряженной системы (хромофора), включающей три бензольных цикла.
Производные трифенилметана нашли широкое практическое применение в качестве красителей и лекарственных препаратов.
16.3.1. красиТеЛи ТриФениЛмеТаноВого рЯда
Трифенилметановые красители являются аминоили гидроксипроизводными трифенилметана. Представителем аминотрифенилметанов является краси-
тель — бриллиантовый зеленый:
(C2H5)2N |
|
+ |
|
N(C2H5)2 |
|
C |
COO– |
|
COOH |
|
|
многоЯдерные арены с изоЛироВанными БензоЛьными ЦикЛами 243
Бриллиантовый зеленый получают конденсацией бензальдегида с N,N-ди- этиланилином в присутствии кислотного катализатора, чаще концентрированной хлороводородной кислоты. В результате реакции образуется бесцветное вещество, так называемое лейкооснование бриллиантового зеленого [4,4'-бис-(диэтилами- но)трифенилметан], которое затем окисляют свинца (IV) оксидом в кислой среде. При окислении образуется бесцветное вещество, получившее название карбинольное основание бриллиантового зеленого [4,4'-бис-(диэтиламино)три- фенилкарбинол], которое со щавелевой кислотой образует соль — краситель бриллиантовый зеленый:
(C2H5)2N |
|
|
N(C2H5)2 (C2H5)2N |
|
N(C2H5)2 |
|
H O H |
|
H |
+ |
C |
[O]; PbO2 |
|
|
|
|
|
|
N,N-диэтиланилин |
C |
|
|
–H2O |
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
бензальдегид |
|
|
|
лейкооснование |
|
|
|
|
|
бриллиантового зеленого |
(C2H5)2N |
|
|
N(C2H5)2 |
|
|
|
|
|
|
|
COOH |
|
|
|
|
C |
OH |
|
COOH |
|
|
|
|
|
–H2O |
|
|
|
|
карбинольное основание |
|
|
|
|
|
бриллиантового зеленого |
|
|
|
|
.. |
|
|
.. |
|
|
|
(C2H5)2N |
|
|
N(C2H5)2 |
|
|
|
|
+ |
|
|
COO– |
|
|
|
|
C |
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
èëè |
хиноидная |
|
|
|
|
|
|
|
|
|
.. |
|
|
|
группа |
|
|
|
+ |
|
|
|
|
(C2H5)2N |
|
N(C2H5)2 |
|
|
|
|
|
C |
|
COO– |
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
244 |
|
|
|
|
|
|
Глава 16 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Бриллиантовый |
зеленый |
представляет |
|
|
|
|
|
|
собой кристаллическое вещество золотисто- |
|
|
зеленого цвета, растворимое в воде, этаноле, |
|
|
хлороформе. Водные растворы имеют интен- |
|
|
сивно зеленую окраску, носителем которой |
|
|
является катион, содержащий в своем соста- |
|
|
ве длинную сопряженную систему, включа- |
|
|
ющую хиноидную группировку (хромофор), |
|
|
а также диэтиламино- и диэтиламмонийную |
|
|
группы (ауксохромы) (см. с. 329). Окрас- |
|
|
ка бриллиантовым зеленым малоустойчива |
|
|
к действию света и влажным обработкам, |
|
мозес гомБерг |
вследствие чего краситель применяется глав- |
|
ным образом для окрашивания нетекстиль- |
|
(1866—1947) |
ных материалов — бумаги, древесины и др. |
|
|
Американский химик. Член Наци- |
|
|
Бриллиантовый |
зеленый |
применяется |
ональной академии наук США. |
в медицине в виде 1—2 %-ных водных или |
Является основателем химии сво- |
спиртовых растворов как |
антисептическое |
бодных радикалов. Впервые полу- |
средство, а также при изготовлении бактери- |
чил (1897) тетрафенилметан. Открыл |
цидных лейкопластырей. |
|
|
|
|
|
|
(1900) существование свободных ра- |
|
|
|
|
|
|
|
|
К аминопроизводным |
трифенилметана |
дикалов. Изучал также металлоргани- |
|
|
относятся также красители — малахитовый |
ческие соединения. Совместно со сво- |
зеленый и кристаллический фиолетовый: |
им учеником В. Бахманом разработал |
способ конденсации двух арильных |
|
|
(CH3)2N |
|
|
+ |
|
|
|
|
|
|
|
|
|
|
радикалов с образованием производ- |
|
|
|
N(CH3)2 |
|
|
ных дифенила (реакция Гомберга). |
|
|
|
|
|
|
|
|
|
|
Создал первый удачный антифриз для |
|
|
C |
|
|
|
|
|
|
Cl– |
автомобилей. |
|
|
|
|
|
|
|
|
Президент Американского хими- |
|
|
|
|
|
|
|
|
|
|
ческого общества (1931). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
малахитовый зеленый |
|
|
|
|
|
|
|
|
|
|
(CH3)2N |
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N(CH3)2 |
|
|
|
|
C |
|
|
|
|
|
|
Cl– |
N(CH3)2
кристаллический фиолетовый
Малахитовый зеленый применяют для окрашивания тканей (хлопка, шерсти, шелка) в зеленый цвет. Кристаллический фиолетовый применяется главным образом как кислотно-основный индикатор для титрования в водных и неводных средах. В водной среде он имеет два перехода окраски: в интервалах pH = 0...1,0 желтая окраска переходит в зеленую, а при pH = 1,0...2,6 – зеленая окраска переходит в фиолетовую.
многоЯдерные арены с изоЛироВанными БензоЛьными ЦикЛами 245
Представителем гидроксипроизводных трифенилметана является фенолфталеин. Получают фенолфталеин конденсацией фенола с фталевым ангидридом в присутствии концентрированной серной кислоты. В результате реакции образуется бесцветная (лактонная) форма фенолфталеина:
HO |
|
OH |
|
|
|
H O H |
|
HO |
OH |
фенол |
H2SÎ4 |
(êîíö.); 130 °Ñ |
|
|
C |
C |
|
|
–H2O |
|
O |
|
O |
|
|
|
|
C |
|
|
C |
|
O |
|
|
O |
фталевый ангидрид |
|
фенолфталеин (бесцветная форма) |
Фенолфталеин представляет собой белое кристаллическое вещество, практически нерастворимое в воде, хорошо растворяется в этаноле, т. пл. 259—263 °С. Фенолфталеин применяют в аналитической практике как кислотно-основный индикатор. В кислой и нейтральной среде он находится в бесцветной лактонной форме, в щелочной среде (при pH = 8,2...10,0) приобретает малиново-красную окраску вследствие образования хиноидной структуры:
|
|
|
|
хиноидная |
HO |
OH |
+ |
– |
структура |
NaO |
O |
|
C |
2NaOH |
|
C |
|
|
|
O |
HCl |
– |
COONa+ |
C |
|
|
O |
|
|
фенолфталеин |
|
фенолфталеин |
(бесцветная форма) |
|
(форма с малиново-красной окраской) |
В сильнощелочной среде (рН > 12) малиново-красная окраска фенолфталеина исчезает в результате образования соли бензоидной структуры:
+ – |
|
O |
|
+ – |
– + |
NaO |
|
|
NaO |
ONa |
C |
|
|
NaOH |
C OH |
|
– |
+ |
HCl |
– + |
|
COONa |
|
COONa |
фенолфталеин |
|
|
бесцветная форма |
|
(форма с малиново-красной окраской) |
|
|
|
Фенолфталеин применяется в медицине как слабительное средство при хронических запорах (пурген).
Глава 17
НЕБЕНЗОИДНЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
Как уже отмечалось, критерием ароматичности соединения является наличие в его структуре плоского цикла, имеющего замкнутую сопряженную систему, содержащую (4n+2)π-электронов. Этим требованиям удовлетворяет ряд соединений, не содержащих в своем составе бензольных циклов. Наиболее важными представителями небензоидных ароматических систем являются циклопентадие-
нил-анион, циклогептатриенил-катион (тропилий-катион) и бициклический угле-
водород азулен.
HC |
|
CH |
HC |
|
CH |
HC |
CH |
CH |
|
|
|
|
|
HC |
– CH |
HC |
|
CH |
C |
|
HC |
CH |
|
C |
HC |
+ CH |
C |
|
HC |
CH |
|
|
|
|
H |
|
CH |
CH |
циклопентадиенил-анион |
циклогептатриенил-катион; |
|
азулен |
|
6π-электронов (n = 1) |
тропилий-катион |
10π-электронов (n = 2) |
6π-электронов (n = 1) |
17.1. ЦИКЛОПЕНТАДИЕНИЛ-АНИОН
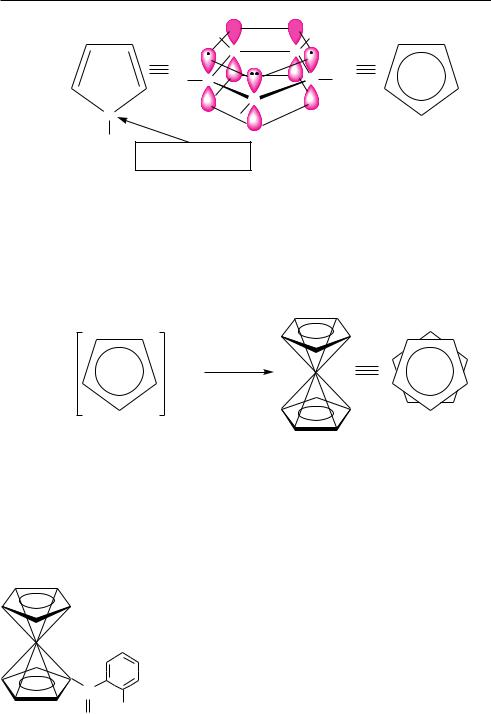
При взаимодействии 1,3-циклопентадиена с металлическим натрием в кипящем ксилоле активная метиленовая группа отщепляет протон, образуя циклопентадиенилнатрий, содержащий ароматический циклопентадиенил-анион:
1,3-циклопентадиен |
циклопентадиенилнатрий |
Вциклопентадиенил-анионе все пять атомов углерода находятся в sp2-гиб- ридизации. На пяти р-орбиталях размещаются шесть p-электронов (4 электрона двух π-связей и 2 электрона анионного центра) (рис. 17.1).
Врезультате перекрывания p-орбиталей образуется замкнутое π-электронное облако, имеющее ароматический секстет электронов. При этом отрицательный заряд анионного центра равномерно распределяется между пятью атомами углерода.
неБензоидные аромаТические соединениЯ
247
H 
 H
H
H sp2-гибридизованный атом углерода
Рис. 17.1. Схема образования ароматической системы циклопентадиенил-аниона
Ароматические свойства циклопентадиенил-аниона подтверждаются его способностью вступать в реакции электрофильного замещения (сульфирования, азосочетания), а также образовывать устойчивые π-комплексы с катионами двухвалентных металлов группы железа (железо, кобальт, никель). При взаимодействии циклопентадиенилнатрия с солями железа (II) образуется ферроцен (дициклопентадиенилжелезо):
2 |
– |
Na |
+ |
FeCl2 |
Fe |
Fe |
|
– 2NaCl |
|
|
|
|
|
|
вид сверху
ферроцен
Ферроцен является представителем группы металлорганических соединений, получивших общее название «металлоцены».
Методом рентгеноструктурного анализа установлено, что циклопентадиенильные анионы в ферроцене размещены друг над другом в двух параллельных плоскостях, между которыми расположен атом железа. Такое строение, напоминающее расположение масла между двумя кусками хлеба в бутерброде, получило название «сэндвичевой структуры» (от англ. sandwich — бутерброд).
Молекула ферроцена представляет собой π-ком- плекс, который образуется в результате перекрывания связывающих π-МО двух циклопентадиенил-
|
Fe |
анионов с вакантными АО катиона железа. |
|
Ферроцен является типичным ароматическим со- |
|
|
|
|
единением. Он устойчив к нагреванию и каталити- |
|
C |
ческому гидрированию, вступает в реакции электро- |
|
фильного замещения — алкилирования и ацилирова- |
Oния по Фриделю—Крафтсу, сульфирования.COONa
|
ферроцерон |
В технике ферроцен применяют в качестве ан- |
|
тидетонатора и термически стойкого теплоносителя. |
|
|
Производное ферроцена — ферроцерон — применяется в медицине для лечения железодефицитных анемий.
Глава 17
248
17.2. ЦИКЛОГЕПТАТРИЕНИЛ-КАТИОН
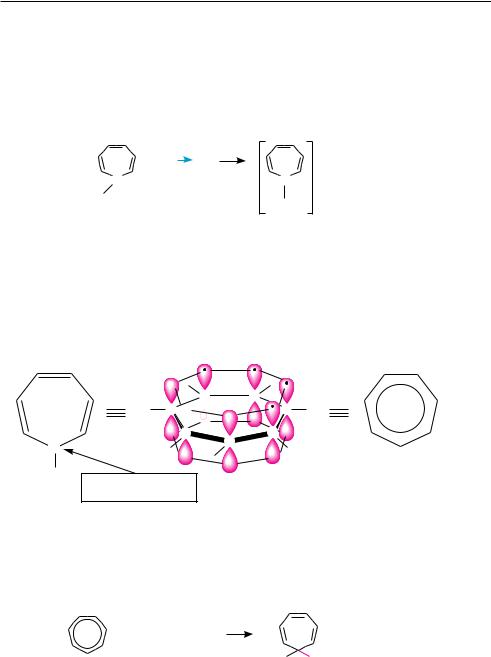
Циклогептатриенил-катион (тропилий-катион) образуется при отщеплении гидрид-иона (атома водорода с двумя электронами) от метиленовой группы 1,3,5-циклогептатриена (тропилидена). Так, при взаимодействии 1,3,5-циклогеп- татриена с бромом образуется тропилия бромид, который содержит циклогеп- татриенил-катион:
δ+ |
δ– |
|
Br– + HBr |
+ Br |
Br |
+ |
C. |
|
|
|
C |
|
. |
|
|
H H |
|
H |
|
|
|
|
1,3,5-циклогептатриен |
|
тропилия бромид |
Тропилий-катион обладает ароматичностью. В семичленной циклической структуре тропилиевого иона все атомы углерода находятся в sp2-гибридизации. В результате перекрывания шести одноэлектронных p-орбиталей двойных связей и одной вакантной p-орбитали атома углерода катионного центра образуется замкнутое π-электронное облако (ароматический секстет), охватывающее все углеродные атомы цикла. При этом положительный заряд катионного центра равномерно распределяется между семью атомами углерода (рис. 17.2).
 H
H
C C
H C

|
+ |
C |
C |
|
C |
H |
|
H |
|
|
|
H |
|
|
sp2-гибридизованный |
|
|
|
атом углерода |
|
Рис. 17.2. Схема образования ароматической системы циклогептатриенил-катиона
Вследствие ароматичности тропилий-катион довольно устойчив. Имея дефицит электронной плотности, тропилий-катион проявляет электрофильные свойства и легко вступает в реакции с нуклеофильными реагентами, образуя продукты присоединения, приводящие к нарушению ароматичности:
+ |
Br |
– |
+ CH3ONa |
54 3 2 |
|
6 7 1 |
|
|
|
|
тропилия бромид |
H |
OCH3 |
7-метокси-1,3,5-циклогептатриен |
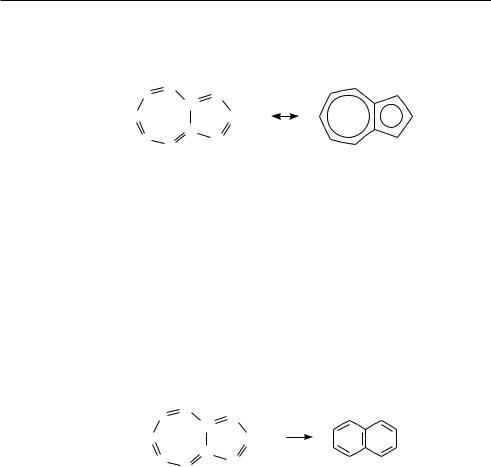
17.3. АЗУЛЕН
Азулен представляет собой бициклическую конденсированную систему, состоящую из циклопентадиенового и циклогептатриенового колец:
неБензоидные аромаТические соединениЯ
249
Молекула азулена имеет биполярное строение — атомы углерода пятичленного цикла несут частичный отрицательный, а семичленного — частичный положительный заряд.
HC7 |
CH |
CH |
|
|
8 |
C |
|
|
HC 6 |
|
1 |
|
|
|
|
2 CH |
+ |
– |
HC5 4 C 3CH
CH
азулен;
бицикло[5.3.0]декапентаен
Образование биполярной структуры обусловлено стремлением каждого кольца иметь ароматический секстет p-электронов. Такая возможность появляется при переходе одного электрона из семичленного цикла в пятичленный, вследствие чего пятичленное кольцо приобретает отрицательный заряд, а семичленное — положительный.
Поэтому азулен можно рассматривать как конденсированную систему, состоящую из циклопентадиенил-аниона и тропилий-катиона. Азулен обладает ароматичностью. Ароматический характер азулена проявляется в склонности к реакциям электрофильного замещения (галогенирование, нитрование, сульфирование, ацилирование), которые протекают по пятичленному кольцу в положениях
1 или 1 и 3.
При нагревании азулен изомеризуется в нафталин:
Алкилпроизводные азулена содержатся в эфирных маслах ряда лекарственных растений (ромашки, тысячелистника, полыни, эвкалипта и др.). Их присутствием обусловлено противовоспалительное действие этих растений.
Глава 18
ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Галогенопроизводными углеводородов называют продукты замещения в углеводо родах одного или нескольких атомов водорода атомами галогенов.
Галогенопроизводные углеводородов в зависимости от природы углеводород-
ного радикала подразделяют на алифатические, алициклические и ароматические.
В ряду алифатических галогенопроизводных углеводородов различают насыщен-
ные (галогеналканы) и ненасыщенные (галогеналкены, галогеналкины). Аромати-
ческие галогенопроизводные углеводородов делят на соединения, в которых атом галогена непосредственно связан с ароматическим ядром (галогенарены), и вещества, содержащие атом галогена в боковой цепи (арилалкилгалогениды). В соответствии с природой атома галогена галогенопроизводные углеводородов подразделяют на фтор-, хлор-, бром-, йодпроизводные. По числу атомов галогена в молекуле разли-
чают моно-, ди-, три- и полигалогенопроизводные углеводородов.
18. 1. НОМЕНКЛАТУРА
По заместительной номенклатуре IUPAC названия галогенопроизводных углеводородов составляют аналогично названиям соответствующих углеводородов. Входящие в их состав атомы галогенов обозначают в названии в виде префикса, к которому прибавляют название родоначальной структуры. За родоначальную структуру в алифатических галогенопроизводных углеводородов принимается главная углеродная цепь, в алициклических и ароматических — цикл:
|
|
3 |
|
|
|
|
Cl |
Br |
4 |
|
|
2 |
1 |
|
|
CH3 |
|
CH2 |
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
2-áðîìбутан |
õëîðциклогексан |
áðîìбензол |
Если при родоначальной структуре имеется несколько заместителей, которыми, кроме атомов галогенов, могут быть и углеводородные радикалы, то в названии их перечисляют в алфавитном порядке. Атомы углерода родоначальной структуры нумеруют в данном случае таким образом, чтобы заместитель, который обозначен в названии первым, получил возможно меньший номер:
1 |
2 |
3 |
4 |
|
5 |
5 |
4 |
3 |
2 |
|
|
1 |
CH3 |
|
|
CH |
|
CH2 |
|
|
CH |
|
CH3 |
CH3 |
|
|
CH |
|
CH2 |
|
|
CH |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
CH3 |
|
|
|
Cl |
|
|
|
CH3 |
|
|
2-áðîì-4-метилпентан |
|
|
|
2-метил-4-õëîðпентан |
|
|









 H
H H
H
