
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
аЛкины |
|
|
|
181 |
|
|
|
|
|
|
|
|
KMnO |
; OH– |
|
||
|
|
|
|||
4 |
|
|
|
|
|
CH3—CH2—C—C—CH3 |
|
|
CH3—CH2—COOH + CH3—COOH |
||
|
|
||||
2-пентин |
|
|
пропановая кислота |
уксусная кислота |
|
Алкины с концевой тройной связью при окислении в этих условиях образуют карбоновую кислоту и углерода (IV) оксид:
CH3—CH2—C—CH |
O3(ССl4) |
CH3—CH2—COOH + СO2 |
|
||
1-бутин |
|
пропановая кислота |
Под действием калия перманганата в нейтральной среде, рутения (VIII) или селена (IV) оксида алкины окисляются до α-дикетонов:
R—C—C—R' KMnO4; H2O 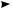 R—C—C—R'
R—C—C—R'
О О
α-дикетон
Восстановление алкинов. Алкины в присутствии катализаторов Pd, Pt или Ni восстанавливаются с образованием алканов. Процесс гидрирования осуществляется ступенчато:
CH3—C—CH |
H2(кат.) |
CH3—CH—CH2 |
H2(кат.) |
CH3—CH2—CH3 |
|
|
|||
пропин |
|
пропен |
|
пропан |
Образующийся в качестве промежуточного продукта алкен не удается выделить в свободном состоянии вследствие быстрого превращения в алкан. Однако при использовании в качестве катализатора палладия, частично дезактивированного солями свинца, процесс восстановления останавливается на стадии образования алкена, причем водород присоединяется в цис-положение:
CH3—C—C—СH3 |
H2(Pd/PbCO3) |
H |
H |
|
С—C |
||
|
H3C |
||
|
|
CH3 |
|
2-бутин |
|
|
цис-2-бутен |
При восстановлении алкинов с помощью натрия в жидком аммиаке водород также присоединяется селективно, но с образованием транс-изомера:
|
H |
(Na; NH |
) |
H |
CH3 |
2 |
3 |
|
|
|
|
CH3—C—C—СH3 |
|
|
|
H3C |
С—C |
|
|
|
|||
|
|
|
|
H |
|
2-бутин |
|
|
|
|
транс-2-бутен |
12.4.5. димеризаЦиЯ, ТримеризаЦиЯ и ТеТрамеризаЦиЯ аЛкиноВ
Ацетилен в присутствии меди (I) хлорида и аммония хлорида димеризуется с образованием винилацетилена:
HC—CH + HC—CH кат.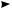 HC—C—СH—СH2
HC—C—СH—СH2
винилацетилен
Глава 12
182
Реакция имеет важное промышленное значение, так как винилацетилен используют в качестве промежуточного продукта при производстве синтетических каучуков.
Ацетилен и его гомологи подвергаются циклотримеризации.
При нагревании ацетилена в присутствии активированного угля образуется бензол.
— C(акт.) ; t
3HC CH
бензол
Алкины при нагревании в присутствии комплексных никельорганических катализаторов Ni(CO)2[(C6H5)3P]2 подвергаются циклотримеризации с образованием бензола и его замещенных:
СH3
3СH3—C—CH кат.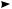
H3С
 СH3
СH3
1,3,5-триметилбензол
Ацетилен при нагревании в присутствии катализатора никеля цианида подвергается циклотетрамеризации с образованием циклооктатетраена:
— Ni(СN)2
4HС CH
циклооктатетраен
12.5. ИДЕНТИФИКАЦИЯ АЛКИНОВ
Наличие кратной связи в структуре алкинов, как и в алкенах, обнаруживают реакциями с раствором брома или калия перманганата (наблюдается исчезновение характерной окраски). Для отличия алкинов с концевой тройной связью от алкенов используют реакцию образования ацетиленидов. Доказательством наличия в соединении группы —С—Н служит образование осадка с аммиачным раствором серебра оксида или меди (I) хлорида (см. с. 179).
ВИК-спектрах алкинов с концевой тройной связью наблюдается полоса
поглощения в области 3300 см–1, характеризующая валентные колебания группировки —С—Н. Для несимметричных алкинов характерна слабоинтенсивная
полоса поглощения в области 2300—2100 см–1, отвечающая валентным колебаниям тройной углерод-углеродной связи. У симметричных алкинов R—С—С—R аналогичная полоса в ИК-спектре определяется с трудом.
Алкины подобно алканам и алкенам поглощают УФ-излучение в области ниже 200 нм.
ВПМР-спектрах алкинов сигналы протона при атоме углерода с тройной связью (—С—Н) проявляются в области 2,3–2,9 млн–1.
Расщепление алкинов при получении масс-спектров происходит таким же образом, как и в случае алкенов.
аЛкины
183
12.6. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ. ПРИМЕНЕНИЕ
ацетилен НС—СН. Бесцветный газ, без запаха, плохо растворим в воде, горит ярким, сильно коптящим пламенем, с воздухом образует взрывчатые смеси. При сгорании ацетилена в кислороде выделяется большое количество тепла (температура пламени достигает 3000 °С). Это позволяет использовать ацетилен для автогенной сварки и резки металлов.
2C2H2 + 5O2  4CO2 + 2H2O + 1300 кДж
4CO2 + 2H2O + 1300 кДж
Ацетилен является сырьем для многих химических производств. В промышленности его используют для получения уксусного альдегида и хлорвинила Н2С—СН—С1, из которых в дальнейшем получают уксусную кислоту и полихлорвинил соответственно.
Большое количество ацетилена используют в технике для получения винилацетилена, который затем действием хлороводорода превращают в хлоропрен (2-хлор-1,3-бутадиен), а частичным гидрированием — в 1,3-бутадиен:
|
|
HCl |
H2C—C—СH—СH2 |
HC—C—СH—СH2 |
|
|
|
|
|
Cl |
|
|
|
||
|
|
H2 |
H2C—CH—СH—СH2 |
|
|
|
Хлоропрен и 1,3-бутадиен служат ценным исходным сырьем для получения синтетического каучука. Полимеризацией хлоропрена получают хлоропреновый каучук, полимеризацией 1,3-бутадиена — бутадиеновый каучук.
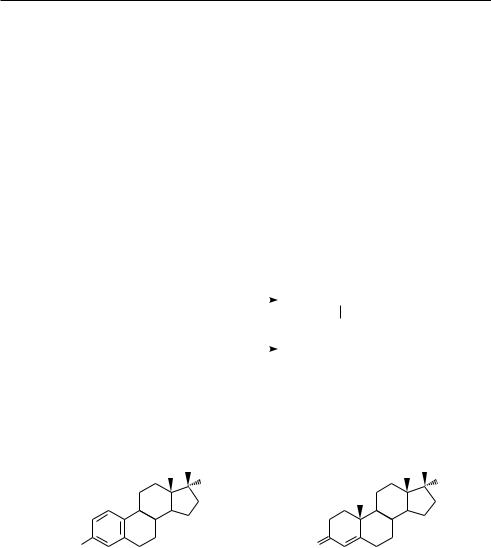
Ряд лекарственных веществ стероидной природы содержит в своей структуре тройную связь (местранол, прегнин и др.).
H |
C OH |
H |
C OH |
3 |
C—CH |
3 |
C—CH |
|
H3C |
||
|
|
|
|
CH3O |
|
O |
|
местранол |
|
прегнин |
|

Глава 13
АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ. ЦИКЛОАЛКАНЫ
Алициклическими (от алифатические циклические) называют углеводороды, молекулы которых содержат один или несколько циклов неароматического характера.
13.1. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА АЛИЦИКЛИЧЕСКИХ УГЛЕВОДОРОДОВ
Алициклические углеводороды классифицируют в зависимости от числа циклов, их величины и способа соединения.
По числу циклов, входящих в состав молекулы, алициклические углеводороды
подразделяют на моно- и полициклические (би-, трициклические и др.).
В ряду моноциклических алициклических соединений выделяют малые циклы
(С3 и С 4), обычные (С5—С7), средние (С8—С11) и макроциклы (12 и более атомов углерода).
Наиболее многочисленная группа в ряду алициклических углеводородов — моноциклические соединения. С целью упрощения написания структурных формул алициклические соединения условно изображают в виде геометрических структур (многоугольников).
|
|
СH |
2 |
≡ |
H2С |
|
СH2 |
≡ |
||
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||
H |
С |
|
СH |
H |
С |
|
СH |
|||
|
2 |
|
2 |
|||||||
2 |
|
|
|
|
2 |
|
СH2 |
|||
|
|
|
|
|
|
|
|
|
||
В соответствии с правилами IUPAC названия моноциклических алициклических углеводородов образуют от названий алканов с соответствующим количеством атомов углерода, прибавляя префикс цикло-:
циклопропан циклобутан циклопентан циклогексан
Положение заместителей в кольце обозначают с помощью цифровых локантов. Нумерацию углеродных атомов цикла начинают с атома, имеющего заместитель; далее проводят таким образом, чтобы остальные атомы углерода цикла, связанные с заместителями, получили возможно меньшие номера. При наличии в цикле кратной связи нумерацию начинают с атомов углерода, образующих кратную связь.

аЛиЦикЛические угЛеВодороды. ЦикЛоаЛканы
185
|
|
|
C2H5 |
|
|
CH3 |
|
CH3 |
4 |
|
3 |
5 |
6 |
2 |
|||
5 |
|
|
2 |
|
1 |
1 |
3 |
|
1 |
4 |
3 |
2 |
6 |
4 |
|||
|
|
|
|
|
CH3 |
5 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|||
|
|
|
|
|
|
|||
1-метил-3-ýòèëциклопентан |
1,2-диметилциклогексан |
3-метилциклогексeí |
||||||
Структуры, состоящие из двух и более циклов, относят к полициклическим (многоядерным) углеводородам. В зависимости от взаимного расположения циклов многоядерные алициклические углеводороды подразделяют на следующие основные группы:
(СH2)n |
— с изолированными циклами, разделенными углерод-угле- |
родной цепью; |
—с циклами, непосредственно связанными простой (или двойной) углерод-углеродной связью;
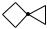 — с циклами, имеющими один общий атом (спираны);
— с циклами, имеющими один общий атом (спираны);
 — с циклами, имеющими два общих атома (конденсированные
— с циклами, имеющими два общих атома (конденсированные  системы);
системы);
— с числом общих атомов в цикле больше двух (мостиковые
системы).
Для первых двух групп углеводородов в названиях используют преимущественно рациональную номенклатуру:
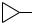 СH2
СH2
циклопропилциклопентилметан циклопропилциклопентан
Название спирановой системы составляют, прибавляя префикс спиро- к названию углеводорода с соответствующим числом атомов углерода. Между префиксом и названием в квадратных скобках указывают (в порядке возрастания) число атомов углерода, исключая общий, в каждом из циклов. Нумерацию углеродных атомов спирановой системы начинают с меньшего цикла, причем узловой атом нумеруют последним.
4 |
5 |
1 |
|
3 |
8 |
4 |
5 |
7 |
8 |
9 |
1 |
|
3 |
|
2 |
2 |
1 |
|
7 |
6 |
6 |
4 |
|
3 |
2 |
|
|
|
|
|
|
|
5 |
|
|
|
||
спиро[2.2]пентан |
спиро[3.4]октан |
спиро[3.5]нонан |
||||||||||
Названия конденсированных и мостиковых алициклических соединений образуют, прибавляя префикс бицикло- к названию углеводорода с соответствующим числом атомов углерода. Между префиксом и названием углеводорода
вквадратных скобках указывают (в порядке убывания) число атомов углерода
вкаждой из трех цепей, соединяющих два третичных (узловых) углеродных атома (последние при этом не учитывают). Нумерацию атомов углерода начинают с одного из узловых атомов и осуществляют таким образом, чтобы вначале была пронумерована самая длинная цепь, соединяющая узловые атомы, затем более короткая, а в случае мостиковых систем — в заключение нумеруют самую короткую углеродную цепь — мостик:
аЛиЦикЛические угЛеВодороды. ЦикЛоаЛканы |
|
187 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
СH3 |
H |
СH3 |
|||
|
|
|
|||||
|
H |
|
H |
|
|
||
H |
|
H |
H3С |
|
H |
||
|
|||||||
|
H |
|
H |
|
|
||
цис-1,2-диметилциклопропан |
транс-1,2-диметилциклопропан |
||||||
Оптическая изомерия характерна для циклоалканов, молекулы которых не имеют плоскости симметрии (см. с. 88). Она неразрывно связана с геометрической изомерией. Так, транс-1,2-диметилциклопропан существует в виде пары
энантиомеров: |
|
|
СH3 |
H3С |
|
|
H |
||
H |
|
|
|
|
|||||
|
* |
H |
* |
* |
H |
* |
|
||
|
|
|
|
|
|
||||
H3С |
|
|
H |
H |
|
|
СH3 |
||
|
|
|
|
||||||
|
|
H |
|
|
H |
|
|
||
энантиомеры транс-1,2-диметилциклопропана
13.3. СПОСОБЫ ПОЛУЧЕНИЯ
Некоторые циклоалканы (циклопропан, циклогексан и другие), а также их гомологи входят в состав некоторых видов нефти, из которых могут быть выделены в чистом виде.
Существует ряд синтетических методов получения циклоалканов.
Взаимодействие α,ω-дигалогеналканов1 с металлическим натрием или цинком.
Данный метод, представляющий собой внутримолекулярный вариант реакции Вюрца, позволяет получить трех-, четырех- и пятичленные циклоалканы:
CH2—CH2—Br |
|
CH2— |
CH2 |
|
|
|
+ Zn |
|
|
|
+ ZnBr2 |
|
|
|
|
||
CH2—CH2—Br |
|
CH2—CH2 |
|
||
1,4-дибромбутан |
циклобутан |
|
|||
Пиролиз кальциевых, бариевых или ториевых солей дикарбоновых кислот. При пиролизе (сухой перегонке) кальциевых, бариевых или ториевых солей дикарбоновых кислот образуются циклические кетоны, которые затем восстанавливают до соответствующих циклоалканов:
|
O |
|
|
|
|
|
|
|
CH2—CH2—С |
|
|
CH2—CH2 С—O |
|
|
CH2—CH2 СH |
|
|
|
O |
t |
|
[H] |
|
|
||
|
Сa |
|
|
2 |
||||
|
O |
–CaСO3 |
CH2—CH2 |
–H2O |
CH2—CH2 |
|||
|
|
|
|
|||||
CH2—CH2—С |
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
кальция адипинат |
|
циклопентанон |
|
циклопентан |
|
||
Кальциевые и бариевые соли дикарбоновых кислот образуют с хорошими выходами только пяти- и шестичленные циклы. Для получения больших циклов используют соли тория.
1 Последнюю букву греческого алфавита ω (омега) применяют для обозначения заместителя, находящегося на конце углеродной цепи.
Глава 13
188
реакции циклоприсоединения. Циклоприсоединением называют процесс соединения двух или нескольких ненасыщенных молекул с образованием продукта цикли-
ческого строения. В зависимости от числа атомов, принимающих участие в об-
разовании цикла, различают [2+1]-циклоприсоединение, [2+2]-циклоприсоединение и [4+2]-циклоприсоединение.
Реакции циклоприсоединения имеют важное значение для синтеза различных алициклических соединений.
Взаимодействие алкенов с карбенами ([2+1]-циклоприсоединение). Карбены яв-
ляются органическими радикалами (см. с. 302), которые образуются в качестве промежуточных продуктов при разложении диазоалканов или дегидрогалогенировании галогеналканов. При взаимодействии карбенов с алкенами образуются производные циклопропана:
+ – |
hν |
|
H2С—N—N |
|
:СH2 + N2 |
|
||
диазометан |
|
карбен |
|
|
СH2 |
СH3—СH—СH2 + :СH2 |
|
СH3—СH—СH2 |
|
||
пропен |
|
метилциклопропан |
Димеризация алкенов ([2+2]-циклоприсоединение). Циклоприсоединение двух молекул алкена происходит только под действием ультрафиолетового света (фотохимически) и приводит к образованию циклобутана и его производных:
|
|
CH2 |
+ |
|
CH2 |
hν |
CH2— |
CH2 |
|
|
|||||||
|
|
|
|
|
|
CH2—CH2 |
||
CH2 |
CH2 |
|
||||||
|
|
|
|
|
|
|
циклобутан |
|
Реакция Дильса—Альдера (диеновый синтез). Реакция представляет собой присоединение алкена к сопряженному диену (см. с. 169). Диеновый синтез относится к реакциям [4+2]-циклоприсоединения и находит широкое применение для получения циклогексана и его производных. Реакция протекает легко при комнатной температуре или незначительном нагревании. Образующийся циклоалкен восстанавливают до циклоалкана:
HC |
CH2 |
C |
H2 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
[H] |
|
|
||||||
|
|
|
|
+ |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HC |
CH2 |
CH2 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
1,3-бутадиен |
|
|
|
циклогексен |
циклогексан |
|||||||||||
|
|
CH3 |
|
|
|
|
|
CH3 |
CH3 |
|||||||
HC CH |
C |
H2 |
|
|
||||||||||||
|
1 6 |
5 |
|
[H] |
|
|
||||||||||
|
|
|
|
+ |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
2 3 |
4 |
|
|
|
|
|
||
HC |
CH |
C |
H |
2 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
CH3 |
CH3 |
||||||
|
|
CH3 |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2,4-гексадиен |
|
|
|
3,6-диметил-1-циклогексен 1,4-диметилциклогексан |
||||||||||||
аЛиЦикЛические угЛеВодороды. ЦикЛоаЛканы
189
Электроциклические реакции. Электроциклической называют реакцию, в которой происходит образование σ-связи между концами открытой сопряженной систе-
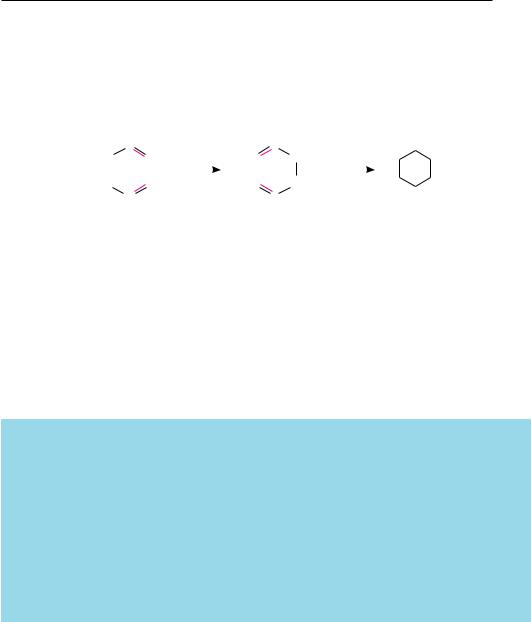
мы молекулы. К электроциклическим реакциям относят также обратные процессы, то есть происходящие с разрывом σ-связи и образованием сопряженной системы. С помощью электроциклических реакций замыкания цикла, инициирующихся термически или фотохимически, получают ненасыщенные и алициклические соединения, которые могут быть восстановлены до циклоалканов:
|
|
СH |
|
|
|
СH |
|
HC |
|
CH2 |
|
HC |
|
CH2 |
[H] |
|
|
|
|
||||
|
|
CH2 |
|
|
|
CH2 |
|
HC |
|
|
HC |
|
|||
|
|
СH |
|
|
|
СH |
|
1,3,5-гексатриен |
1,3-циклогексадиен |
циклогексан |
|||||
13.4. ФИЗИЧЕСКИЕ СВОЙСТВА
В обычных условиях циклопропан и циклобутан являются газообразными веществами, циклоалканы с размером цикла от С5 до С11 представляют собой жидкости, последующие представители — твердые вещества (табл. 13.1). По сравнению с соответствующими алканами (см. табл. 9.3) циклоалканы имеют несколько более высокие температуры кипения и плавления. Все циклоалканы практически нерастворимы в воде.
|
|
|
Таблица 13.1 |
|
|
Физические характеристики циклоалканов |
|
||
|
|
|
|
|
Соединение |
Название |
Температура, °С |
||
|
|
|||
плавления |
кипения |
|||
|
|
|||
С3Н6 |
Циклопропан |
–127 |
–33 |
|
С4Н8 |
Метилциклопропан |
–177 |
0,7 |
|
С4Н8 |
Циклобутан |
–80 |
13 |
|
С5Н10 |
Циклопентан |
–93,8 |
49,3 |
|
С5Н10 |
Метилциклобутан |
149,3 |
36,8 |
|
С6Н12 |
Циклогексан |
6,5 |
80,7 |
|
С6Н12 |
Метилциклопентан |
–142,2 |
71,9 |
|
С7Н14 |
Циклогептан |
–12 |
118 |
|
С8Н16 |
Циклооктан |
14 |
151 |
|
13. 5. СТРОЕНИЕ ЦИКЛОАЛКАНОВ
Аналогично алканам в молекулах циклоалканов атомы углерода находятся в состоянии sр3-гибридизации. Но если молекулы алканов обладают значительной гибкостью за счет свободного вращения вокруг углерод-углеродных связей, то молекулы циклоалканов, несмотря на возможные конформационные повороты, представляют собой в определенной степени жесткие образования.
Для молекул циклоалканов, как и для алканов, характерны торсионное напряжение (напряжение Питцера), связанное со взаимодействием химических связей

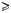 3).
3).