
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf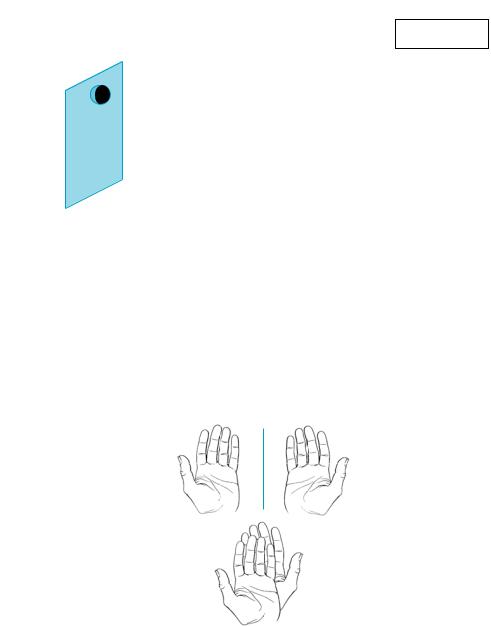
изомериЯ органических соединениЙ
Плоскость симметрии |
|
Центр симметрии |
|
|
|
|
|
Ñl |
Í |
|
H |
|
|
Cl |
|
F |
F |
Cl |
|
||
|
|
||
|
H |
|
|
|
|
Í |
Ñl |
71
Ось симметрии 3-го порядка
|
Í |
Ñl |
Ñ |
Ñl |
Ñl |
|
Рис. 5.4. Элементы симметрии органических молекул:
а — дихлорметана; б — 1,3 дифтор-2,4 дихлорциклобутана; в — хлороформа
Различные объекты, в том числе и молекулы, не имеющие плоскости, центра и оси симметрии, обладают свойством не совмещаться со своим зеркальным изображением. Это свойство называют хиральностью (от греч. χειρ — рука), а молекулы им обладающие — хиральными.
Термин «хиральность» был введен английским физиком У. Томпсоном (1884). Наглядным примером хиральности могут служить левая и правая руки, которые являются зеркальным отражением друг друга, но вместе с тем их нельзя совместить при любом способе наложения (рис. 5.5). По этой причине перчатка с левой руки не пригодна для правой и наоборот.
зеркало
Рис. 5.5. Хиральные объекты
Молекулы, имеющие хотя бы один элемент симметрии, всегда идентичны со своим зеркальным изображением и называются ахиральными.
Хиральность молекулы можно легко установить путем построения модели молекулы и модели ее зеркального изображения с последующим их совмещением. Если модели не совмещаются — молекула хиральна, если совмещаются — ахиральна. Такой же вывод можно сделать и на основе стереохимических формул молекул по наличию или отсутствию элементов симметрии, чаще всего плоскости симметрии:
Глава 5
72
|
|
|
Cl |
|
|
|
C2H5 |
|||
хиральные молекулы |
|
|
|
|
|
|
|
|||
|
|
C |
|
|
|
C |
|
|||
(плоскость симметрии |
|
Br |
H |
H3C |
H |
|||||
отсутствует) |
|
|
|
I |
|
|
Cl |
|||
|
|
|
|
|
|
|
|
|||
|
бромйодхлорметан |
|
2-хлорбутан |
|||||||
|
|
|
|
|
|
|
|
|
|
|
ахиральные молекулы |
|
|
H |
|
|
|
Cl |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
C |
|
|||
(имеется |
|
Cl |
Cl |
|
Br |
Н |
||||
плоскость симметрии) |
|
|
|
Cl |
|
|
|
H |
||
|
|
|
|
|
|
|
|
|||
|
|
хлороформ |
|
бромхлорметан |
||||||
Хиральность молекул является обязательным условием для проявления веществом оптической активности.
соединения с одним асимметрическим атомом углерода. Одной из причин воз-
никновения хиральности органических молекул является наличие в их структуре sр3-гибридизованного атома углерода, связанного с четырьмя разными заместителями. Такой атом углерода называют хиральным, или асимметрическим. Часто для него применяют более общее название — «хиральный центр». В структурных формулах асимметрический атом углерода принято обозначать звездочкой — С*:
|
H |
|
|
|
H |
||
CH |
|
|
|
|
|
|
|
—C*—C |
H |
|
CH |
—C*—COOH |
|||
3 |
|
2 |
|
5 |
3 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
OH |
||
2-хлорбутан |
|
|
молочная кислота |
||||
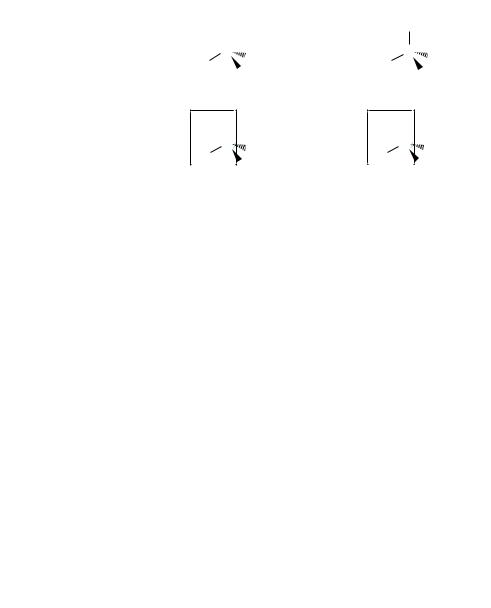
Молекулы, содержащие один асимметрический атом углерода, существуют в виде двух изомеров, относящихся друг к другу как хиральный предмет к своему зеркальному изображению. Такие изомеры называют энантиомерами (рис. 5.6).
зеркало
Рис. 5.6. Модели энантиомерных молекул бромйодхлорметана
Зеркальное изображение хиральной молекулы образуется, если поменять местами любые два заместителя у асимметрического атома углерода. Энантиомеры очень похожи друг на друга, но, тем не менее, не тождественны. Они имеют одинаковый состав и последовательность связывания атомов в молекуле, но отличаются относительным расположением их в пространстве, то есть конфигурацией. Если в изомере а переход от атома йода к атому хлора через атом брома направлен по часовой стрелке, то в изомере б аналогичный переход имеет противоположное направление (см. рис. 5.6). В том, что эти молекулы разные, можно легко убедиться при наложении их моделей друг на друга (см. рис. 5.6, в).
изомериЯ органических соединениЙ
73
Энантиомеры идентичны по физическим и химическим свойствам. Существенное отличие их состоит в том, что они по-разному относятся к поляризованному свету, а именно: вращают плоскость поляризации на один и тот же угол, но в противоположных направлениях (если один вращает влево, то другой — на такой же угол вправо). Поэтому их еще называют оптическими изомерами, или оптическими антиподами. Кроме того, энантиомеры с различной скоростью реагируют с другими хиральными соединениями и, как правило, обладают разной физиологической активностью.
Смесь равных количеств энантиомеров называют рацемической. Такая смесь не обладает оптической активностью, так как одинаковое по значению, но противоположное по направлению вращение взаимно компенсируется. Для обозначения рацемической смеси перед названием соединения ставят символ (±).
химия в зеркале
Многие органические соединения существуют в виде стереоизомеров, которые относятся друг к другу как предмет и его зеркальное отображение. Молекулы этих соединений несовместимы друг с другом, то есть являются хиральными объектами. Хиральность — универсальное явление мироздания.
Поскольку существуют две зеркальные формы, достаточно неожиданным является тот факт, что в нашем организме и в остальном биологическом мире присутствует лишь один из изомеров. Так, обычные сахара (см. гл. 34) — преимущественно представители D-ряда, а аминокислоты в составе белков (см. гл. 35) — представители L-ряда. Поэтому и неудивительно, что ферменты нашего организма стереоспецифичны, то есть «узнают» только один зеркальный изомер. Помните, как главная героиня детской повести Льюис Кэрролл «Алиса в Зазеркалье» размышляет: «Вкусно ли молоко, отраженное в зеркале?». «Молоко, отраженное в зеркале» не может быть нашей пищей. Очень даже возможно, что оно окажется токсичным для нас! Сахара и белки, содержащиеся в таком «молоке», будут иметь иную конфигурацию (D-аминокислоты, L-монозы) и не могут быть расщеплены ферментами нашего организма.
Специалисты, занимающиеся созданием новых лекарственных препаратов, пристальное внимание уделяют их стереохимической чистоте. В середине пятидесятых годов прошлого столетия в ФРГ был разработан и внедрен в медицинскую практику препарат «Толидомид». Однако в 1961 году появились первые сообщения о серьезных проблемах, связанных с его применением. Были зафиксированы многочисленные случаи рождения детей с врожденными дефектами и установлено, что во время беременности будущие матери принимали данный препарат в качестве седативного средства. Лишь в 1979 году немецким химикам удалось разделить энантиомеры данного препарата.
O O |
H |
H |
O O |
|
N |
N |
|
N |
О |
О |
N |
O H |
|
|
H O |
R-энантиомер |
|
S-энантиомер |
|
Оказалось, что токсический тератогенный эффект оказывает S-(–)-энантиомер. Можно было бы рекомендовать применение R-энантиомера, однако в 1984 году установили, что в организме происходит быстрое взаимопревращение энантиомеров. В настоящее время препарат применяют для лечения особо тяжелых случаев проказы.
Вкус, запах и фармакологический эффект соединений зависят от их стереохимической формы и взаимодействия с клеточными ферментами и рецепторами.
Глава 5
74
изображение оптических изомеров на плоскости. Для изображения пространс-
твенного строения оптических изомеров на плоскости могут быть использованы стереохимические формулы. Например, энантиомеры 2-бутанола, изображенные с помощью стереохимических формул, имеют следующий вид:
|
CH3 |
|
CH3 |
||
C2H5 |
C H |
H |
C |
C2H5 |
|
|
OH |
HO |
|
||
|
|
|
|
||
Однако стереохимические формулы не удобны для описания пространственного строения молекул с несколькими асимметрическими атомами. Поэтому чаще всего оптические изомеры изображают на плоскости с помощью проекционных формул Фишера. Для получения проекционной формулы Фишера необходимо руководствоваться определенными правилами расположения тетраэдрической модели молекулы в пространстве. Вначале модель молекулы располагают таким образом, чтобы главная углеродная цепь была ориентирована вертикально, причем вверху находился тот ее конец, с которого согласно номенклатуре IUPAC начинали нумерацию атомов. Затем модель ориентируют в пространстве так, чтобы асимметрический атом углерода находился в плоскости чертежа, заместители, расположенные горизонтально, были над плоскостью, а расположенные вертикально — за плоскостью чертежа. При проецировании такой модели на плоскость получают проекционную формулу Фишера, в которой связи, находящиеся за плоскостью, изображают вертикальными линиями, а расположенные над плоскостью — горизонтальными. Асимметрический атом углерода при этом расположен в точке пересечения вертикальной и горизонтальной линий и обычно не обозначается символом.
Используя для наглядности клиновидную форму изображения связей, получение проекционной формулы Фишера одного из энантиомеров 2-бутанола можно представить следующим образом:
|
CH3 |
CH3 |
CH3 |
||
C2H5 |
C H ≡ HO |
C H ≡ HO |
|
H |
|
|
|||||
|
OH |
C2H5 |
C2H5 |
||
|
|
||||
|
|
|
|||
Аналогичные приемы применяют при построении проекций Фишера для молекул, содержащих несколько асимметрических атомов углерода:
HC |
O |
H |
|
|
CHO |
|
CHO |
|||||
C |
|
HO |
C |
H |
HO |
|
|
H |
||||
|
OH |
≡ |
|
|
||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
≡ |
|
|
|
|
|||
|
|
|
H |
|
HO |
|
|
|
|
|
|
|
H2C |
C |
|
C |
H |
HO |
|
|
H |
||||
OH |
|
|
|
|||||||||
OH |
|
|
CH2OH |
|
|
|
|
|||||
|
|
|
|
|
|
CH2OH |
||||||
Чтобы убедиться, являются ли молекулы идентичными или разными, необходимо проверить, совмещаются их проекционные формулы при наложении или нет. Согласно правилам обращения проекционные формулы Фишера нельзя выводить из плоскости чертежа, а также поворачивать в плоскости на 90°, хотя поворот на 180° в плоскости чертежа разрешается. Как и в реальной молекуле,

изомериЯ органических соединениЙ
75
перемена местами в формуле Фишера двух любых заместителей при асимметрическом атоме углерода приводит к формуле оптического антипода:
|
CH3 |
|
меняются местами |
|
CH3 |
|||||
HO |
|
|
H |
|
Н и ОН |
H |
|
|
OH |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
C2H5 |
||||
|
|
|
|
энантиомеры 2-бутанола |
|
|
|
|
||
соединения с несколькими асимметрическими атомами углерода. Если молекула имеет несколько асимметрических атомов углерода, число возможных изомеров увеличивается.
Общее количество стереоизомеров в молекуле, содержащей несколько асимметрических атомов углерода с разным набором заместителей, можно рассчитать по формуле
N = 2n,
где N — количество изомеров;
n — число асимметрических атомов углерода.
Так, при наличии в молекуле двух неэквивалентных асимметрических атомов углерода число изомеров равно N = 22 = 4, если содержится три — число стереоизомеров соответственно равно 23 = 8 и т. д. — * — * —
Например, хлоряблочная кислота НООС СНОН СНСl СООН имеет два асимметрических атома углерода и существует в виде четырех пространственных изомеров:
|
COOH |
|
COOH |
|
COOH |
|
COOH |
||||||||||||
H |
|
|
|
OH |
HO |
|
|
|
H |
H |
|
|
|
OH |
HO |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Cl |
|
|
|
H |
H |
|
|
|
Cl |
H |
|
|
|
Cl |
Cl |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
COOH |
|
|
|
COOH |
|
|
|
COOH |
|
|
|
COOH |
||||
|
|
|
|
|
|
|
|
||||||||||||
|
I. |
|
II. |
|
III. |
|
IV. |
||||||||||||
В том, что молекулы I—IV неидентичны, легко убедиться, используя метод наложения. Поскольку приведенные изомеры не имеют плоскости симметрии, все они обладают оптической активностью. Изомеры I, II, а также III, IV представляют собой зеркальное изображение друг друга, то есть являются энантиомерами. Как уже отмечалось, энантиомеры обладают одинаковыми физическими и химическими свойствами, имеют равное по значению, но противоположное по знаку удельное вращение. Однако энантиомеры I, II отличаются по физикохимическим характеристикам от энантиомеров III, IV.
Стереоизомеры I, III и I, IV, а также II, III и II, IV не являются зеркальным изображением друг друга. Они имеют одинаковую конфигурацию при одном асимметрическом атоме углерода, но разную — при другом. Такие стереоизомеры
называют диастереомерами. В отличие от энантиомеров, диастереомеры обладают разными физическими и химическими свойствами, имеют разное по значению удельное вращение.
Когда молекула содержит два асимметрических атома углерода с одинаковым набором заместителей, число стереоизомеров уменьшается с четырех до трех. В данном случае один из изомеров имеет плоскость симметрии, поэтому он совместим со своим зеркальным изображением. Этот изомер называется мезоформой.
Глава 5
76
Примером может служить винная кислота — * — * —
HOOC СH СH COOH, имею-
OH OH
щая только три изомера — два энантиомера и одну мезоформу:
|
COOH |
|
|
COOH |
|
|
COOH |
|||||||||
HO |
|
|
|
H |
H |
|
|
|
|
OH |
H |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
||||||
H |
|
|
|
OH |
HO |
|
|
|
|
H |
H |
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
COOH |
|
|
|
|
COOH |
|
|
|
|
COOH |
|||
|
|
|
|
|
|
|
|
|||||||||
плоскость
симметрии
энантиомеры |
мезоформа |
Если для мезоформы изобразить формально оптический антипод, то, повернув его проекцию на 180° в плоскости чертежа, получим первоначальную структуру. Это свидетельствует о том, что данные стереоизомеры идентичны:
|
|
COOH |
|
|
COOH |
||||||
H |
|
|
|
|
OH |
≡ |
HO |
|
|
|
H |
|
|
|
|
|
|
|
|||||
H |
|
|
|
|
OH |
|
HO |
|
|
|
H |
|
|
|
|
|
|
|
|
||||
|
|
|
|
COOH |
|
|
|
|
COOH |
||
|
|
|
|
|
|
||||||
мезоформа
Молекула мезоформы имеет плоскость симметрии, следовательно, она ахиральна, а поэтому не обладает оптической активностью. Мезоформа является типичным примером, когда молекула, имеющая несколько хиральных центров, в целом может быть ахиральной. Каждый из энантиомеров винной кислоты по отношению к мезоформе является диастереомером.
оптически активные соединения с другими асимметрическими атомами. Поми-
мо атома углерода, молекула может иметь в качестве асимметрического центра и другие атомы, связанные с четырьмя разными заместителями. Это, в частности, атомы кремния, азота, фосфора. Такие молекулы проявляют оптическую активность и образуют устойчивые оптические изомеры.
|
CH3 |
|
CH3 |
|
|||
C2H5 |
Si C6H4—COOH |
HOOC—C6H4 Si |
|
C2H5 |
|||
|
C6H5 |
C6H5 |
|
|
|||
|
|
|
|
|
|
||
Br– + |
CH3 |
|
CH3 |
Br– |
|||
N |
H |
H |
N |
+ |
|
||
|
|
||||||
C6H5 |
|
|
|
C6H5 |
|||
|
C2H5 |
C2H5 |
|
|
|||
|
|
|
|
|
|
||
Наряду с этим имеются асимметрично построенные соединения, в молекулах которых хиральный центр (атомы азота, фосфора, серы) связан не с четырьмя, а с тремя разными группами. Роль четвертого заместителя в данном случае выполняет неподеленная электронная пара. Примерами таких соединений могут служить вторичные (а) и третичные (б) амины, фосфины (в) и сульфоксиды (г):

изомериЯ органических соединениЙ |
|
|
|
|
|
|
|
77 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
CH3 |
|
|
|
H |
|
|
|
C6H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
C N |
|
|
N |
|
P |
O S |
||||||||||||
H |
|
H C |
H |
C |
|
C6H4—CH3 |
|||||||||||||
3 |
|
|
|
|
5 |
2 |
|
|
|
3 |
|
|
|
C2H5 |
|
|
|
||
|
|
|
|
C2H5 |
|
|
|
|
C3H7 |
|
|
|
|
|
|
||||
|
|
а |
|
|
|
|
б |
|
|
в |
|
|
г |
|
|
||||
|
Следует |
отметить, |
что |
|
конфигурационные |
изомеры |
соединений с трехва- |
||||||||||||
лентным асимметрическим центром крайне неустойчивы. При обычных условиях происходит быстро протекающий процесс взаимопревращения энантиомеров друг в друга, поэтому выделить оптически активные изомеры удается лишь в редких случаях.
Кроме рассмотренных примеров, оптическая изомерия свойственна также некоторым веществам, не имеющим асимметрических атомов (см. атропоизо-
мерия).
номенклатура оптических изомеров. Поскольку оптические изомеры отличаются друг от друга лишь конфигурацией молекул и отношением к поляризованному свету, в их номенклатуре наряду с названием, отражающим химическое строение, указывается также конфигурация и направление вращения поляризованного света.
Отклонение плоскополяризованного луча вправо обозначают в названии оптического изомера знаком (+), а влево — знаком (–). Чтобы сказать, какой энантиомер из пары имеет правое, а какой — левое вращение, необходимо знать истинное расположение вокруг хирального центра, то есть абсолютную конфигурацию молекул. Важно отметить, что направление и угол вращения плоскости поляризации не связаны каким-либо образом с конфигурацией. Определение абсолютной конфигурации молекул оказалось для химиков довольно сложной задачей. Лишь в 1951 году методом рентгеноструктурного анализа была впервые установлена абсолютная конфигурация натрий-рубидиевой соли (+)-винной кислоты. До этого времени конфигурация оптических изомеров устанавливалась методом сравнения со специально выбранным стандартным веществом. Такая конфигурация получила название «относительной». В 1906 году русским ученым
М. А. Розановым в качестве стандарта для установления относительной конфи-
— * — —
гурации был предложен глицериновый альдегид СН2(ОН) СН(ОН) СН О. Правовращающему изомеру глицеринового альдегида была произвольно приписана абсолютная конфигурация, в фишеровской проекции которой группа —ОН находится справа. Такую конфигурацию обозначили буквой D. Левовращающе-
му энантиомеру глицеринового альдегида соответственно приписана зеркальная конфигурация, которую обозначили буквой L (группа —ОН в проекции Фишера расположена слева):
|
|
|
O |
|
|
|
O |
|
C |
|
C |
||||
|
|
|
H |
HO |
|
|
H |
H |
|
|
OH |
|
|
H |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
CH2OH |
|
CH2OH |
||||
D-(+)-глицериновый альдегид |
L-(–)-глицериновый альдегид |
||||||
Глицериновый альдегид выбран в качестве стандарта по той причине, что с помощью ряда химических реакций его можно превратить во многие другие

Глава 5
78
оптически активные соединения, не затрагивая связи с асимметрическим атомом углерода. Например, без нарушения конфигурации хирального центра (+)-гли- цериновый альдегид можно превратить в (–)-молочную кислоту. Следовательно,
(–)-молочная кислота будет иметь такую же конфигурацию, что и (+)-глицери- новый альдегид, то есть D-конфигурацию:
|
CHO |
|
|
|
|
COOH |
|
|
|
COOH |
|
|
COOH |
|||||||||
|
|
|
|
|
Br |
/H |
O |
|
|
|
|
PBr |
3 |
|
|
|
|
Zn/H+ |
|
|
||
H |
|
|
OH |
|
2 |
2 |
|
H |
|
|
OH |
|
H |
|
|
OH |
|
H |
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
CH2OH |
|
|
|
|
|
CH2OH |
|
|
|
|
CH2Br |
|
|
|
CH3 |
|||||
D-(+)-глицериновый |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
D-(–)-молочная |
|||||||
|
альдегид |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
|||||
Этот пример свидетельствует о том, что молекулы с одинаковой конфигурацией необязательно должны вращать плоскость поляризованного света в одном направлении.
Аналогичным образом, независимо от знака вращения, конфигурация других оптически активных соединений косвенно отнесена к D- или L-глицериновому альдегиду или соответственно к D- или L-стереохимическому ряду.
Позже экспериментальным путем было установлено, что произвольно приписанная (+)- и (–)-глицериновому альдегиду конфигурация соответствует истинному расположению заместителей в пространстве, то есть абсолютной конфигурации этих веществ. Это удачное совпадение позволило избежать путаницы в химической литературе, так как установленная для различных соединений относительная конфигурация приобрела силу абсолютной.
D,L-Система обозначения конфигурации оптических изомеров применима толь-
ко для структурно родственных глицериновому альдегиду соединений. К ним относят вещества с такой конфигурацией хирального центра, когда в проекции Фишера с одной стороны от вертикальной линии расположен атом водорода, а с другой — группа —ОН, —NH2, —NO2, атом галогена и др. Если указанные заместители находятся справа, молекула имеет D-конфигурацию, а если слева — L-конфигурацию:
|
|
COOH |
|
|
|
COOH |
|
CH3 |
|||
|
|
|
|||||||||
H |
|
|
OH |
H2N |
|
|
|
H |
H |
|
Cl |
|
|
|
|
|
|
||||||
|
|
CH2COOH |
|
|
CH3 |
|
C2H5 |
||||
D-яблочная кислота |
L-аланин |
D-2-хлорбутан |
|||||||||
Применительно к соединениям с несколькими хиральными центрами принадлежность изомеров к D- или L-стереохимическому ряду устанавливают по конфигурации асимметрического атома углерода с наибольшим порядковым номером, то есть по нижнему асимметрическому атому углерода в проекции Фишера:
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
C |
||
|
|
|
O |
|
C |
H |
|
|
H |
||
|
|
|
|
|
|
OH |
|||||
|
C |
|
|
|
H |
|
|
||||
|
|
|
|
|
|
||||||
|
H |
|
|
OH |
HO |
|
|
H |
|||
|
|
|
H |
|
|
|
|
||||
|
|
|
|
|
|
|
|||||
HO |
|
|
H |
H |
|
|
OH |
H |
|
|
OH |
|
|
|
|
|
|
||||||
H |
|
|
OH |
HO |
|
|
H |
H |
|
|
OH |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
|
CH2OH |
|
CH2OH |
||||||
D-треоза |
L-рибоза |
D-глюкоза |
|||||||||
изомериЯ органических соединениЙ
79
Исключением из этого правила являются α-аминокислоты, α-гидроксикислоты, винная кислота, в которых принадлежность к D- или L-ряду устанавливают по конфигурации α-углеродного атома (верхнего асимметрического атома углерода в проекции Фишера):
|
COOH |
|
COOH |
|
COOH |
|||||||
H2N |
|
|
H |
H |
|
|
|
OH |
HO |
|
|
H |
|
|
|
|
|
|
|
||||||
H |
|
|
OH |
HO |
|
|
|
H |
H |
|
|
OH |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
COOH |
|
|
|
|||
|
CH3 |
|
|
|
CH3 |
|||||||
L-треонин |
D-винная |
L-α,β-дигидрокси- |
||||||||||
|
|
|
|
кислота |
масляная кислота |
|||||||
Пространственное положение одинаковых заместителей в молекулах с двумя соседними асимметрическими атомами углерода принято обозначать в названии изомера приставками трео- и эритро-.
Треоизомерами называют вещества, в проекциях Фишера которых одинаковые заместители при асимметрических атомах углерода расположены по разные стороны, эритро изомерами — соответственно по одну сторону:
|
COOH |
|
COOH |
||||||
H |
|
|
|
OH |
HO |
|
|
|
H |
|
|
|
|
|
|
||||
H |
|
|
|
Cl |
Cl |
|
|
|
H |
|
|
|
|
|
|
||||
|
|
|
COOH |
|
|
|
COOH |
||
|
|
|
|
||||||
Владимир ПреЛог
(1906—1998)
Швейцарский химик. Работы посвящены стереохимии, синтезу и исследованию органических соединений, в том числе антибиотиков. Сформулировал (1950) правило Прелога о предпочтительной конформации оптически активных веществ в ходе их превращения. Разработал (1966) совместно с К. Ингольдом общепринятую систему R,S-обозначений для пространственных конфигураций, они же ввели понятие «хиральность». Лауреат Нобелевской премии (1975, совместно с Дж. У. Корнфортом).
|
COOH |
|
COOH |
||||||
H |
|
|
|
OH |
HO |
|
|
|
H |
|
|
|
|
|
|
||||
Cl |
|
|
|
H |
H |
|
|
|
Cl |
|
|
|
|
|
|
||||
|
|
|
COOH |
|
|
|
COOH |
||
|
|
|
|
||||||
D-эритро-хлоряблочная |
L-эритро-хлоряблочная |
D-трео-хлоряблочная |
L-трео-хлоряблочная |
кислота |
кислота |
кислота |
кислота |
D,L-Система обозначения конфигурации, несмотря на широкое использование, имеет ограниченную область применения. Иногда соединение содержит такие заместители вокруг асимметрического центра, что бывает просто невозможно каким-либо образом сравнить его конфигурацию с глицериновым альдегидом.
В последнее время в органической химии все шире стала применяться более универсальная номенклатурная система обозначения абсолютной конфигурации оптических изомеров — R,S-система, предложенная Каном, Ингольдом и Прелогом.
R,S-Система основана на определении направления последовательного убывания старшинства заместителей, связанных с асимметрическим атомом углерода.
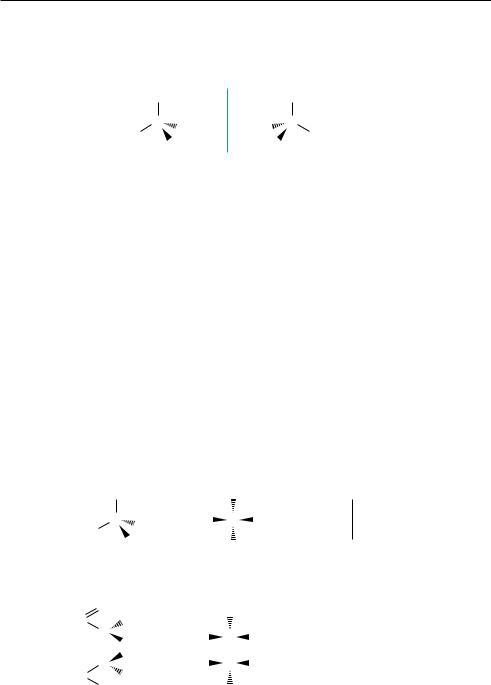
Старшинство заместителей устанавливается подсчетом атомных номеров элементов, вначале непосредственно связанных с хиральным центром, а затем, если это необходимо,— элементов последующих элементных слоев. Чем больше атомный номер, тем старше заместитель. В молекуле бромйодхлорметана
Глава 5
80
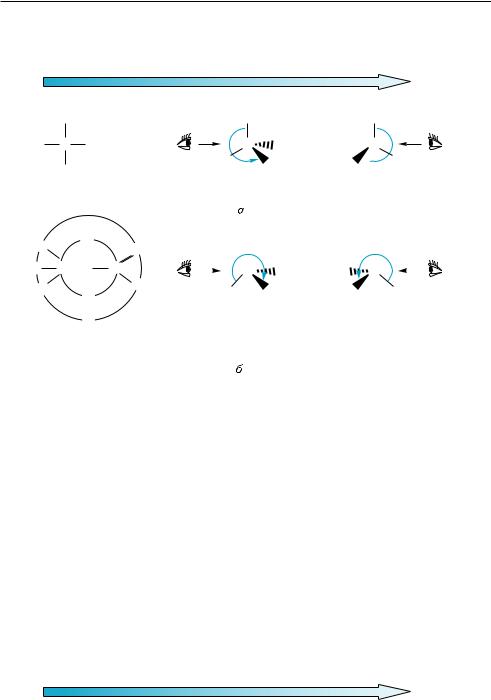
(рис. 5.7, а) заместители образуют следующий ряд последовательно убывающего старшинства:
—I, —Вr, —С1, —Н
|
|
1H |
|
|
I |
|
|
53 |
I |
|
* |
35 |
Br |
* |
H |
|
C |
|
C |
||||
|
|
17 |
Cl |
|
|
Br |
Cl |
|
|
|
|
|
|
|
|
I
H C*
C*
Cl  Br
Br
–I > –Br > –Cl > –H S-конфигурация R-конфигурация
1H |
1H |
O8×2 |
|
|
|
COOH |
|
|
|
COOH |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
||||||||||||||||||
1H |
6C |
|
|
|
* 6C |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
C |
8O |
|
1H |
|
C* |
H |
H |
C* |
|
||||||||||
|
|
|
|
|||||||||||||||||
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
1 |
H |
|
|
|
|
|
|
HO |
CH3 |
H3C |
|
|
OH |
|||||||
8O |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
H |
|
|
|
R-конфигурация |
S-конфигурация |
||||||||||||
–OH > –COOH > –CH3 > –H |
||||||||||||||||||||
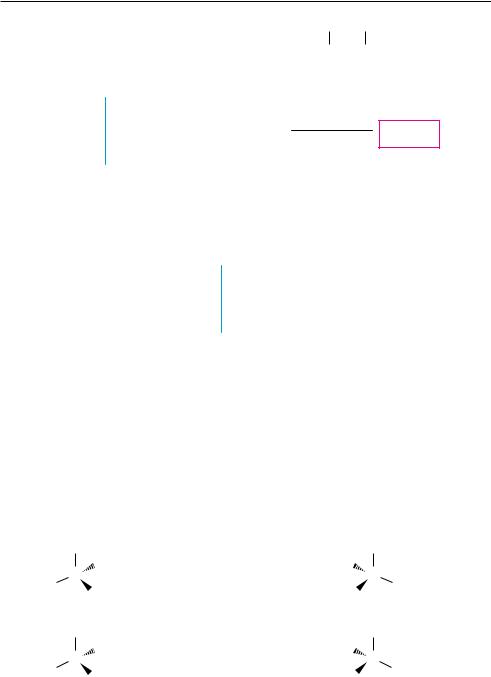
Рис. 5.7. Определение конфигурации по R,S-системе:
а — бромйодхлорметана; б — молочной кислоты
Если два или более атомов, непосредственно связанных с асимметрическим центром, одинаковы, то порядок старшинства заместителей, в состав которых входят эти атомы, определяется аналогичным образом по второму элементному слою, то есть путем подсчета суммы атомных номеров элементов, непосредственно связанных с атомами первого слоя, причем атомные номера элементов, связанных двойной связью, удваиваются, а тройной — утраиваются.
Так, в молекуле молочной кислоты (рис. 5.7, б) по первому элементному слою (8O, 6C, 1H, 6C) видно, что самым старшим заместителем является группа —ОН, а самым младшим —Н. Для выяснения старшинства заместителей —СООН и —СН3, имеющих в первом слое одинаковые атомы (6С), необходимо рассмотреть второй элементный слой. Сумма атомных номеров второго элементного слоя СН3-группы — 1+1+1=3, а группы —СООН — 8 + 8·2 = 24 (см. рис. 5.7, б). Следовательно, группа —СООН старше группы —СН3, а все заместители вокруг хирального центра молочной кислоты располагаются в следующий ряд последовательно убывающего старшинства:
—ОН, —СООН, —СН3, —Н
После установления старшинства заместителей, согласно R,S-системе описания конфигурации стереоизомеров, модель молекулы или ее стереохимическую формулу рассматривают таким образом, чтобы самый младший заместитель (чаще всего это атом водорода) был наиболее удален от наблюдателя (см. рис. 5.7, б). Если при этом три остальных заместителя расположены в пространстве так,
