
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
химическаЯ сВЯзь
51
чем неполярных. Полярные вещества хорошо растворяются в полярных растворителях, а неполярные, как правило,— в неполярных.
Полярность химических связей определяет тип химического взаимодействия (тип реакции) и является количественной характеристикой реакционной способности вещества.
Поляризуемость связи. Под «поляризуемостью» понимают легкость, с которой смещаются электроны связи под влиянием внешних воздействий (электрическое поле, реагирующая частица и др.). Другими словами, поляризуемость — это способность электронного облака связи к поляризации при действии внешнего электрического поля или электрически заряженных частиц. В результате внешних воздействий происходит деформация электронного облака связи, возрастает ее полярность (увеличивается дипольный момент).
Следует отличать понятия «поляризуемость» и «полярность» связи. Если полярность обусловлена различной электроотрицательностью связанных атомов, то поляризуемость определяется степенью подвижности электронов связи. Полярность — это статическое явление, а поляризуемость — динамическое. Поляризуемость не всегда согласуется с полярностью. Так, полярность связи С—Hal в ряду С—F > С—Сl > С—Вг > С—I уменьшается, а ее поляризуемость, напротив, увеличивается.
При сравнении поляризуемости σ- и π-связей необходимо отметить, что π-связи поляризуются гораздо легче, чем σ-связи, поскольку π-электронная плотность находится дальше от атомных ядер. Как и полярность, поляризуемость влияет на реакционную способность веществ, но ее вклад значительно больше.
направленность связей. Ковалентные связи имеют определенную направленность в пространстве. Электронные пары, образующие химические связи, стремятся занять такое пространственное положение относительно друг друга, чтобы силы электростатического отталкивания между ними были минимальными. Углы между направлениями связей в молекуле называют валентными углами. Значение ва-
лентного угла зависит от состояния гибридизации атомных орбиталей и природы атомов, образующих связи. Так, углы между связями С—Н в метане составляют 109° 28′. Однако это справедливо только в тех случаях, когда атом углерода связан
счетырьмя одинаковыми заместителями. В большинстве же случаев наблюдают-
ся небольшие отклонения от угла правильного тетраэдра. Например, в молекуле 2-бромпропана валентный угол С—С—Вr составляет 114,2°. Аналогично незначительное отклонение от валентных углов 120° и 180° наблюдается в соединениях
сатомом углерода в sр2- и sр-гибридизации.

Глава 4
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Идея о взаимном влиянии атомов на реакционную способность органических соединений впервые высказана Александром Михайловичем Бутлеровым в теории химического строения. Дальнейшее развитие она получила в теории электронных смещений (электронных эффектов). Согласно современным пред-
ставлениям, реакционная способность органических соединений определяется характером распределения электронной плотности в молекуле и подвижностью (поляризуемостью) электронов ковалентных связей.
В органических соединениях различают два вида электронных смещений: смещение электронной плотности по цепи σ-связей — индуктивный эффект; смещение по системе π-связей — мезомерный эффект.
4.1. ИНДУКТИВНЫЙ ЭФФЕКТ
Как уже отмечалось, при образовании ковалентной связи между двумя атомами с одинаковой электроотрицательностью электронная пара в равной мере принадлежит связанным атомам (неполярная связь). Если же атомы имеют разную электроотрицательность, электронная плотность ковалентной связи смещается к более электроотрицательному атому (полярная связь). В сложных органических молекулах полярная ковалентная связь оказывает влияние на соседние связи, вызывая их поляризацию:
СН3—СН2—СН2—СН3 |
δ'''+ |
δ''+ |
|
δ'+ |
|
δ+ |
δ– |
||
СН3 |
|
СН2 |
|
СН2 |
|
СН2 |
|
Сl |
|
|
|
|
|
||||||
бутан μ=0 |
|
|
1-хлорбутан μ≠0 |
|
|||||
В молекуле бутана углерод-углеродные связи неполярны, электронная плотность распределена симметрично, и молекула не имеет дипольного момента. Введение в молекулу бутана атома хлора (1-хлорбутан) приводит к поляризации не только связи С—С1, но и соседних углерод-углеродных связей. Атом хлора, имея большую электроотрицательность по сравнению с атомом углерода, оттягивает в свою сторону электроны σ-связи С—С1. В результате такого смещения на атоме хлора появляется частичный отрицательный заряд (δ–), а на углеродном атоме — равный по значению частичный положительный заряд (δ+). Понижение электронной плотности на С1 частично компенсируется оттягиванием в его сторону электронной плотности с соседнего атома углерода, что приводит к поляризации связи С-2—С-1 и возникновению частичного положительного заряда на атоме С-2. Тот, в свою очередь, вызывает поляризацию связи С-3—С-2 и т. д. По мере удаления связи дробный заряд на атомах углерода уменьшается: δ+ > δ'+ > δ''+ > δ'"+. Таким образом, поляризация связи С—Сl вызывает электронную асимметрию молекулы и появление дипольного момента.

Взаимное ВЛиЯние аТомоВ В органических соединениЯх
53
Передачу электронного влияния заместителя вдоль цепи σсвязей называют индуктивным (индукционным) эффектом (позднелат. «inductivus» — от лат. «inductio» — наведение, побуждение).
Индуктивный эффект обозначается символом I, направление смещения электронной плотности σ-связей — прямой стрелкой ( ).
).
Действие индуктивного эффекта наиболее сильно проявляется на двух ближайших σ-связях. Индуктивный эффект из-за слабой поляризуемости σ-связей затухает через 3—4 связи.
В зависимости от направления электронного влияния заместителя различают
положительный (+І) и отрицательный (–І) индуктивный эффект. В качестве стандарта для оценки индуктивного влияния заместителя принят индуктивный эффект атома водорода, который из-за небольшого дипольного момента связи С—Н принято считать равным нулю.
Заместители, притягивающие к себе электроны σсвязи в большей степени, чем
атом водорода, проявляют отрицательный индуктивный эффект (–І ), а замес тители, отталкивающие от себя электроны σсвязи сильнее атома водорода,
проявляют положительный индуктивный эффект (+І ).
Под притяжением и отталкиванием имеют в виду разницу в положении электронов связи, обусловленную различной электроотрицательностью атома водорода и заместителей.
Заместители располагают в ряды в порядке уменьшения –І- или +І- эффектов по отношению к атому водорода:
|
|
|
|
|
δ+ |
δ– |
R—СН2—Н R |
|
δ– |
|
|
δ+ |
|||||
|
|
|
R |
|
СН2 |
|
|
A |
|
СН2 |
|
|
B |
||||
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
–I-эффект |
|
стандарт I = 0 |
+I-эффект |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
– |
|
– |
||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
А : —OR2, —NR3, —NO2,—C—N, —S—OH |
|
|
B : —NR, —O, |
||||||||||||||
—C |
О |
, —F, —Cl, —Br, —I, O |
|
|
—Alk** (—CR3, |
||||||||||||
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
—CHR2, |
||
|
О , |
|
|
|
|
|
О, |
|
|
|
|
|
|||||
—C |
—OR, —C |
|
|
|
|
|
—CH2R, |
||||||||||
|
OR |
|
|
|
|
|
|
R |
|
|
|
|
|
—CH3) |
|||
—SR, —OH, —NH2, —C—CR, —Ar*, |
|
|
|
|
|
||||||||||||
—CH—CR2 |
и др. |
|
|
|
|
|
|
|
и др. |
||||||||
Ar — ароматический радикал. ** Аlk — алкильные группы.
Отрицательный индуктивный эффект заместителя, как правило, тем больше, чем выше электроотрицательность атома, связанного с углеродной цепью. Наибольший отрицательный индуктивный эффект проявляют группы, несущие положительный заряд. При прочих равных условиях sр-гибридизованные атомы обладают большей электроноакцепторной способностью, чем sp2-, а те, в свою очередь, большей, чем sp3-гибридизованные атомы. Этим объясняется отрица-

Глава 4
54
тельный индуктивный эффект остатков непредельных и ароматических углеводородов:
sp3 |
sp2 |
sp3 |
|
sp2 |
sp3 |
sp |
|||||
|
|
|
|
|
|
||||||
СН3 |
|
СН—СН2 |
СН3 |
|
|
|
|
|
СН3 |
|
С—СН |
|
|
|
|
|
|
|
|||||
|
|
–I-эффект |
|
|
–I-эффект |
|
|
–I-эффект |
|||
|
|
пропен |
|
|
|
толуол |
|
|
пропин |
||
Наибольший положительный индуктивный эффект проявляют заместители, несущие отрицательный заряд.
Электронодонорные свойства алкильных групп возрастают при переходе от первичных к третичным радикалам:
|
|
|
|
|
|
|
|
|
|
|
|
СН3 СН— < СН |
|
|
|
СН3 |
СН |
|
|
СН |
|
|
СН |
|
|
СН — |
< |
|
|
|
С— |
||
3 |
2 |
2 |
|
3 |
||||||||||||
|
|
|
2 |
СН3 |
|
СН2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
|||
|
|
|
|
|
|
Электронодонорные свойства алкильных групп |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
В ряду первичных алкильных радикалов положительный индуктивный эффект возрастает с увеличением углеродной цепи:
СН3— < СН3 СН2— < СН3
СН2— < СН3 СН2
СН2 СН2— < СН3
СН2— < СН3 СН2
СН2 СН2
СН2 СН2—
СН2—
Электронодонорные свойства алкильных групп
Таким образом, на основании вышеизложенного можно сделать следующие выводы:
1.Индуктивный эффект проявляется всегда при наличии в молекуле атомов
сразличной электроотрицательностью.
2. Индуктивный эффект распространяется только через σ-связи и всегда
водном направлении.
3.Индуктивный эффект затухает в цепи через 3—4 σ-связи.
4.2. МЕЗОМЕРНЫЙ ЭФФЕКТ (ЭФФЕКТ СОПРЯЖЕНИЯ)
Более эффективно происходит передача электронного влияния заместителя по сопряженной системе.
Сопряженной называют систему, сотоящую из чередующихся простых и кратных связей, или же когда рядом с углеродным атомом, образующим кратную связь, находится атом, р-АО которого заолнена одним электроном, двумя или вакантна.
Сопряженные системы делятся на системы с открытой и замкнутой цепью:
H2C—CH—CH—CH2 |
H2C—CH—C—CH |
H2C—CH—C—N |
|
1,3-бутадиен |
винилацетилен |
акрилонитрил |
|
|
|
H2C—CH—Cl |
H2C—CH—О—СH—CH2 |
|
|
||
|
|
||
бензол |
винилхлорид |
дивиниловый эфир |
|
|
– |
H2C—CH—CH2 |
+ |
H2C—CH—CH2 |
H2C—CH—CH2 |
||
аллил-анион |
аллил-радикал |
аллил-катион |
|
Взаимное ВЛиЯние аТомоВ В органических соединениЯх
55
В сопряженных системах имеет место сопряжение связей — дополнительное перекрывание π- или р-орбиталей заместителя с πорбиталями связей углеродной
цепи или ароматического кольца.
Сопряжение связей обусловливает образование единого делокализованного электронного облака.
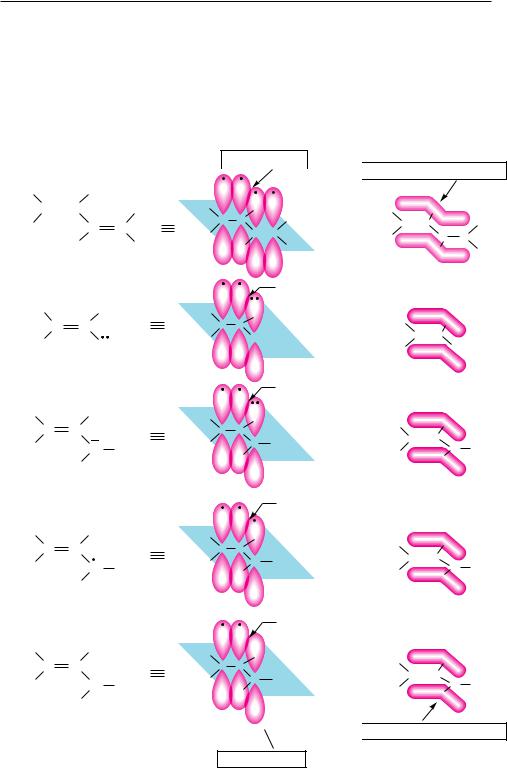
Различают (рис. 4.1) π,π-сопряжение (перекрывание двух π-орбиталей) и р,π-со- пряжение (перекрывание р- с π-орбиталью). Сопряжение возможно лишь в случае параллельности осей симметрии (компланарности) взаимодействующих орбиталей.
HH
C  C H H C C
C H H C C
HH
1,3-бутадиен
HH
CC
HCl
винилхлорид
HH
CC
H C H
H
аллил-анион
HH
CC
H C H
H
аллил-радикал
HH
C |
C |
+ |
H |
H |
H |
C |
|
|
|
|
|
аллил-катион |
|
||
π,π-сопряжение 
 делокализованная π-система
делокализованная π-система
H |
|
H |
|
H |
|
|
|
H |
H |
|
|||||||
C |
C |
|
|
|
|
|
|
C |
|
|
|
|
C |
|
|
H |
|
|
|
|
|
|
|
|
|||||||||||
H |
|
C |
|
C |
|
|
|
H |
|
C |
C |
||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
||||||||||||
H |
|
|
|
H |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
p,π-сопряжение |
|
|
|
|
|
|
|
|
|
|||
H |
|
H |
|
|
|
|
|
H |
|
H |
|
||||||
C |
C |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|||||||||
Cl |
|
|
|
|
|
|
C |
|
|
C |
|
||||||
H |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
H |
|
Cl |
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
p,π-сопряжение |
|
|
|
|
|
|
|
|
|
|
||
H |
|
H |
|
|
|
|
|
H |
|
H |
|
||||||
C |
C |
|
|
|
|
|
|
|
|||||||||
C |
H |
|
|
|
|
C |
|
|
|
C |
|
||||||
H |
|
|
|
|
|
|
H |
||||||||||
|
|
|
|
|
|
||||||||||||
H |
|
|
|
H |
|
H C |
|||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
p,π-сопряжение |
|
|
|
|
|
|
|
|
|
|||
H |
|
H |
|
|
|
|
|
H |
|
H |
|
||||||
C |
C |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
C |
|
|
|
|
C |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
H |
H |
C |
H |
H |
|
H C |
H |
||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
p,π-сопряжение |
|
|
|
|
|
|
|
|
|
|||
H |
|
H |
|
|
|
|
|
H |
|
H |
|
||||||
C |
C |
|
|
|
|
|
|
|
|||||||||
C |
H |
|
|
|
|
C |
|
|
|
|
C |
|
|||||
H |
|
|
|
|
|
|
H |
||||||||||
|
|
|
|
|
|
||||||||||||
H |
|
|
|
H |
|
H C |
|||||||||||
|
|
|
|
|
|
|
|
||||||||||
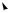
 делокализованная π-система вакантная ð-ÀÎ
делокализованная π-система вакантная ð-ÀÎ
Рис. 4.1. Сопряженные системы 1,3-бутадиена, винилхлорида и аллильного катиона, радикала и катиона

Глава 4
56
Сопряжение является для молекулы энергетически выгодным процессом. Оно сопровождается уменьшением энергии системы и приводит к повышению термодинамической устойчивости молекулы.
Процесс передачи электронного влияния заместителя по сопряженной системе πсвязей называют мезомерным эффектом (М) или эффектом сопряжения (С).
Мезомерный эффект проявляется лишь в том случае, если заместитель включен
всопряженную систему молекулы.
Вмолекуле анилина аминогруппа входит в сопряженную систему и проявляет мезомерный эффект. В молекуле бензиламина аминогруппа изолирована от сопряженной системы ароматического кольца двумя δ-связями и не обладает мезомерным эффектом.
—NH2 |
—CH2—NH2 |
анилин |
бензиламин |
Мезомерный эффект обозначают символом М, а смещение электронной плотности в сопряженной системе — изогнутой стрелкой ( ). Начало стрелки указывает, какие именно электроны смещаются, а конец стрелки — связь или атом, к которым направлено смещение.
). Начало стрелки указывает, какие именно электроны смещаются, а конец стрелки — связь или атом, к которым направлено смещение.
Различают положительный (+М) и отрицательный (–М) мезомерный эффект.
Положительный мезомерный эффект проявляют заместители, подающие элек троны в сопряженную систему.
+М-Эффект проявляют атомы, содержащие неподеленные пары электронов или несущие отрицательный заряд, а также атомные группы, имеющие на первом атоме неподеленные электронные пары или отрицательный заряд.
Отрицательный мезомерный эффект проявляют заместители, смещающие на себя электронную плотность сопряженной системы.
–М-Эффект проявляют заместители, первый атом которых несет положительный заряд, а также атомные группы, в которых первый атом связан с более электроотрицательным атомом кратной связью.
Ниже приведены некоторые заместители, расположенные в порядке уменьшения +М- или –М-эффектов.
C—C—А ; |
—А |
C—C—B ; |
—B |
группа А проявляет –М-эффект |
группа В проявляет +М-эффект |
||
+ |
|
+ |
|
|
О |
|
А : —OR2, |
—NR3, —N , —C—N, |
|||||
|
|
|
О |
|
O |
|
C—O, —C |
, —C О |
, |
||||
|
|
|
OR |
|
OH |
|
—C |
О |
, |
—C |
О |
и др. |
|
|
NH |
|
O– |
|
|
|
|
|
2 |
|
|
|
|
—– —
 СH3 —
СH3 —
В : O, N , NHCH3,
: O, N , NHCH3,
СH3
—NH2, —ОСH3, —OH,
—F, —Cl, —Br и др.
Взаимное ВЛиЯние аТомоВ В органических соединениЯх
57
Максимальный отрицательный мезомерный эффект проявляют заместители, несущие положительный заряд. –М-Эффект ненасыщенных группировок тем больше, чем больше разность электроотрицательностей атомов, связанных кратной связью.
Максимальным положительным мезомерным эффектом обладают атомы, несущие отрицательный заряд. +М-Эффект заместителей, содержащих атомы с неподеленными парами электронов тем больше, чем меньше в пределах периода электроотрицательность атома, несущего неподеленную электронную пару:
—NH2 > —ОН > —F
В пределах группы периодической системы +М-эффект заместителей ослабевает сверху вниз (–F > –С1 > –Вr), что объясняют большей энергетической выгодностью при перекрывании близких по размерам р-орбиталей.
Различают четыре основных типа проявления мезомерного эффекта в органических соединениях.
1. Взаимодействие заместителя, обладающего +М-эффектом, с π-электронной системой молекулы:
H2C—CH—OCH3 |
|
—OH |
+М-эффект |
|
+М-эффект |
винилметиловый эфир |
|
фенол |
2. Взаимодействие заместителя, обладающего –М-эффектом, с π-электронной системой молекулы:
H2C—CH—C—N |
|
—N О |
|
|
O |
–М-эффект |
|
–М-эффект |
акрилонитрил |
нитробензол |
|
3. Взаимодействие двух заместителей с +М-эффектом и –М-эффектом, непосредственно связанных σ-связью:
СH3—С О –М-эффект
О –М-эффект  OH
OH +М-эффект
+М-эффект
уксусная кислота
4. Взаимодействие заместителей, обладающих +М-эффектом и –М-эффек- том, через π-электронную систему молекулы:
H2N —
 —
— С
С О
О
H
+М-эффект –М-эффект 4-аминобензальдегид
Глава 4
58
В отличие от индуктивного эффекта передача электронного влияния заместителя по сопряженной системе происходит на значительно большее расстояние, практически не затухая.
4.3. СОВМЕСТНОЕ ПРОЯВЛЕНИЕ ИНДУКТИВНОГО И МЕЗОМЕРНОГО ЭФФЕКТОВ ЗАМЕСТИТЕЛЕЙ
Ранее отмечалось, что индуктивный эффект проявляется в органических соединениях всегда при наличии в молекуле атомов с разной электроотрицательностью. Мезомерный же эффект проявляется лишь в том случае, когда заместитель вовлечен в сопряженную систему. Поэтому включенные в сопряженную систему заместители вызывают поляризацию связей за счет индуктивного и мезомерного эффектов. Эти эффекты могут совпадать и не совпадать по направлению:
|
|
|
– |
|
|
|
|
||
H2C—C |
|
C—N |
H2C |
|
C—CH2 |
|
|
|
OH |
|
|
||||||||
|
|
|
|
|
|||||
H –I, –M |
+I, +M H |
|
|
–I, +M |
|||||
|
|
||||||||
акрилонитрил |
аллильный карбанион |
фенол |
|||||||
Вбольшинстве случаев индуктивный и мезомерный эффекты заместителей совпадают по направлению. У заместителей, содержащих атомы с неподеленными электронными парами, индуктивный и мезомерный эффекты имеют противоположные направления и как бы «гасят» друг друга.
Поскольку электроны π-связи поляризуются легче по сравнению с элект-
ронами σ-связи, более выраженное влияние на поляризацию молекул оказывает мезомерный эффект, то есть мезомерный эффект заместителя, как правило, больше его индуктивного эффекта. Исключение составляют лишь атомы галогенов (F, С1, Br, I), для которых в статическом (нереагирующем) состоянии молекулы +М-эффект меньше –І-эффекта, но в процессе реакции (динамическое состояние) и для них +М-эффект больше –І-эффекта.
Заместители, повышающие электронную плотность в молекуле, называют элек тронодонорными, а заместители, понижающие ее, — электроноакцепторными.
Врезультате совместного проявления индуктивного и мезомерного эффектов заместителя происходит альтернирование (чередование) поляризации в сопряжен-
ной системе по значению зарядов:
δ+ |
|
|
δ++ |
δ+ |
|
|
δ++ |
|
δ– |
|||
СН2 |
|
|
|
СН |
|
СН |
|
|
|
СН |
|
Сl |
|
|
|
|
|||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
||||||||
4 |
|
3 |
|
2 |
|
1 |
|
|
||||
1-хлор-1,3-бутадиен
Так, в молекуле 1-хлор-1,3-бутадиена в результате –I-эффекта атома хлора, который больше, чем +М-эффект, все атомы углерода приобретают дробный положительный заряд. Но благодаря +М-эффекту хлора на атомах С-2 и С-4 электронная плотность несколько увеличивается. И несмотря на то что в итоге все атомы углерода несут дробный положительный заряд, в положениях С-2
Взаимное ВЛиЯние аТомоВ В органических соединениЯх
59
и С-4 он меньше, чем в С-1 и С-3, то есть происходит чередование поляризации по значению заряда1.
Аналогичное явление наблюдается в системах с замкнутой цепью сопряжения.
δ–  δ––
δ––
δ–– |
NH2 |
δ–  δ––
δ––
анилин
В молекуле анилина –І-эффект аминогруппы вызывает понижение электронной плотности на всех атомах углерода бензольного кольца. Однако, поскольку +М-эффект аминогруппы за счет неподеленной пары электронов атома азота больше –І-эффекта, что приводит в целом к повышению электронной плотности на углеродных атомах кольца и особенно в положениях 2, 4 и 6, то происходит
альтернирующая поляризация.
Обычно в молекулах с открытой цепью сопряжения указывают частичные заряды, сосредоточенные на концевых атомах сопряженной системы, а в замкнутых сопряженных системах — максимальные заряды на атомах:
δ+ |
Оδ– |
|
|
δ– |
δ+ |
|
|
|
δ+ |
Оδ– |
H2C—C—C |
H |
δ– |
|
—OH |
δ+ |
|
|
—С |
||
H |
|
|
δ– |
|
|
|
|
δ+ |
H |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
акролеин |
|
|
фенол |
|
|
бензальдегид |
||||
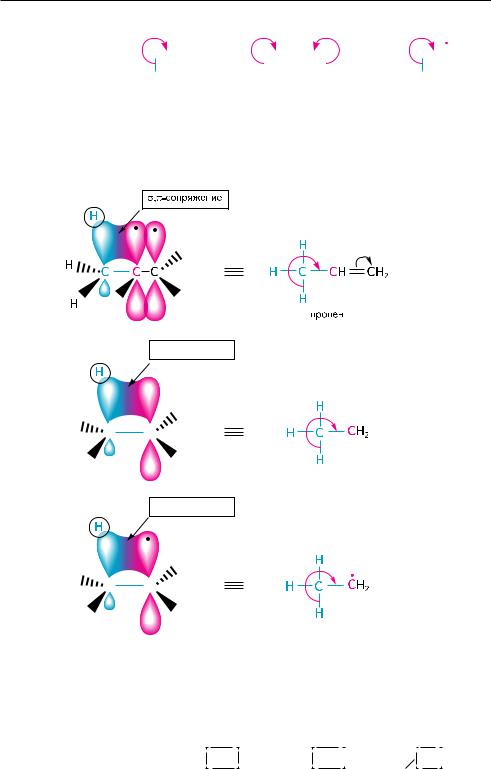
4.4. СВЕРХСОПРЯЖЕНИЕ (ГИПЕРКОНъюГАЦИЯ)
В молекулах некоторых органических соединений имеет место сверхсопряже-
ние (гиперконъюгация).
Сверхсопряжение (гиперконъюгация) — взаимодействие, возникающее в молекуле, карбокатионе или в свободном радикале в результате перекрывания σорбитали с—нсвязей с соседними π или pорбиталями и приводящее к дополнительной стабилизации системы (σ,π или σ,рсопряжения).
Сверхсопряжение характерно для соединений, в молекулах которых sp3-гиб- ридизованный атом углерода, имеющий по крайней мере один атом водорода, расположен рядом с кратной связью, ароматической системой (σ,π-сопряжение) или фрагментом молекулы с вакантной или частично заполненной р-орбиталью
(σ,р-сопряжение).
Эффект сверхсопряжения обозначают символом Mh (индекс h от англ. «hyperconjugation» — гиперконъюгация) и схематично изображают с помощью изогнутой стрелки  .
.
|
H |
H |
H |
||||
|
|
|
|
|
|
|
|
σ, π-Cопряжение |
H—C—CH—CH2 |
H—C—C—N H—C— |
|||||
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
H |
H |
|||||
|
|
пропен |
ацетонитрил |
|
толуол |
||
1 Знак δ++ обозначает, что в этом положении электронная плотность ниже, чем в положении со знаком δ+.
Глава 4
60
|
H |
H |
H |
H |
||||
|
|
+ |
|
|
+ |
|
|
|
σ, p-Сопряжение |
H—C—CH2 |
H—C—CH—C—H |
H—C—CH2 |
|||||
|
H |
|
|
|
|
H |
||
|
|
|
|
|
||||
|
H |
H |
||||||
|
этил-катион |
изопропил-катион |
этил-радикал |
|||||
С позиций квантово-механической теории сверхсопряжение рассматривают как частичное перекрывание σ-орбиталей С—Н-связей с π-орбиталью соседней кратной связи, ароматической системы или р-орбиталью промежуточно активных частиц (карбокатионов, свободных радикалов) (рис. 4.2).
|
|
|
Í |
|
|
Í |
Í |
||
|
|
|
σ,p-сопряжение |
|
Í |
|
|
Í |
|
Ñ |
+ |
+ |
||
|
|
Ñ |
||
|
Í |
|
Í |
|
|
|
|
этил-катион |
|
|
|
|
σ,p-сопряжение |
|
Í |
|
+ |
Í |
|
Ñ |
Ñ |
|||
|
|
|||
|
Í |
|
Í |
|
|
|
|
этил-радикал |
|
Рис. 4.2. Схема перекрывания σ-орбиталей связей С–Н с π-орбиталью кратной связи в молекуле пропена, р-орбиталью в этил-катионе и этил-радикале
Эффективность перекрывания σ-орбитали С—Н-связей с π- или р-орбиталью невысока, так как они не являются параллельными.
Эффект сверхсопряжения зависит от количества атомов водорода при α-угле-
родном атоме и уменьшается в ряду: СH3— > СH3—CH2— > СH3
> СH3
 CH—
CH— . СH3
. СH3
