
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf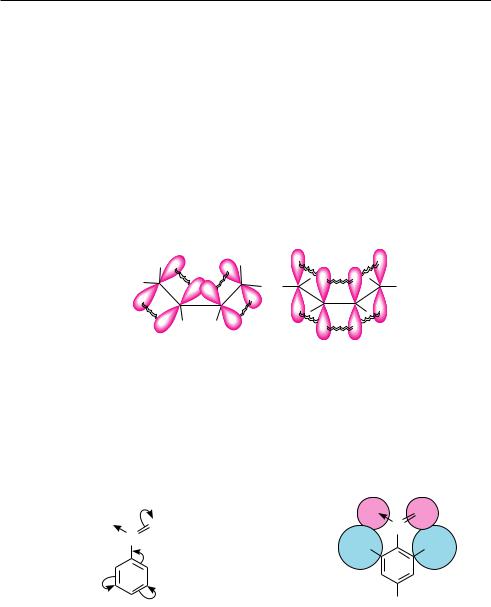
Взаимное ВЛиЯние аТомоВ В органических соединениЯх
61
В результате сверхсопряжения атомы водорода при α-атоме углерода активируются (протонируются) и проявляют повышенную реакционную способность.
4.5. СОПРЯЖЕНИЕ И ПРОСТРАНСТВЕННЫЕ ПРЕПЯТСТВИЯ
Наличие сопряженной системы является обязательным, но не единственным условием для сопряжения. Важную роль в сопряжении играет пространственное расположение взаимодействующих орбиталей. Как уже отмечалось, мезомерный эффект проявляется лишь в том случае, когда все атомы сопряженной системы лежат в одной плоскости или близко к ней, то есть когда наблюдается условие параллельности осей симметрии, участвующих в сопряжении орбиталей (компла-
нарность). Если это условие не выполняется, сопряжение не происходит или эффективность его значительно снижается (рис. 4.3).
à |
á |
Рис. 4.3. Пространственное расположение р-орбиталей сопряженной системы:
а — сопряжение невозможно; б — сопряжение осуществляется
Одной из причин нарушения эффекта сопряжения заместителя являются пространственные (стерические) препятствия. Они возникают при наличии в молекуле у соседних с заместителем объемных атомов или групп атомов. В результате стерических факторов заместитель выходит из плоскости сопряженной системы, что частично или полностью нарушает перекрывание р-орбиталей:
O |
O |
O |
|
|
O |
N |
|
||||
|
N |
Br |
|
|
Br |
|
|
1 |
|
||
|
|
6 |
|
2 |
|
|
|
5 4 |
3 |
||
|
|
|
Br |
||
нитробензол |
2,4,6-трибромнитробензол |
||||
µ = 3,97 D |
µ = 3,17 D |
||||
Так, в молекуле нитробензола нитрогруппа и бензольное кольцо расположены в одной плоскости, что обеспечивает сопряжение. В молекуле же 2,4,6-трибром- нитробензола нитрогруппа в результате пространственных препятствий со стороны заместителей в положениях 2 и 6 выведена из плоскости бензольного кольца. При этом оси р-орбиталей атомов азота нитрогруппы и атомов углерода кольца располагаются под углом по отношению друг к другу, что затрудняет их перекрывание, а следовательно, и сопряжение.
Влияние пространственных препятствий на проявление эффекта сопряжения заместителя можно обнаружить методом дипольных моментов. В приведенном
Глава 4
62
примере молекула нитробензола имеет значительно больший дипольный момент (3,97 D), чем молекула 2,4,6-трибромнитробензола (3,17 D). При сопоставлении дипольных моментов необходимо иметь в виду, что расположенные в центросимметричных положениях бензольного кольца одинаковые заместители не влияют на дипольный момент молекулы.
4.6. СПОСОБЫ ИЗОБРАЖЕНИЯ РАСПРЕДЕЛЕНИЯ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В МОЛЕКУЛАХ. ПОНЯТИЕ О РЕЗОНАНСЕ
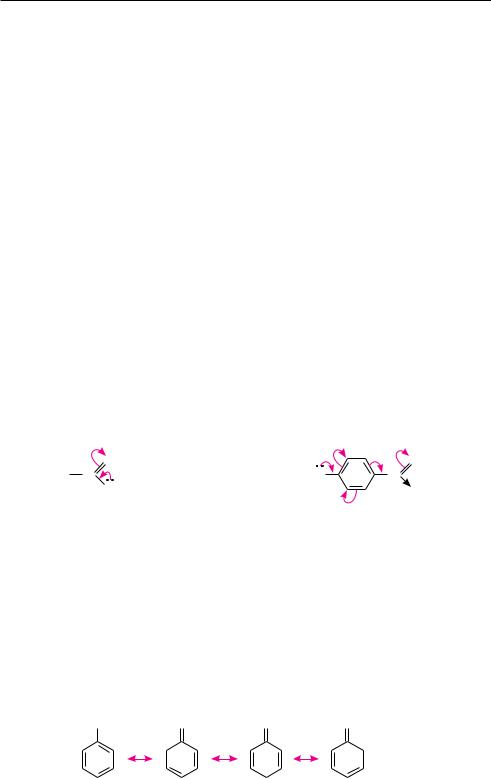
Структурные формулы достаточно однозначно описывают строение органи-
ческих соединений лишь с локализованными химическими связями, то есть когда электроны связи разделены (локализованы) между двумя атомными ядрами. Смещение электронной плотности в локализованных связях молекулы изображают в структурной формуле прямой стрелкой ( ):
):
СН3 СН2
СН2 Сl
Сl
хлорэтан
В молекулах с сопряженными системами связей одна или несколько связывающих орбиталей принадлежат уже не двум атомам, а охватывают несколько атомных ядер. Такую связь называют делокализованной. Используемые в структурных формулах для обозначения химических связей черточки не отражают реальное положение электронов в делокализованных связях.
Для изображения распределения электронной плотности в сопряженной системе молекулы с помощью структурных формул используют два способа. Один из них состоит в том, что соединение изображают одной структурной формулой, в которой изогнутой стрелкой ( ) указывают направление смещения р-или π-электронов:
) указывают направление смещения р-или π-электронов:
|
O |
|
O |
CH3 |
C |
H2N |
N |
|
OC2H5 |
|
O |
|
этилацетат |
|
4-нитроанилин |
Идея второго способа принадлежит американскому ученому Лайнусу Карлу Полингу и носит название «метода резонансных структур». Сущность его заклю-
чается в том, что делокализацию электронов в сопряженной системе изображают с помощью нескольких структурных формул, так называемых резонансных (предельных, граничных) структур, отличающихся друг от друга только распределением электронных пар между ядрами атомов. Истинное электронное строение молекулы не соответствует ни одной из данных структур, а является промежуточным между ними, то есть реальная молекула рассматривается как гибрид резонансных структур.
Взаимосвязь предельных структур изображают двухсторонней стрелкой (
 ). Делокализацию электронов в молекуле фенола можно изобразить в виде следующих граничных структур:
). Делокализацию электронов в молекуле фенола можно изобразить в виде следующих граничных структур:
OH |
+ |
+ |
+ |
OH |
OH |
OH |
|
|
– |
|
– |
–

Взаимное ВЛиЯние аТомоВ В органических соединениЯх
63
Резонансные структуры не существуют реально, это лишь способ описания де-
локализации электронов в молекуле. Вклад каждой структуры в истинное строение молекулы пропорционален ее устойчивости, то есть чем стабильнее граничная структура, тем вклад ее значительнее. Относительная устойчивость резонансных структур определяется несколькими факторами.
Более устойчивой считается структура, в которой: а) содержится большее число ковалентных связей
|
+ |
– |
|
H2С—СН—СН—СН2 |
|
Н2С—СН—СН—СН2 |
|
|
|||
А |
|
|
Б |
то есть структура А стабильнее, чем Б; б) отрицательный заряд «расположен» на более электроотрицательном атоме
(или положительный заряд на атомах с низкой электроотрицательностью)
O |
+ |
O– |
|
|
|
– |
O+ |
|||
H2C—CH—C |
|
|
|
H2C—CH—C |
|
|
|
H2C—CH—C |
||
|
|
|
||||||||
H |
|
H |
|
|
|
|
H |
|||
А |
Б |
|
|
|
|
|
B |
|||
то есть структура А вносит основной вклад; структура Б стабильнее, чем В; |
||||||||||
в) меньше расстояние между разноименными зарядами |
|
|||||||||
|
|
|
|
+ |
– |
+ |
– |
|||
H2N—СН—O |
|
Н2N—СН—O |
|
|
|
Н2N—СН—O |
||||
|
|
|
|
|||||||
А |
Б |
|
|
|
|
|
B |
|||
то есть структура А вносит |
основной |
вклад; |
структура |
Б — значительный, |
||||||
а структура В — незначительный.
Энергия истинной молекулы всегда меньше энергии, рассчитанной для любой из резонансных структур.
Разницу между энергиями реальной молекулы и наиболее устойчивой граничной структуры называют энергией резонанса. Энергия резонанса тем больше, чем больше количество резонансных структур и чем больше число низкоэнергетичных структур с равной или близкой энергией. Энергия резонанса является мерой стабилизации молекулы, обусловленной делокализацией электронов в сопряженных системах.
Несмотря на то что метод резонанса более наглядно описывает делокализацию электронной плотности в сопряженных системах, его применение затруднено необходимостью написания большого числа граничных структур. Это особенно неудобно при составлении уравнений реакций, поэтому в дальнейшем, как правило, делокализация электронов в сопряженных связях будет изображаться с помощью изогнутых стрелок. Метод же резонанса будет использован только для качественной оценки строения и реакционной способности отдельных органических соединений.
Глава 5
ИЗОМЕРИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ МОЛЕКУЛ
Изомерия — явление, заключающееся в существовании соединений, одинаковых по качественному и количественному составу, но различающихся порядком связывания атомов в молекуле или расположением их в пространстве, а вследствие этого имеющих различные физические и химические свойства.
Впервые термин «изомеры» был введен в 1830 году шведским химиком Й. Я. Берцелиусом. Теоретическое же обоснование изомерии принадлежит русскому химику А. М. Бутлерову. С развитием органической химии понятие изомерии расширилось благодаря представлениям о пространственном строении органических соединений (Я. Вант-Гофф, Ж. А. Ле Бель, 1874).
Различают два основных вида изомерии — структурную (изомерия строения)
и пространственную (стереоизомерия).
изомериЯ
|
|
|
сТрукТурнаЯ |
|
|
|
|
ПросТрансТВеннаЯ |
|
|||||||
|
|
(изомерия строения) |
|
|
|
|
|
(стереоизомерия) |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Углеродной |
|
|
ПОЛОЖЕНИЯ |
|
ФУНКЦИО- |
|
|
КОНФИГУРА- |
|
КОНФОРМА- |
||||||
|
|
функциональных |
|
|
НАЛЬНЫХ |
|
|
ЦИОННАЯ |
|
ЦИОННАЯ |
||||||
ЦЕПИ |
|
|
|
|
|
|
|
|||||||||
|
|
групп |
|
|
ГРУПП |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
ГЕОМЕТРИЧЕСКАЯ |
|
|
ОПТИЧЕСКАЯ |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.1. СТРУКТУРНАЯ ИЗОМЕРИЯ
Структурные изомеры, или изомеры строения, отличаются друг от друга после-
довательностью связывания атомов в молекуле, то есть структурой. Структурную изомерию подразделяют на изомерию углеродной цепи, изомерию положения, изомерию функциональных групп.
изомерия углеродной цепи обусловлена разной последовательностью связывания атомов, образующих углеродный скелет молекулы:
СН3—СН2—СН2—СН3 |
СН3— |
|
СН—СН3 |
(С4Н10) |
|
||||
|
|
|
|
|
|
СН3 |
|
||
бутан |
изобутан; |
|
||
|
2-метилпропан |
|
||

изомериЯ органических соединениЙ
65
Для органических соединений циклического строения изомерия цепи может быть вызвана разной величиной цикла или разным способом соединения циклов:
СН3 |
СН3 |
|
(С6Н12) |
||
|
||
|
СН3 |
|
циклогексан метилцикло- |
1,2-диметил- |
|
пентан |
циклобутан |
|
|
(С14Н10) |
Якоб хендрик ВанТ-гоФФ
(1852—1911)
|
|
антрацен |
|
|
фенантрен |
|
Голландский химик. Один из осно- |
|||
|
|
|
|
|
вателей физической химии и стерео- |
|||||
|
изомерия положения обусловлена разным |
химии. Впервые одновременно и неза- |
||||||||
|
висимо от Ж. А. Ле Беля сформулиро- |
|||||||||
положением |
одинаковых функциональных |
вал (1874) теорию пространственного |
||||||||
групп или кратных связей при одном и том |
расположения атомов в органических |
|||||||||
же углеродном скелете молекулы: |
|
соединениях. Выдвинул идею наличия |
||||||||
|
двух стереоизомеров у соединения, |
|||||||||
|
|
|
|
|
|
|
|
|
||
CH3—CH2—CH2—Cl СН3— |
СН—СН3 (С3Н7Cl) |
содержащего атом углерода с четырь- |
||||||||
мя разными заместителями. Исследо- |
||||||||||
|
|
|
|
|
Сl |
|
вал кинетику реакций и |
химическое |
||
|
|
|
|
|
|
сродство. Предложил классификацию |
||||
|
|
1-хлорпропан |
2-хлорпропан |
|
||||||
|
|
|
химических реакций. Установил зави- |
|||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
симость скорости реакции от темпера- |
|
|
Cl |
Cl |
|
Cl |
|
турного режима (правило Вант-Гоф- |
||||
|
|
|
фа). Вывел уравнения изохоры и изо- |
|||||||
|
|
Cl |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
термы. Впервые предложил оценивать |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
(С6Н4Сl2) |
реакционную способность соединений |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
Cl |
|
|
|
с помощью константы скорости реак- |
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
ций. Вывел закон осмотического дав- |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
Cl |
|
ления (закон Вант-Гоффа). |
||
|
1,2-дихлор- |
1,3-дихлор- |
1,4-дихлор- |
|
Один из первых лауреатов Нобе- |
|||||
|
|
левской премии (1901). |
|
|||||||
|
бензол |
бензол |
бензол |
|
|
|||||
|
|
H2C—CH—CH2—CH3 |
CH3—CH—CH—CH3 |
(С4Н8) |
||||||
|
|
|
|
1-бутен |
|
2-бутен |
|
|||
изомерией функциональных групп называют вид структурной изомерии, при котором изомеры отличаются природой функциональной группы.
Наглядным примером такой изомерии является этанол и диметиловый эфир:
СН3—СН2—ОН |
СН3—О—СН3 |
(С2Н6О) |
этанол |
диметиловый эфир |
|

66 |
|
|
|
|
|
Глава 5 |
|
|
|
|
|
|
|
|
Изомерия цепи и положения проявля- |
|||||
|
|
|||||
|
|
ется, как правило, в пределах одного класса |
||||
|
|
органических соединений, а в случае изо- |
||||
|
|
мерии функциональных групп изомеры при- |
||||
|
|
надлежат к разным классам. |
||||
|
|
В некоторых случаях два структурных |
||||
|
|
изомера могут находиться в состоянии дина- |
||||
|
|
мического равновесия друг с другом. Такое |
||||
|
|
явление называют таутомерией, а структур- |
||||
|
|
ные изомеры — таутомерами: |
||||
|
|
таутомеры |
||||
|
Жозеф ашиль Ле БеЛь |
CH3—C—CH3 |
|
|
|
CH3—C—CH2 (С3Н6О) |
|
|
|
|
|||
|
|
|
|
|||
|
О |
|
|
|
ОН |
|
|
(1847—1930) |
|
|
|
|
|
Французский химик. Работал у Ш. А. Вюрца (с 1873). После получения наследства (нефтяные месторождения в Эльзасе) основал (1889) собственную химическую лабораторию.
Научные работы посвящены стереохимии органических соединений. Изучал явление оптической активности. Одновременно с Я. Х. Вант-Гоф- фом и независимо от него сформулировал (1874) теорию пространственного расположения атомов в молекулах органических соединений.
Президент Французского химического общества (1892).
5.2. ПРОСТРАНСТВЕННАЯ ИЗОМЕРИЯ (СТЕРЕОИЗОМЕРИЯ)
Вещества, имеющие одинаковый состав и порядок связывания атомов в молекуле, но отличающиеся друг от друга их расположением в пространстве, называют пространст венными изомерами, или стереоизомерами.
Для характеристики пространственных различий в стереоизомерии используют по-
нятия «конфигурация» и «конформация».
Конфигурациейназываюттоилииноеотно сительное расположение атомов молекулы в пространстве.
Например, в молекуле метана СН4 атом углерода имеет тетраэдрическую конфигурацию. Пространственная модель метана представляет правильный тетраэдр, в центре которого находится углеродный атом, а в вершинах — атомы водорода. Угол между связями метана, равный 109° 28′, называют нормальным или тетра-
эдрическим (рис. 5.1).
109° 28′ |
|
180° |
120° |
|
|
|
|
|
à |
á |
â |
Рис. 5.1. Конфигурация атома углерода:
а — тетраэдрическая; б — плоскостная; в — линейная
Если атом углерода связан с разными заместителями, углы между связями незначительно отклоняются от нормального. Так, в молекуле трихлорметана СНСl3 валентный угол Сl—С—Сl равен 112°. В этилене Н2С—СН2 атом углерода имеет плоскостную конфигурацию (все атомы лежат в одной плоскости, валентный угол 120°), в ацетилене — линейную (атомы расположены линейно, валентный угол 180°).

изомериЯ органических соединениЙ
67
Понятие «конформация» отражает более тонкие особенности пространственного строения молекул.
Конформацией называют различное пространственное расположение атомов или атомных групп в молекулах определенной конфигурации, обусловленное вра щением вокруг σсвязей.
В молекуле этана Н3С—СН3 в результате вращения вокруг углерод-углерод- ной связи меняется пространственное расположение одной метильной группы относительно другой. При этом молекула принимает множество конформаций.
Органические соединения, отличающиеся друг от друга только конфигурацией молекул (без учета возможных конформаций), называют конфигурационными изоме рами. Различают оптические и геометрические конфигурационные изомеры.
Стереоизомеры, имеющие различное пространственное расположение атомов или атомных групп, обусловленное вращением вокруг простой углерод-углеродной связи,
называют конформационными изомерами.
5.2.1. сПосоБы изоБраЖениЯ ПросТрансТВенного сТроениЯ моЛекуЛ
Для изображения пространственного строения органических соединений используют молекулярные модели и стереоформулы.
молекулярные модели. Более наглядное представление о пространственном строении молекулы дают молекулярные модели. Обычно применяют три основ-
ных типа моделей — шаростержневые, скелетные (модели Драйдинга) и полусферические (модели Стюарта—Бриглеба) (рис. 5.2).
Рис 5.2. Модели молекул этана (слева) и этилена (справа):
а— шаростержневые; б — Драйдинга; в — полусферические (Стюарта—Бриглеба)
Вшаростержневых моделях молекул атомы представлены разноцветными шариками, а химические связи — стержнями (рис. 5.2). Шарики связаны друг
сдругом стержнями с учетом взаимного расположения атомов в пространстве. Шаростержневые модели удобны для рассмотрения валентных углов и вращения вокруг простых связей, однако они не отражают относительных размеров атомов и межатомных расстояний в молекуле.

Глава 5
68
Модели Драйдинга, в отличие от шаростержневых, ограничиваются изображением лишь скелета молекулы, то есть химических связей между атомами (см. рис. 5.2), причем межатомные расстояния в этих моделях пропорциональны истинным (в масштабе 0,1 нм = 2,5 см).
Полусферические модели Стюарта—Бриглеба изображают реальные молекулы с учетом пространственного расположения атомов, межатомных расстояний и размеров атомов (см. рис. 5.2). В молекулах Стюарта-Бриглеба атомы представлены разноцветными, частично срезанными шариками, радиус которых пропорционален вандерваальсову радиусу1 атома, а расстояние от центра шарика до поверхности среза — ковалентному радиусу2.
Атом углерода в состоянии sp3-гибридизации изображают в виде шара с четырьмя, в sр2 — с тремя, в sр — с двумя срезами, атом водорода представляют шаром с одним срезом и т. д. При сборке моделей шарики соединяются между собой по плоскостям срезов. Несмотря на то что полусферические модели наиболее удачно отражают реальные молекулы, они не пригодны для рассмотрения валентных углов между атомами и вращения вокруг простых связей.
стереоформулы. Для изображения пространственного строения органических соединений на плоскости (например, на листе бумаги или доске) используют сте-
реохимические и перспективные формулы, а также проекционные формулы Ньюмена.
В стереохимических формулах химические связи, расположенные в плоскости чертежа, изображают обычной чертой; связи, находящиеся над плоскостью — жирным клином или жирной чертой, а расположенные под плоскостью — штриховым клином или пунктирной линией:
H |
H |
H |
H |
H |
H |
H |
C—C H ≡ |
H |
C—C H ≡ |
H |
C—C H |
|
|
|
|||
H |
H |
H |
H |
H |
H |
|
|
|
этан |
|
|
Перспективные формулы отражают пространственное строение на плоскости с учетом рассмотрения молекулы вдоль одной из углерод-углеродных связей. По внешнему виду они напоминают лесопильные козлы:
|
|
H |
|
H |
H |
|
H |
|
H |
С |
СH3 |
С |
|||
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
СH3 |
||
H |
С |
H |
H С H |
||||
|
|
этан |
н-бутан |
||||
1 Вандерваальсов радиус атома равен половине расстояния между двумя не связанными атомами при их максимальном приближении.
2 Ковалентный радиус атома равен половине длины ковалентной связи между одинаковыми атомами.
изомериЯ органических соединениЙ
69
При построении проекционных формул Ньюмена молекулу рассматривают в направлении одной С—С-связи таким образом, чтобы атомы, образующие данную связь, заслоняли друг друга. Из выбранной пары ближний к наблюдателю атом углерода изображают точкой, а дальний — окружностью. Химические связи ближнего атома углерода с другими атомами представляют линиями, берущими начало от точки в центре круга, а дальнего — от окружности:
H СH3
H |
H |
H |
H |
H |
H |
H |
H |
|
H |
|
СH3 |
|
этан |
|
бутан |
Ни один из приведенных способов изображения пространственного строения не является универсальным. Стереохимические формулы чаще применяют для описания стереохимических аспектов протекания реакций, перспективные формулы и проекции Ньюмена — в основном для изображения конформаций молекулы.
Существуют также проекционные формулы Фишера, которые применяют обычно для изображения на плоскости пространственного строения оптических изомеров (см. с. 74).
5.2.2. оПТическаЯ изомериЯ
оптическая активность и хиральность молекул. Для характеристики опти-
ческой изомерии важное значение имеют понятия «оптическая активность»
и «хиральность» молекул.
Оптической активностью называют свойство вещества вращать плоскость поляризации поляризованного света.
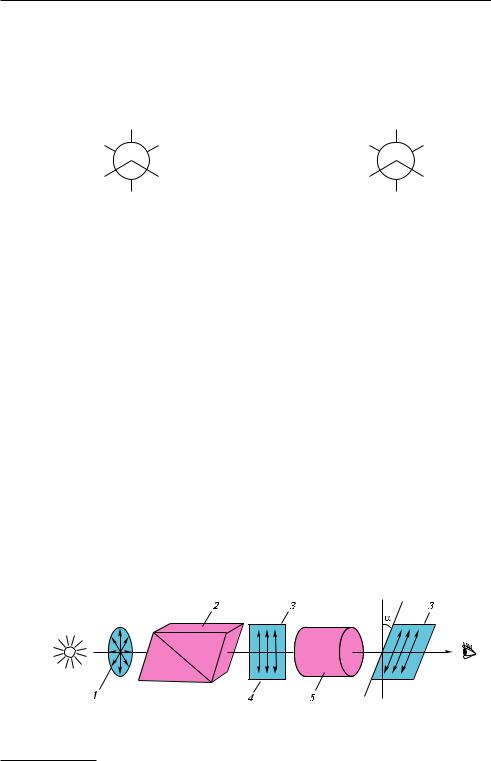
Если луч обычного света, в котором, как известно, электромагнитные колебания происходят в разных плоскостях, перпендикулярных к направлению его распространения, пропустить через призму Николя1, то выходящий свет будет плоскополяризованным. В таком луче электромагнитные колебания совершаются только в одной плоскости. Эту плоскость называют плоскостью поляризации
(рис. 5.3).
Рис. 5.3. Схема образования поляризованного света и вращения плоскости поляризации оптически активным веществом:
1 — обычный свет; 2 — призма Николя; 3 — плоскость поляризации; 4 — поляризованный свет; 5 — оптически активное вещество
1 Призма Николя — призма, изготовленная из двух кристаллов исландского шпата (СаСО3), склеенных канадским бальзамом.

Глава 5
70
При прохождении поляризованного света через оптически активное вещество плоскость поляризации поворачивается на определенный угол α вправо или влево
(см. рис. 5.3). Если вещество отклоняет плоскость поляризации вправо (при наблюде-
нии навстречу лучу), его называют правовращающим, если влево — левовращающим.
Правое вращение обозначают знаком (+), левое — знаком (–).
Угол вращения α зависит от природы оптически активного вещества, толщины слоя оптически активной среды, через которую проходит поляризованный свет,
иего длины волны. Для растворов угол α зависит также от природы растворителя
иконцентрации оптически активного вещества. В меньшей степени оптическое вращение подвержено влиянию температуры.
Для сравнительной оценки оптической активности различных соединений используют значение удельного вращения [α]. Удельное вращение является константой оптически активного вещества. Оно характеризует оптическую активность раствора с концентрацией оптически активного вещества 1 г/мл при толщине слоя 1 дм.
Удельное вращение вычисляют по одной из приведенных формул:
для веществ в растворе |
|
|
; |
|
|
|
|||
для жидких веществ |
|
|
, |
|
где α — измеренный угол вращения, град.; l — толщина слоя, дм;
с — концентрация оптически активного вещества, г/100 мл раствора; ρ — плотность жидкого вещества.
Оптическую активность измеряют с помощью приборов, называемых поляриметрами. Обычно определение проводят при температуре 20 °С и длине волны D-линии спектра натрия (589,3 нм). Соответствующее значение удельного враще-
ния обозначают 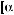
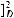
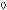 . Обязательным условием для проявления органическим соединением оптической активности является асимметрия (отсутствие симметрии)
. Обязательным условием для проявления органическим соединением оптической активности является асимметрия (отсутствие симметрии)
его молекул. Поскольку молекула представляет собой трехмерное образование, ее строение можно рассматривать с точки зрения симметрии геометрических фигур.
Основными элементами симметрии являются плоскость, центр и ось симметрии.
Плоскостью симметрии называют воображаемую плоскость, которая проходит через молекулу, разделяя ее на две зеркально равные части (рис. 5.4, а).
Центром симметрии называют воображаемую внутри молекулы точку, равноудаленную от одинаковых атомов, расположенных на прямой, проходящей через эту точку (рис. 5.4, б).
Осью симметрии называют проходящую через молекулу воображаемую ось, при повороте вокруг которой на угол 360°/n (п — целое число, равное 2, 3, 4 и т. д.) молекула совмещается со своим исходным положением.
Число п определяет порядок оси симметрии. Если n = 2, 3 и так далее, ось симметрии называют соответственно осью второго, третьего и так далее порядка. Например, молекула хлороформа (рис. 5.4, в) совмещается со своим исходным положением при каждом повороте вокруг связи С—Н на угол 360°/3 = 120°. Следовательно, проходящая через молекулу вдоль связи С—Н ось называется осью симметрии третьего порядка.
