
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
аЛиФаТические угЛеВодороды. аЛканы
Представители гомологического ряда алканов
Структурная формула |
Брутто-формула |
Число атомов углерода |
СН4 |
СН4 |
1 |
СН3СН3 |
С2Н6 |
2 |
СН3СН2СН3 |
С3Н8 |
3 |
СН3(СН2)2СН3 |
С4Н10 |
4 |
СН3(СН2)3СН3 |
С5Н12 |
5 |
СН3(СН2)4СН3 |
С6Н14 |
6 |
СН3(СН2)5СН3 |
С7Н16 |
7 |
СН3(СН2)6СН3 |
С8Н18 |
8 |
СН3(СН2)7СН3 |
С9Н20 |
9 |
СН3(СН2)8СН3 |
С10Н22 |
10 |
СН3(СН2)9СН3 |
С11Н24 |
11 |
СН3(СН2)10СН3 |
С12Н26 |
12 |
СН3(СН2)11СН3 |
С13Н28 |
13 |
СН3(СН2)12СН3 |
С14Н30 |
14 |
СН3(СН2)13СН3 |
С15Н32 |
15 |
СН3(СН2)18СН3 |
С20Н42 |
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
109°28′ |
H |
H |
C |
||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
H |
C |
|
C |
H |
|
|
|
|
|
|
|
|
|
|
|
0,154 íì |
0,110 íì |
|
|
|||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
H |
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|||||
131
Таблица 9.1
Название
Метан
Этан
Пропан
Бутан
Пентан
Гексан
Гептан
Октан
Нонан
Декан
Ундекан
Додекан
Тридекан
Тетрадекан
Пентадекан
Эйкозан
H
C |
H |
|
|
|
H |
Рис. 9.1. Строение молекулы этана:
а — шаростержневая модель; б — геометрия молекулы; в — σ-связи
Вокруг углерод-углеродных связей происходит свободное вращение, в результате которого молекула может принимать разные пространственные формы — конформации (рис. 9.2).
Рис. 9.2. Конформации алканов:
а — зигзагообразная; б — нерегулярная; в — клешневидная

Глава 9
132
На основании данных рентгеноструктурного анализа установлено, что алканы нормального (неразветвленного) строения в кристаллическом состоянии имеют зигзагообразную конформацию. Такое строение для молекулы наиболее выгодно, поскольку в данном случае все атомы углерода по отношению друг к другу находятся в заторможенной антибутановой конформации. При разветвленном строении углеродной цепи конформация может изменяться.
9.2. НОМЕНКЛАТУРА
Первые четыре представителя гомологического ряда алканов имеют тривиальные названия — метан, этан, пропан, бутан. Название последующих углеводородов с нормальной углеродной цепью образуется от названия греческого числительного, указывающего количество атомов углерода в молекуле, с добавлением суффикса ан: пентан, гексан и др. (см. табл. 9.1).
В названиях алканов с разветвленной цепью, в которых две метильные группы находятся на одном конце углеродной цепи, не имеющей других ответвлений, используется приставка изо, если же на конце углеродной цепи имеются три метильные группы, в название алкана вводится приставка нео:
СН3 |
СН3 |
СН3—СН2—СН2—СН |
СН3—СН2—С—СН3 |
СН3 |
СН3 |
|
|
изогексан |
неогексан |
Названия алканов с разветвленной углеродной цепью составляют согласно
заместительной номенклатуре IUPAC :
1. За основу принимают название углеводорода, которому в рассматриваемом алкане отвечает наиболее длинная неразветвленная углеродная цепь (главная углеродная цепь). Если в углеводороде имеется несколько цепей одинаковой длины, за главную из них принимается та, которая имеет наибольшее число разветвлений:
|
СН3 |
главная цепь |
|
|
СН3 |
цепь не является главной |
|
|
|
|
|
||
|
|
|
|
|
||
СН3—СН—СН—СН2—СН3 |
СН3—СН—СН—СН2—СН3 |
|||||
СН3—СН—СН3 |
СН3—СН—СН3 |
|||||
2. Нумеруют атомы углерода главной цепи с того конца, к которому ближе находится заместитель. Если в молекуле алкана заместители расположены на равном расстоянии от обоих концов, то нумерацию проводят с того конца, к которому ближе расположен заместитель с названием, стоящим в алфавитном порядке раньше:
5 |
4 |
3 |
2 |
1 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
|||
СН3—СН2—СН2— |
|
СН—СН3 |
СН3—СН2— |
СН—СН2—СН—СН2—СН3 |
||||||||||
|
||||||||||||||
|
|
|
|
|
|
|
|
|
СН2—СН3 СН3 |
|
|
|||
|
|
|
СН3 |
|
|
|
|
|
||||||
|
|
2-метилпентан |
|
|
|
3-метил-5-этилгептан |
|
|
||||||

аЛиФаТические угЛеВодороды. аЛканы
133
Если же на одинаковом расстоянии от обоих концов главной цепи расположены идентичные заместители, но с одной стороны количество разветвлений больше, чем с другой, нумерацию начинают с того конца, где большее число заместителей:
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
3 |
4 |
5 |
6 |
6 |
5 |
4 |
3 |
2 |
1 |
||
СН3—С—СН2—СН2— |
СН—СН3 |
СН3— |
СН—СН2—СН—СН—СН3 |
|||||||||||
|
СН3 |
|
|
СН3 |
|
|
СН3 |
СН3 |
СН3 |
|
||||
|
|
2,2,5-триметилгексан |
|
|
|
|
2,3,5-триметилгексан |
|
||||||
3. Составляют название соединения в целом, соблюдая определенные правила:
А. Сначала перечисляют в алфавитном порядке названия заместителей, указывая цифровой локант, соответствующий положению каждого заместителя в главной углеродной цепи. Если углеводород содержит несколько одинаковых заместителей, число их обозначают множительными приставками ди-, три-, тетра- и так далее, а положение в главной цепи, как обычно, цифрами.
Б. Затем называют углеводород, которому отвечает в рассматриваемом соединении главная углеродная цепь.
Заместителями при главной углеродной цепи в алканах являются одновалентные остатки алканов, так называемые алкильные группы, или алкильные радикалы, которые обозначают Аlk или R. Названия алкильных групп образуют из названий соответствующих алканов, заменяя суффикс -ан на -ил.
Наиболее часто встречающиеся алкильные радикалы:
СН — |
СН |
—СН |
— |
СН |
—СН |
—СН — СН3 СН— |
|||
3 |
|
3 |
2 |
|
3 |
2 |
2 |
СН3 |
|
|
|
|
|
|
|
|
|
|
|
метил |
|
|
этил |
|
|
пропил |
изопропил |
||
СН3—СН2—СН2—СН2— СН3 |
СН—СН2— СН3—СН2— |
СН— |
СН3 |
||||||
СН3—С— |
|||||||||
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3 |
СН3 |
||
|
|
|
|
|
|
|
|||
бутил |
|
изобутил |
|
|
втор-бутил |
трет-бутил |
|||
В приведенных названиях приставки втор- (вторичный) и трет-(третичный) характеризуют атом углерода со свободной валентностью.
Для названия сложных разветвленных радикалов используют нумерацию углеродной цепи радикала, причем начинают нумерацию всегда с атома углерода, имеющего свободную валентность:
5 4 3 2 1
СН3—СН—СН—СН2—СН2—
СН3 СН3
3,4-диметилпентил

Глава 9
134
Названия остатков молекул алканов, имеющих две свободные валентности, образуют от названий соответствующих алканов путем замены суффикса -ан на -илен (если свободные валентности находятся при разных атомах углерода) или -илиден (если свободные валентности находятся у одного и того же атома углерода):
—СН2— |
|
—СН2—СН2— |
СН3—СН— |
СН3—СН2—СН— |
||||||
метилен |
|
этилен |
этилиден |
|
пропилиден |
|
||||
СН |
|
|
— |
СН—СН2— |
—СН |
—СН |
—СН |
— |
||
|
|
|
||||||||
—С—СН |
|
|||||||||
3 |
|
|
3 |
|
|
|
2 |
2 |
2 |
|
|
|
|
|
|
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
изопропилиден |
|
|
пропилен |
|
|
триметилен |
|
|||
Учитывая рассмотренные правила, нижеприведенные углеводороды следует называть по заместительной номенклатуре IUPAC следующим образом:
|
|
|
|
|
|
СН |
|
СН |
|
|
|
|
|
|
|
|
|
СН3 |
|
|
3 |
СН |
|
3 |
СН3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
4 |
3 |
2 |
|
1 |
1 |
2 |
3 |
|
4 |
5 |
6 |
7 |
8 |
|
СН3—СН2—С—СН3 |
СН3—СH—СН—СН2—С—СН2—СН2—СН3 |
|||||||||||||
|
|
СН3 |
|
|
СН3 |
|
|
|
|
СН2—СН3 |
|
|
||
|
2,2-диметилбутан |
|
|
3-изопропил-2,5-диметил-5-этилоктан |
|
|||||||||
9.3. ИЗОМЕРИЯ
Для алканов характерна структурная и оптическая изомерия. Структурная изомерия алканов обусловлена разной последовательностью связывания атомов углерода в молекуле (изомерия цепи). Она характерна для бутана и последующих гомологов ряда алканов:
|
|
|
СН3 |
С4Н10 |
СН3—СН2—СН2—СН3 |
СН3—СН |
|
|
|
|
СН3 |
|
бутан |
|
изобутан |
|
|
СН3 |
СН3 |
|
|
СН3—С—СН3 |
|
С5Н12 СН3—СН2—СН2—СН2—СН3 |
СН3—СН2—СН |
||
|
|
СН3 |
СН3 |
|
|
|
|
|
пентан |
изопентан; |
неопентан; |
|
|
2-метилбутан |
2,2-диметилпропан |
С увеличением количества атомов углерода в молекуле алкана количество структурных изомеров быстро возрастает. Так, гексан С6Н12 имеет 5 изомеров,
гептан С7Н16 — 9, октан С8Н18 — 18, декан С10Н22 — 75, эйкозан С20Н42 — 366 319. Для алканов, начиная с углеводорода состава С7Н16, возможна оптическая
*
изомерия. Так, 3-метилгексан СН3СН2СН(СН3)СН2СН2СН3 имеет асимметрический атом углерода и существует в виде двух энантиомеров (зеркальных изомеров):
аЛиФаТические угЛеВодороды. аЛканы |
|
|
135 |
|||
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|||
СН3—СН2 |
C H |
H |
C |
СН2—СН3 |
||
|
СН2—СН2—СН3 |
СН3—СН2—СН2 |
|
|||
|
|
|
|
|
||
R-3-метилгексан |
S-3-метилгексан |
|||||
9.4. СПОСОБЫ ПОЛУЧЕНИЯ
9.4.1. Природные исТочники
Главными природными источниками алканов являются нефть и природный газ. Нефть представляет собой сложную смесь органических соединений, основными компонентами которой являются неразветвленные и разветвленные алканы. Природный газ состоит из газообразных алканов, главным образом метана (до 95 %), этана, пропана и бутана.
Для получения смеси алканов и других углеводородов нефть подвергают фракционной перегонке. В результате перегонки выделяют несколько фракций (петролейный эфир, бензин, керосин, дизельное топливо, мазут), каждая из которых представляет собой смесь углеводородов, кипящих в определенном интервале температур (табл. 9.2).
|
|
|
|
Таблица 9.2 |
|
Фракции, получаемые при перегонке нефти |
|
||
|
|
|
|
|
Фракция |
|
Температура кипения, °С |
|
Смесь алканов |
|
|
|
|
|
Петролейный эфир |
|
20—60 |
|
С5, С6 |
Бензин |
|
60—180 |
|
С6—С10 |
Керосин |
|
180—230 |
|
С11, С12 |
Дизельное топливо |
|
230—300 |
|
С13—С17 |
Мазут |
|
выше 300 |
|
С18 и выше |
|
|
|
|
|
Из мазута перегонкой под вакуумом или с водяным паром получают соляровое масло (углеводороды состава С18—С25), смазочные масла (углеводороды состава С28—С38), вазелин и парафин. При дальнейшей перегонке фракций нефти можно получить индивидуальные алканы.
Природный газ разделяют на составляющие компоненты путем сжижения с последующей фракционной перегонкой.
Природные источники метана
Благодаря бактериям «метаногенам», которые разлагают растительные и животные остатки без доступа кислорода, ежегодно на нашей планете выделяется приблизительно 2 млрд тонн метана. Так, болотный газ на 99 % состоит из метана, природный газ содержит около 95 %, попутные газы — 75—85 % метана.
Огромные количества метана содержатся в атмосфере тяжелых планет (Нептуна, Урана, Юпитера, Сатурна). Возможно, в будущем будут осуществлены фантастические проекты транспортировки метана на Землю.

Глава 9
136
9.4.2. синТеТические меТоды ПоЛучениЯ
каталитическое гидрирование углерода (II) оксида (синтез Фишера—Тропша).
При пропускании смеси углерода (II) оксида и водорода над железным или кобальтовым катализатором при температуре 180—300 °С образуется смесь углеводородов, состоящая главным образом из алканов нормального строения, содержащих 6—10 атомов углерода:
CO + 2H2 |
кат. |
н-алканы + H2O |
|
Синтез Фишера—Тропша применяют в промышленности для получения синтетического бензина и отдельных углеводородов.
каталитическое гидрирование алкенов и алкинов. Реакция протекает в нормаль-
ных условиях в присутствии катализаторов Pt, Pd или Ni:
CH3—C—C—CH3 |
H2, Ni |
CH3—CH—CH—CH3 |
H2, Ni |
CH3—CH2—CH2—CH3 |
|
|
|||
2-бутин |
|
2-бутен |
|
бутан |
Взаимодействие галогеналканов с металлическим натрием. Метод известен как
реакция Вюрца (1855), заключается в обработке галогеналканов (обычно йодидов и бромидов) избытком натрия:
|
2CH3—I + 2Na |
|
CH3—CH3 + 2NaI |
|
|
||
йодметан |
этан |
|
|
Реакция протекает через стадию образования металлорганических соединений:
CH3—I + 2Na  CH3Na + NaI
CH3Na + NaI
метилнатрий
CH3Na + CH3—I  CH3—CH3 + NaI
CH3—CH3 + NaI
Если в качестве исходных веществ используют два разных галогеналкана, то в результате реакции образуется смесь трех углеводородов:
CH —I + CH —CH —I |
|
Na |
|
|
|
|||
–NaI |
|
|
||||||
3 |
3 2 |
|
|
|
||||
|
|
|
|
CH3—CH3 + CH3—CH2—CH3 + CH3—CH2—CH2—CH3 |
||||
|
|
|
|
|||||
|
|
|
|
|
|
этан |
пропан |
бутан |
Вместо натрия в данной реакции могут быть использованы и другие металлы (Zn, Мg, Li). Наиболее легко реакция Вюрца протекает с первичными йодалканами, труднее с бром- и хлоралканами. Вторичные и третичные галогенопроизводные углеводородов в условиях реакции Вюрца практически не образуют алканов. В этом случае образуются преимущественно алкены. Реакция редко используется в синтетических целях из-за наличия побочных процессов (элиминирования, перегруппировки).
сплавление солей карбоновых кислот со щелочами. В качестве исходных ве-
ществ обычно используют соли карбоновых кислот со щелочными или щелочноземельными металлами и натрия или бария гидроксиды с добавлением натронной извести. При сплавлении образуется алкан, имеющий на один атом углерода меньше, чем в исходной кислоте:
CH3—CH2—COONa + NaOH |
t |
CH3—CH3 |
+ Na2CO3 |
|
|||
натрия пропионат |
|
|
|

аЛиФаТические угЛеВодороды. аЛканы
137
Взаимодействие металлорганических со-
единений с водой. При действии воды на металлорганические соединения лития, натрия, магния или цинка разрывается связь металл-углерод с образованием углеводородов:
CH3—CH2MgI + HOH
этилмагниййодид
 CH3—CH3 + Mg(OH)I
CH3—CH3 + Mg(OH)I
этан
Действием воды на алюминия карбид получают метан:
Al4C3 + 12H2O  3CH4↑ + 4Al(OH)3
3CH4↑ + 4Al(OH)3
Электролиз водных растворов солей кар-
боновых кислот. Чаще используют натриевые и калиевые соли карбоновых кислот:
2CH3COO–Na+ + 2H2O электролиз
натрия ацетат
 CH3—CH3 + 2CO2 + 2NaOH + H2
CH3—CH3 + 2CO2 + 2NaOH + H2
этан
На аноде ацетат-ион CH3COO– отдает один электрон, превращаясь в неустойчивый свободный радикал, который распадается на углерода (IV) оксид и свободный метильный радикал. Метильные радикалы димеризуются с образованием этана:
2CH3COO– –2е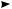 2CH3COO• –2СO2
2CH3COO• –2СO2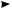
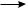 2CH3•
2CH3• 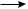 CH3—CH3
CH3—CH3
На катоде образуется водород и гидроксид соответствующего щелочного металла.
Шарль адольф ВюрЦ
(1817—1884)
Французский химик. Окончил медицинский факультет Страсбургского университета (1839). Изучал химию в лаборатории Ю. Либиха в Гисенском университете (1842). Профессор Парижского университета с 1875 года.
Научные работы проводил в области органической и неорганической химии. Получил циануровую кислоту, изоциановые эфиры. Открыл (1849) алкиламины, синтезировал метиламин и этиламин. Разработал (1855) метод синтеза парафиновых углеводородов при взаимодействии алкилгалогенидов с металлическим натрием (реакция Вюрца). Синтезировал этиленгликоль (1856), молочную кислоту (1865), этиленхлоргидрин, этиленоксид (1859), фенол, этаноламины, холин (1867), нейрин (1869). Одновременно с А. П. Бородиным осуществил альдольную конденсацию (1872). Провел (1872) кротоновую конденсацию уксусного альдегида.
Был прекрасным лектором. В его честь назван минерал вюрцит.
9.5. ФИЗИЧЕСКИЕ СВОЙСТВА
Вобычных условиях четыре первых представителя гомологического ряда алканов — газообразные вещества; нормальные алканы, содержащие от 5 до 17 атомов углерода — жидкости, последующие гомологи — твердые вещества (табл. 9.3).
Вгомологическом ряду алканов по мере увеличения молекулярной массы возрастают температуры плавления и кипения. Температуры кипения изомеров с разветвленной углеродной цепью более низкие по сравнению с алканами нормального строения. Газообразные и твердые алканы не имеют запаха,

138 |
|
|
|
Глава 9 |
|
|
|
|
|
||
|
|
|
Таблица 9.3 |
||
|
|
|
|
||
|
|
Физические характеристики алканов |
|
||
|
|
|
|
|
|
|
Соединение |
Название |
Температура, °С |
||
|
|
|
|||
плавления |
кипения |
||||
|
|
|
|||
|
|
|
|
|
|
СН4 |
Метан |
–182,6 |
–161,6 |
||
СН3СН3 |
Этан |
–183,3 |
–88,5 |
||
СН3СН2СН3 |
Пропан |
–187,1 |
–42,2 |
||
СН3(СН2)2СН3 |
Бутан |
–138,4 |
–0,5 |
||
СН3СН(CH3)СН3 |
2-Метилпропан |
–159,6 |
–11,7 |
||
СН3(СН2)3СН3 |
Пентан |
–129,7 |
36,1 |
||
СН3CH(СН3)СН2СН3 |
2-Метилбутан |
–159,9 |
27,8 |
||
СН3C(СН3)3 |
2,2-Диметилпропан |
–16,6 |
9,5 |
||
СН3(СН2)4СН3 |
Гексан |
–94,0 |
68,7 |
||
СН3(СН2)5СН3 |
Гептан |
–90,5 |
98,4 |
||
СН3(СН2)8СН3 |
Декан |
–29,7 |
174,1 |
||
СН3(СН2)13СН3 |
Пентадекан |
10 |
270,7 |
||
СН3(СН2)18СН3 |
Эйкозан |
36,4 |
345,1 |
||
|
|
|
|
|
|
жидкие — обладают характерным «бензиновым» запахом. Все алканы легче воды и практически не растворяются в ней. Наряду с этим, они хорошо растворимы в неполярных растворителях — диэтиловом эфире, четыреххлористом углероде, бензоле и других, причем с увеличением молекулярной массы растворимость уменьшается.
9.6. ХИМИЧЕСКИЕ СВОЙСТВА
В обычных условиях алканы являются малореакционноспособными соединениями. Они устойчивы к действию кислот, щелочей и окислителей. Инертность алканов используют на практике. Концентрированную серную кислоту
ищелочи применяют для очистки нефтепродуктов. Щелочные металлы, для предотвращения контакта с кислородом и влагой воздуха, хранят под слоем инертно-
го растворителя (керосин). Химическая инертность алканов обусловлена высокой прочностью σ-связей С—С и С—Н (см. разд. 3.2.3). В результате незначительного отличия электроотрицательностей sp3-гибридизованного атома углерода (2,5)
иатома водорода (2,1) σ-связи С—С и С—Н в алканах практически не полярны
ипоэтому не склонны к гетеролитическому разрыву, но способны расщепляться
гомолитически с образованием свободных радикалов. Несмотря на то что связь С—С менее прочная, чем связь С—Н, последняя разрывается с большей легкостью,
так как более доступна для атаки реагентом. Химические превращения алканов сопровождаются гомолитическим расщеплением связей С—Н с последующим замещением атома водорода другими атомами или группами, то есть для них харак-
терны реакции замещения, происходящие по радикальному механизму (SR). При высоких температурах может наблюдаться гомолитический разрыв связей С—С.

аЛиФаТические угЛеВодороды. аЛканы
139
9.6.1. реакЦии радикаЛьного замещениЯ (SR )
галогенирование. Алканы легко реагируют с галогенами (кроме йода), образуя смеси моно- и полигалогеналканов. Галогены по реакционной способности с алканами располагаются в ряд: F2 > Сl2 > Вr2. Прямое фторирование алканов является трудно контролируемой экзотермической реакцией. Выделяющаяся энергия при замещении атома водорода на атом фтора превышает энергию диссоциации связи С—С. При фторировании алканов наряду с замещением атомов водорода атомами фтора происходит разрыв углерод-углеродных связей, и образуется сложная смесь фторалканов. Именно поэтому прямое фторирование алканов имеет ограниченное применение.
Менее экзотермична реакция алканов с хлором. Она протекает в условиях фотохимического (под действием УФ-облучения) или термического (300 °С) процесса. При взаимодействии метана с хлором атомы водорода постепенно замещаются на атомы хлора:
CH4 + Cl2 |
hν |
HCl + CH3Cl |
||
|
||||
|
|
|
|
хлорметан |
CH3Cl + Cl2 |
|
|
hν |
HCl + CH2Cl2 |
|
|
|
||
|
|
|
|
дихлорметан |
CH2Cl2 + Cl2 |
|
hν |
HCl + CHCl3 |
|
|
|
|||
|
|
|
|
трихлорметан; |
|
|
|
|
хлороформ |
CHCl3 + Cl2 |
|
|
hν |
HCl + CCl4 |
|
|
|||
|
|
|
|
тетрахлорметан; |
|
|
|
|
четыреххлористый углерод |
Реакция протекает по цепному свободнорадикальному механизму, который был изучен советским ученым Николаем Николаевичем Семеновым.
В цепном процессе выделяют три стадии: инициирование, рост цепи, обрыв цепи. Инициирование. Под действием энергии квантов света (hν) или нагревания молекула хлора активируется и претерпевает гомолитический разрыв связи с об-
разованием двух свободных радикалов:
Cl· ·Cl hν
·Cl hν 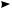 2Cl·
2Cl·
Рост цепи. Свободные радикалы хлора атакуют связь С—Н в молекуле метана, отрывая при этом атом водорода с образованием хлороводорода HCl и свободного метильного радикала СН3·:
Н |
|
Н |
Н C H + Cl· |
|
Н C· + H··Cl |
|
||
Н |
|
Н |
Метильный радикал, в свою очередь, атакует молекулу хлора, отрывает атом галогена и образует хлорметан СН3Сl и свободный радикал хлора:
СН3· + Cl· ·Cl 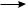 CH3··Cl + Cl·
CH3··Cl + Cl·
Образовавшийся радикал хлора повторяет цикл указанных превращений, то есть происходит цепной процесс, в котором атом хлора, прореагировавший

Глава 9
140
на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии.
В результате образуется смесь моно-, ди-, три- и тетрахлорпроизводных метана:
Cl· + CH |
|
Cl |
|
|
·CH |
Cl + HCl |
|||
|
|
||||||||
3 |
|
|
2 |
|
|
|
|||
·CH2Cl + Cl2 |
|
|
CH2Cl2 |
+ Cl· |
|||||
|
|
||||||||
дихлорметан |
|
|
|
|
|
|
|
||
Cl· + CH |
Cl |
2 |
|
|
·CHCl |
2 |
+ HCl |
||
|
|
||||||||
2 |
|
|
|
|
|
|
|
||
·CHCl2 + Cl2 |
|
|
CHCl3 + Cl· |
||||||
|
|
||||||||
трихлорметан |
|
|
|
|
|
|
|
||
николай николаевич семеноВ
(1896—1986)
Советский физик и физикохимик. Окончил Петроградский университет (1917). Открыл (1927) новый тип химических процессов — разветвленные цепные реакции, теорию которых впервые сформулировал в 1930— 1934 годах. Установил механизм цепных реакций. Осуществил (1950—1960) цикл работ в области гомогенного и гетерогенного катализа.
Лауреат Государственной премии
СССР (1941, 1949), Нобелевской премии (1956, совместно с С. Н. Хиншелвудом), Ленинской премии (1976).
CHCl |
3 |
+ Cl· |
|
·CCl |
3 |
+ HCl |
|||
|
|||||||||
|
|
|
|
|
|
|
|
||
·CCl |
+ Cl |
2 |
|
|
CCl |
4 |
+ Cl· |
||
|
|
||||||||
|
3 |
|
|
|
|
|
|||
тетрахлорметан
Цепной процесс прекращается только после исчезновения всех свободных радикалов, образующихся в ходе реакции.
Обрыв цепи. В результате рекомбинации (димеризации) свободных радикалов происходит обрыв цепи:
СН3· + СН3· 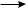 СН3—СН3
СН3—СН3
СН3· + Сl· 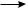 CH3——Cl Сl· + Сl·
CH3——Cl Сl· + Сl· 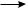 Cl2
Cl2
Аналогично протекает реакция бромирования метана, однако она значительно менее экзотермична, чем реакции фторирования и хлорирования.
Следует отметить, что замещение атома водорода на атом галогена в алканах происходит в большинстве случаев региоселективно (избирательно): в первую очередь, как правило, замещается атом водорода при третичном атоме углерода, затем — при вторичном и в последнюю очередь — при первичном. При бромировании 2-метилпропана образуется продукт замещения при участии третичного атома углерода:
CH3 |
hν |
CH3 |
|
|
CH3—C—CH3 + Br2 |
CH3—C—CH3 |
+ HBr |
||
|
||||
H |
|
Br |
|
|
2-метилпропан |
|
2-бром-2-метилпропан |
||
Такая последовательность замещения обусловлена устойчивостью образующихся свободных радикалов. Чем устойчивее свободный радикал, тем легче он образуется. Поскольку третичные алкильные радикалы более стабильны, чем вторичные и тем более первичные (см. с. 179), реакционная способность связей С—Н при галогенировании алканов увеличивается в ряду: первичный < вторич-
