
- •Тема 6: «Теплоемкость газов. Энтропия» 33
- •Тема 7: «Термодинамические процессы идеальных газов» 43
- •Тема 8: «Второй закон термодинамики» 57
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем» 71
- •Тема 10: «Водяной пар» 83
- •Тема 11. Истечение газов и паров 89
- •Тема 1: Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •4. Внутренняя энергия.
- •5. Энтальпия,
- •6. Энтропия,
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •Тема 2: «Состояние идеального газа»
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Тема 4: «Реальные газы»
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнения м.П. Вукаловича и и.И. Новикова
- •Контрольные вопросы
- •Тема 5: «Первый закон термодинамики»
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •Тема 6: «Теплоемкость газов. Энтропия»
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессе
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •Тема 7: «Термодинамические процессы идеальных газов»
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •Тема 8: «Второй закон термодинамики»
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем»
- •Характеристические функции
- •Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •Тема 10: «Водяной пар»
- •10.1. Основные понятия и определения
- •Контрольные вопросы
- •Тема 11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
Тема 4: «Реальные газы»
Реальные газы отличаются от идеальных тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой силами взаимодействия, имеющими электромагнитную или квантовую природу.
Из-за наличия сил взаимодействия между молекулами и конечности их объема законы идеальных газов, ни при каких условиях, не могут быть строго применены к реальным газам.
При
практических расчетах различных свойств
реальных газов широкое применение нашло
отношение
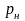 ,
которое называется коэффициентом
сжимаемости.
,
которое называется коэффициентом
сжимаемости.
Так
как для идеальных газов при любых
условиях
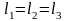 и
и
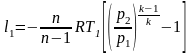 ,
следовательно коэффициент сжимаемости
отражает отклонение свойств реального
газа от идеального.
,
следовательно коэффициент сжимаемости
отражает отклонение свойств реального
газа от идеального.
Значение С зависит от давления и температуры может быть больше или меньше 1, при очень низком давлении и высокой температуре приблизительно равно 1.
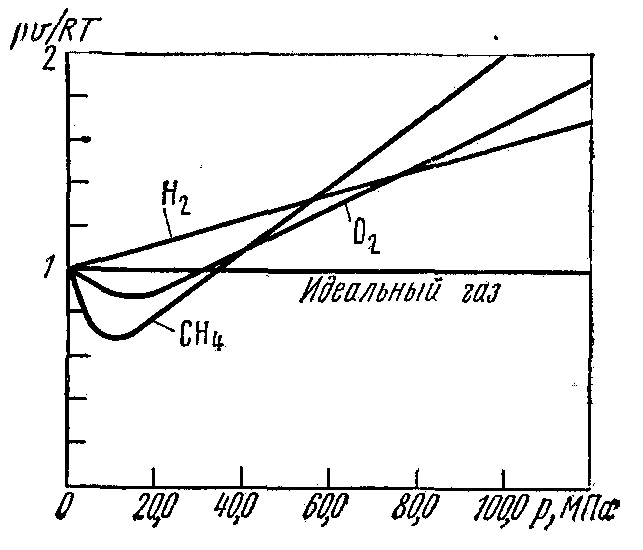
Рисунок 3 – Зависимость С от давления при температуре t=0 °С.
Повышение давления и понижение температуры, увеличение концентрации молекул газа и уменьшение расстояния между ними усиливает отклонения свойств реального газа от идеального.
4.1. Уравнение состояния Ван-дер-Ваальса
Уравнение состояния Ван-дер-Ваальса является одной из первых попыток аналитически описать свойства реальных газов. Это уравнение наглядно показывает качественные особенности реальных газов и их отличие от идеальных.
В первом приближении Ван-дер-Ваальс ввел в свое уравнение две поправки, которые учитывают отклонение реального газа от идеального.
Первая поправка зависит от объема самих молекул и тогда уравнение Клапейрона можно представить в виде:

отсюда
следует, что при увеличении давления
объем υ
будет уменьшаться, и если
 ,
то
,
то
 .
Это полностью согласуется с определением
идеального газа, в котором молекулы
занимают бесконечно малый объем.
.
Это полностью согласуется с определением
идеального газа, в котором молекулы
занимают бесконечно малый объем.
В реальном газе молекулы занимают конечный объем υмол. (молекулы представляются как недеформируемые шары) и необходимо учитывать объем зазоров между молекулами при их полной упаковке υзаз. Таким образом, свободный объем для движения молекул составляет υ – b, где b= υмол. + υзаз. Величина b – это тот минимальный объем, до которого можно сжать газ.
При этих условиях уравнение Клайперона принимает другой вид:
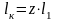
Если в полученной зависимости давление увеличивается и стремится к бесконечности, то объем стремится к нулю или величине b, которая зависит от объема молекул. При этом давление в реальных газах при одинаковой температуре выше, чем в идеальных газах вследствие наличия меньшего свободного объема.
Вторая поправка учитывает влияние сил межмолекулярного взаимодействия.
В реальном газе сила ударов о стенки сосуда меньше из-за того, что молекулы у стенки сосуда притягиваются соседними молекулами внутрь сосуда. Следовательно, и давление, оказываемое реальным газом, меньше на величину ∆р. Эта поправка прямо пропорциональна числу притягиваемых или притягивающих молекул, или квадрату плотности газа или обратно пропорциональна квадрату его удельного объема.
где α – коэффициент пропорциональности, принимающий для каждого газа определенное значение, не зависящее от состояния газа.
Введя эту поправку, получим:
 или
или
Отсюда уравнение Ван-дер-Ваальса принимает вид
где
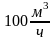 – внутреннее давление.
– внутреннее давление.
Уравнение Ван-дер-Ваальса качественно верно отражает поведение реальных газов в жидком или газообразном состоянии. Для двухфазных состояний оно неприменимо.
