
- •Тема 6: «Теплоемкость газов. Энтропия» 33
- •Тема 7: «Термодинамические процессы идеальных газов» 43
- •Тема 8: «Второй закон термодинамики» 57
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем» 71
- •Тема 10: «Водяной пар» 83
- •Тема 11. Истечение газов и паров 89
- •Тема 1: Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •4. Внутренняя энергия.
- •5. Энтальпия,
- •6. Энтропия,
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •Тема 2: «Состояние идеального газа»
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Тема 4: «Реальные газы»
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнения м.П. Вукаловича и и.И. Новикова
- •Контрольные вопросы
- •Тема 5: «Первый закон термодинамики»
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •Тема 6: «Теплоемкость газов. Энтропия»
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессе
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •Тема 7: «Термодинамические процессы идеальных газов»
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •Тема 8: «Второй закон термодинамики»
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем»
- •Характеристические функции
- •Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •Тема 10: «Водяной пар»
- •10.1. Основные понятия и определения
- •Контрольные вопросы
- •Тема 11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
Каждая характеристическая функция имеет свою область применения: изобарно-изотермический потенциал применяется для анализа изохорно-изотермических процессов, изобарно-изотермический – для анализа изобарно-изотермических процессов и т.д.
Рассмотрим физический смысл изохорно-изотермного потенциала в уравнениях
и
Представим себе, что рассматриваемая адиабатная система А является частью другой адиабатной системы В (среды) (рис. 26).
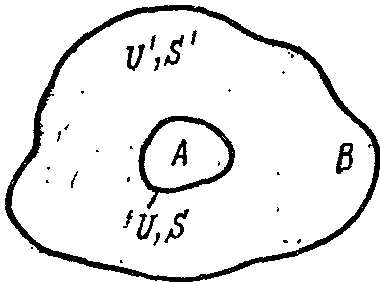
Рисунок 26.
Температура обеих систем Т. Внутри этих систем протекают различные процессы при постоянной температуре. Обозначим изменение внутренней энергии и энтропии системы А через dU и dS, а изменение внутренней энергии и энтропии среды В — через dU' и dS'.
По закону сохранения энергии, внутренняя энергия всей сложной замкнутой системы неизменна:
На основании второго закона термодинамики энтропия сложной системы или должна оставаться постоянной, или в случае необратимых процессов должна увеличиваться:
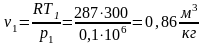
Предположим,
что система А
совершает
работу δL
над телами
среды В и
при этом передает среде В
некоторое
количество теплоты, вследствие чего
энтропия среды повысится на dS'.
Тогда на
основании термодинамического тождества
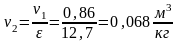 изменение
внутренней энергии среды В
составит
изменение
внутренней энергии среды В
составит
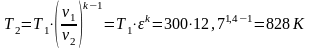
Работа имеет положительный знак, если она совершается над телами среды и увеличивает энергию ее тел. Из трех приведенных уравнений находим
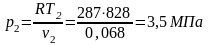
Все величины в этом уравнении относятся к системе, а не к среде.
Так как температура сложной системы постоянна, то уравнение можно представить так:
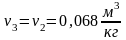
Выражение в скобках есть не что иное, как изохорно-изотермный потенциал системы F, поэтому для всяких изотермных процессов
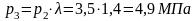
Для обратимых изотермических процессов
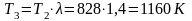 или
или
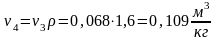
При изотермических обратимых процессах работа, совершаемая системой, равна уменьшению изохорно-изотермического потенциала.
Из
уравнений
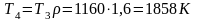 и
и
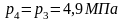 следует, что
следует, что
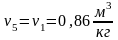
Или при постоянной температуре
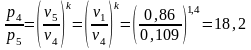
Величина
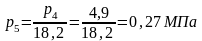 есть
полученная системой теплота, поэтому
данное уравнение указывает, что работа
в изохорно-изотермическом процессе
совершается не только за счет внутренней
энергии, но и за счет теплоты среды.
есть
полученная системой теплота, поэтому
данное уравнение указывает, что работа
в изохорно-изотермическом процессе
совершается не только за счет внутренней
энергии, но и за счет теплоты среды.
Работы равна разности
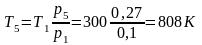
или
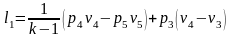
Работа равна уменьшению изохорно-изотермического потенциала F. Изохорно-изотермический потенциал системы есть часть ее энергии, которая в изотермическом процессе превращается во внешнюю работу.
Таким образом, общую энергию системы U можно представить в виде суммы двух частей уравнения:
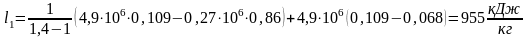
На внешнюю изотермическую работу расходуется только изохорно-изотермический потенциал. Часть TS выделяется в виде теплоты и в работе не участвует. Эту часть Гельмгольц назвал связанной энергией.
При
обратимом процессе работа, производимая
телом при переходе из одного состояния
в другое, является максимальной. Поэтому
если уравнение
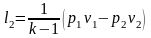 проинтегрировать между начальным и
конечным состоянием системы, то
проинтегрировать между начальным и
конечным состоянием системы, то
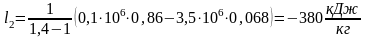
Максимальная работа, производимая системой в изотермическом процессе, равна разности изохорно-изотермических потенциалов в этих двух состояниях.
При
необратимом изотермическом процессе
работа
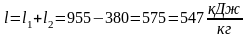 ,
совершаемая системой, меньше
,
совершаемая системой, меньше
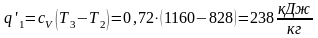 .
.
Из
уравнения
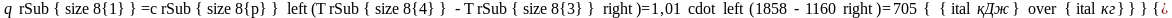 следует, что
следует, что
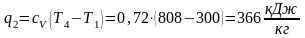
Или после интегрирования получаем
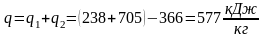
Из этого неравенства видно, что изохорно-изотермический потенциал системы при необратимом изотермическом процессе возрастает на меньшую величину по сравнению с внешней работой.
Уравнения
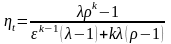 и
и
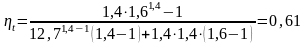 можно объединить в одно
можно объединить в одно
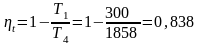
Знак равенства относится к обратимым процессам, знак «меньше» – к необратимым.
Таким образом, изохорно-изотермический потенциал F является мерой работоспособности системы при T=const.
Если
необратимый процесс протекает при
постоянных объеме и температуре без
совершения внешней работы, то общая
работа системы
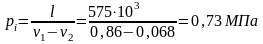 равна нулю и уравнение примет вид
равна нулю и уравнение примет вид
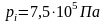
Изохорно-изотермический потенциал системы при постоянных объеме и температуре в необратимом процессе всегда убывает, а в обратимом остается величиной постоянной.
Применяя
уравнение
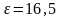 можно получить другое уравнение
максимальной работы
можно получить другое уравнение
максимальной работы
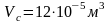
Пусть система переходит из первого во второе состояние, тогда
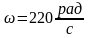 и
и
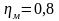
Разность изохорно-изотермических потенциалов
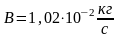
В изохорном процессе , поэтому
– уравнение максимальной работы Гиббса-Гельмгольца при постоянных Т и V.
Работа расширения системы, преодолевающая внешнее давление р, равна
Подставляя в уравнение это выражение, получим
Или, применяя
уравнение
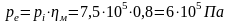 или
или
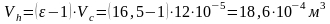 ,
находим
,
находим
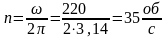
В рассматриваемой системе давление постоянно, поэтому последнее уравнение можно представит в виде
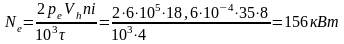
Выражение в скобках есть изобарно-изотермический потенциал, поэтому
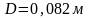 или
или
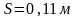
Отсюда следует, что в системах, находящихся при постоянной температуре и постоянном давлении, обратимые процессы протекают при постоянной величине изобарного потенциала.
При протекании в системе необратимых процессов изобарно-изотермический потенциал всегда уменьшается.
Необходимо отметить, что протекание процесса при постоянных температуре и давлении однородной системы, находящейся в среде постоянного давления и температуры, возможно лишь при неравенстве параметров системы с давлением и температурой среды.
В неоднородной системе, состоящей из двух фаз вещества, для которой давление и температура не являются независимыми параметрами, могут протекать обратимые процессы при равенстве температуры и давления системы и окружающей среды.
Уравнение работы при изобарно-изотермическом процессе можно представить в развернутом виде
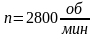
или
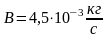
Из уравнения
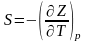
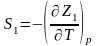 и
и
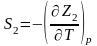
Подставляя значения энтропии в уравнение максимальной работы, получим
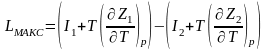
или

Но в изобарном процессе
, а
Поэтому
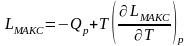 – уравнение
максимальной работы Гиббса-Гельмгольца
при постоянных Т
и р.
– уравнение
максимальной работы Гиббса-Гельмгольца
при постоянных Т
и р.
В системе при необратимом процесс, протекающем при постоянных давлении и температуре, полезная работа равна
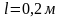
Т.е. она меньше максимальной работы на величину произведения абсолютной температуры среды на приращение энтропии системы.
Величину
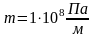 называют потерей полезной работы из-за
необратимости процесса.
называют потерей полезной работы из-за
необратимости процесса.
Характеристические функции U (V,S), I (p,S), F (T,V), Z (p,T), полностью определяющие все термодинамические свойства системы, называются также термодинамическими потенциалами.
Термодинамическим потенциалом называется такая характеристическая функция, убыль которой в равновесном процессе, протекающем при постоянстве определенной термодинамической пары термодинамических параметров (Т и V, T и p, S и U), равна полной работе, произведенной системой, за вычетом работы против внешнего давления.
Каждый из термодинамических потенциалов является функцией состояния системы.
Известно, что при обратимом процессе для перевода тела из одного состояния в другое необходимо затратить минимальную работу, при этом само тело при переходе совершает максимальную работу. Поэтому с помощью термодинамических потенциалов можно определить максимальную работу при различных независимых переменных.
Действительно, при постоянных независимых переменных S и V характеристической функцией и термодинамическим потенциалом является внутренняя энергия U (изохорно-изоэнтропический потенциал), а
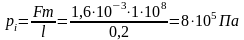 или
или

При изохорно-изоэнтропическом процессе максимальная работа изменения объема равна убыли внутренней энергии тела.
При постоянных независимых переменных S и p характеристической функцией и термодинамическим потенциалом является энтальпия I (изобарно-изоэнтропический потенциал), а
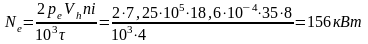 или
или
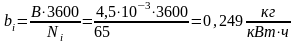
При изобарно-изоэнтропическом процессе максимальная полезная внешняя работа равна убыли энтальпии тела.
При
постоянных независимых переменных
Т
и V
характеристической функцией и
термодинамическим потенциалом является
изохорно-изотермический потенциал

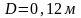 или
или
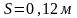
При изохорно-изотермическом процессе максимальная работа изменения объема равна убыли изохорно-изотермического потенциала.
При постоянных независимых переменных Т и p характеристической функцией и термодинамическим потенциалом является изобарно-изотермический потенциал, а
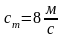 или
или
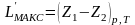
При изобарно-изотермическом процессе максимальная полезная внешняя работа равна убыли изобарно-изотермического потенциала.
Таким образом, знание хотя бы одного термодинамического потенциала позволяет определить термические и калорические свойства термодинамической системы.
При практических исследованиях чаще всего применяют два потенциала: изохорно-изотермический и изобарный, поскольку независимые переменные Т, V и Т, р, при которых они являются потенциалами, легко могут быть получены из эксперимента.
Все термодинамические потенциалы являются аддитивными и однозначными функциями состояния, а их убыль при соответствующих условиях определяет работу действующих на систему сил.
