
- •Тема 6: «Теплоемкость газов. Энтропия» 33
- •Тема 7: «Термодинамические процессы идеальных газов» 43
- •Тема 8: «Второй закон термодинамики» 57
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем» 71
- •Тема 10: «Водяной пар» 83
- •Тема 11. Истечение газов и паров 89
- •Тема 1: Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •4. Внутренняя энергия.
- •5. Энтальпия,
- •6. Энтропия,
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •Тема 2: «Состояние идеального газа»
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Тема 4: «Реальные газы»
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнения м.П. Вукаловича и и.И. Новикова
- •Контрольные вопросы
- •Тема 5: «Первый закон термодинамики»
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •Тема 6: «Теплоемкость газов. Энтропия»
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессе
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •Тема 7: «Термодинамические процессы идеальных газов»
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •Тема 8: «Второй закон термодинамики»
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем»
- •Характеристические функции
- •Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •Тема 10: «Водяной пар»
- •10.1. Основные понятия и определения
- •Контрольные вопросы
- •Тема 11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
6.3. Теплоемкость в изохорном и изобарном процессе
Поскольку теплоемкость зависит от характера процесса, то выражения теплоемкости в изохорном и изобарном процессах будут выглядеть следующим образом:
В изохорном процессе
В изобарном процессе
При равновесном процессе нагревания тела элементарное количество теплоты определяется соотношением:
Поскольку внутренняя энергия есть функция двух параметров системы:
Можно записать
тогда
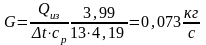
Полученное выражение для процесса при постоянном объеме примет вид
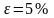
Поэтому теплоемкость при υ=const может быть представлена уравнением
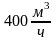
Т.е. теплоемкость при постоянном объеме равна частной производной от внутренней энергии (рассматриваемой как функцию Т и υ) по температуре.
Кроме того, поскольку в процессе изохорного процесса тело не совершает внешней работы, вся теплота, совершаемая телом, идет на приращение внутренней энергии.
или
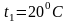
Изменение внутренней энергии идеального газа равно произведению теплоемкости при постоянном объеме на разность температур тела в любом процессе.
Подставляя
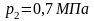 в уравнение первого закона термодинамики,
получим в общем случае для обратимого
процесса при бесконечно малом изменении
состоянии идеального газа
в уравнение первого закона термодинамики,
получим в общем случае для обратимого
процесса при бесконечно малом изменении
состоянии идеального газа
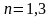
Если в качестве независимых переменных принять Т и υ, то из уравнения первого закона термодинамики получим
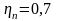
Отсюда при р=const

или, поскольку,
Учитывая, что , получим
Последнее уравнение устанавливает взаимосвязь между двумя теплоемкостями ср и сυ.
Для
идеального газа
,
а из уравнения состояния
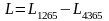 ,
следовательно
,
следовательно
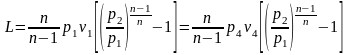 и
и
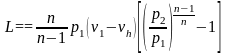
Это уравнение носит название уравнения Майера.
Для
идеальных газов разность
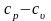 есть величина постоянная. Для реальных
газов
есть величина постоянная. Для реальных
газов
 .
.
Это неравенство объясняется тем, что при расширении реальных газов (при р=const) совершается не только внешняя, но внутренняя работа, связанная с изменением внутренней потенциальной энергии тела, что и вызывает больший расход теплоты.
Уравнение для теплоемкости ср можно получить, если в качестве независимых использовать Т и р, тогда получим:
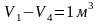
или
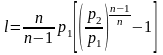
Откуда следует, что р=const
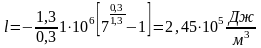
И, следовательно, теплоемкость при постоянном давлении равна
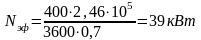
Т.е. теплоемкость тела ср при p=const равна частной производной от энтальпии i по температуре Т и является функцией р и Т.
Поскольку энтальпия идеального газа зависит только от температуры, то теплоемкость ср идеального газа для любого процесса
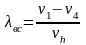
Тогда уравнение первого закона термодинамики
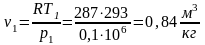
Для идеального газа можно представить в виде
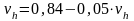
6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики.
Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул.
Согласно
этой теореме внутренняя энергия
идеального газа прямо пропорциональная
числу степеней свободы молекул и энергии
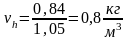 ,
приходящейся на одну степень свободы.
,
приходящейся на одну степень свободы.
Для 1 моля газа
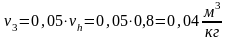
где
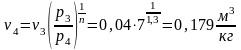 – число Авогадро;
– число Авогадро;
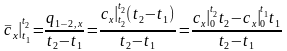 – число степеней
свободы (число независимых координат,
которые нужно задавать, чтобы полностью
определить положение молекулы в
пространстве).
– число степеней
свободы (число независимых координат,
которые нужно задавать, чтобы полностью
определить положение молекулы в
пространстве).
Молекула
одноатомного газа
имеет 3
степени свободы поступательного
движения. Мольная теплоемкость равна
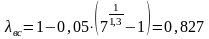 .
.
Молекула двухатомного газа кроме поступательного может совершать еще и вращательное движение вокруг общего центра тяжести, который находится на линии, соединяющей два атома. Такая молекула имеет 5 степеней свободы, 3 из которых принадлежат поступательному движению и 2 степени свободы вращательного движения. Мольная теплоемкость равна .
Молекулы трех- и многоатомных газов имеют 3 степени свободы поступательного движения и 3 степени свободы вращательного движения, всего 6. мольная теплоемкость равна .
