- •Тема 6: «Теплоемкость газов. Энтропия» 33
- •Тема 7: «Термодинамические процессы идеальных газов» 43
- •Тема 8: «Второй закон термодинамики» 57
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем» 71
- •Тема 10: «Водяной пар» 83
- •Тема 11. Истечение газов и паров 89
- •Тема 1: Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •4. Внутренняя энергия.
- •5. Энтальпия,
- •6. Энтропия,
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •Тема 2: «Состояние идеального газа»
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Тема 4: «Реальные газы»
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнения м.П. Вукаловича и и.И. Новикова
- •Контрольные вопросы
- •Тема 5: «Первый закон термодинамики»
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •Тема 6: «Теплоемкость газов. Энтропия»
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессе
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •Тема 7: «Термодинамические процессы идеальных газов»
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •Тема 8: «Второй закон термодинамики»
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем»
- •Характеристические функции
- •Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •Тема 10: «Водяной пар»
- •10.1. Основные понятия и определения
- •Контрольные вопросы
- •Тема 11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
7.5. Адиабатный процесс
Адиабатным называется процесс, протекающий без подвода и отвода теплоты, т.е. при отсутствии теплообмена рабочего тела с окружающей средой.
Кривая процесса – адиабата.

Рисунок 15 – р,υ- и T,s-диаграммы адиабатного процесса.
Из уравнения
первого закона термодинамики при
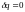 имеем
имеем
и
Разделив первое уравнение на второе, получим
или
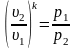
Интегрируя последнее выражение при условии, что k=const (поскольку ср=const и сυ=const), получим

и
После потенцирования имеем
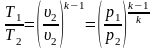
и
Отсюда уравнение адиабаты
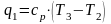
Величина k называется показателем адиабаты.
Зависимость между основными параметрами в адиабатном процессе.
Из уравнения адиабаты следует, что
и

Если эти соотношения параметров тела подставить в уравнение состояния для крайних точек процесса
То после соответствующих преобразований
Удельная работа изменения объема , совершаемая телом над окружающей средой при равновесном адиабатном процессе, может быть вычислена по уравнению адиабаты
или
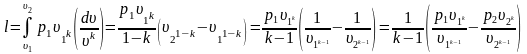
Откуда
Из данного выражения могут быть получены следующие формулы:
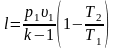 и
и
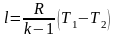
Отношение температур заменяем отношением объемов и давлений.
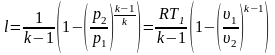
Все зависимости между р, υ и Т и уравнения работы получены при условии k=const. При переменной k при расчетах берут среднее значение, соответствующее изменению температуры в процессе по уравнению:
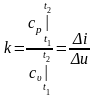
Уравнение первого закона термодинамики для адиабатного процесса:
и
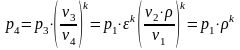
Из этого выражения можно получить дифференциальное уравнение изоэнтропного (при постоянной энтропии) процесса:
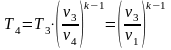
В
этом уравнении
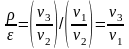 .
.
Согласно первому закону термодинамики, удельная работа изменения объема в адиабатном процессе получается за счет убыли удельной внутренней энергии тела.
При cυ=const.
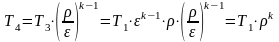
При сυ≠const.
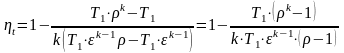
Если газ расширяется, то его внутренняя энергия и температура убывают, если газ сжимается, то его внутренняя энергия и температура возрастают.
Удельная
теплоемкость в адиабатном процессе из
выражения
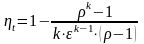 при
при
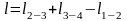 также равна нулю.
также равна нулю.
Располагаемая (полезная) внешняя работа в адиабатном процессе:
При обратимом адиабатном процессе идеального газа располагаемая внешняя работа будет в k раз больше удельной работы изменения объема и обратна ей по знаку.
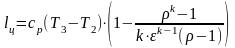
и
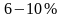
Графически располагаемая внешняя работа изображается на р,υ–диаграмме пл. ABCD.

Рисунок 16.
На рисунке 16 видно, что, поскольку k>1, линия адиабаты идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Для обратимого адиабатного процесса , поэтому и s1=s2=const, т.е. обратимый адиабатный процесс является изоэнтропным.
Протекание необратимого адиабатного процесса не является изоэнтропным и независимо от его направления как при расширении, так и при сжатии сопровождается увеличением удельной энтропии. На рисунке 12 обратимый адиабатный процесс изображается прямыми 0-b, d-c, необратимый адиабатный процесс расширения – кривая 0-с, а процесс сжатия – с-e.
7.6. Политропные процессы
Политропным называется всякий процесс идеального газа, в котором удельная теплоемкость является постоянной величиной.
Кривая процесса – политропа.
Частные случаи политропного процесса – изохорный, изобарный, изотермический, адиабатный, протекающие при постоянной удельной теплоемкости.
Удельная теплоемкость политропного процесса сп принимает значения от +∞ до -∞.
Удельное количество теплоты политропного процесса:
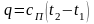 и
и
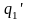
Вывод уравнения политропного процесса: на основании первого закона термодинамики.
 и
и
Из этих уравнений найдем
Обозначив выражение получим
Интегрируя полученное выражение в пределах начало–конец процесса, находим
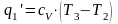
или
 – уравнение
политропного процесса
– уравнение
политропного процесса
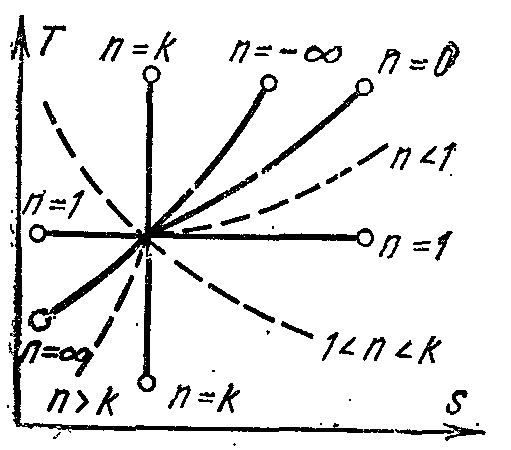
Показатель политропы n принимает для каждого процесса определенное числовое значение:
Изохорный процесс – n=±∞
Изобарный процесс – n=0
Изотермический – n=1
Адиабатный – n=k
Поскольку уравнение политропы отличается от уравнения адиабаты только значениями показателя n, то и все уравнения, связывающие основные параметры, аналогичны:
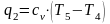
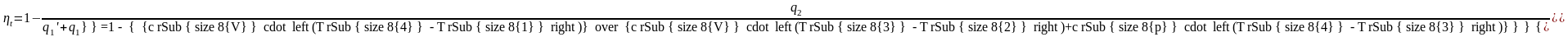
Удельная теплоемкость политропного процесса определяется из формулы
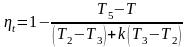
откуда
Данное уравнение позволяет определить удельную теплоемкость для каждого значения n. Подставив в него значения n для частных случаев, получим:
Изохорный процесс – n=±∞, сП=сυ
Изобарный процесс – n=0, сП=к·сυ
Изотермический – n=1, сП=±∞
Адиабатный – n=k, сП=0
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением при адиабатном процессе:
Изменение внутренней энергии газа и удельное количество теплоты в политропном процессе определяется по формулам:
Располагаемая внешняя работа в политропном процессе по аналогии с адиабатным процессом равна:
Изменение удельной энтальпии в политропном процессе:
Значение n может быть определено по координатам двух любых точек графика:
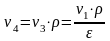

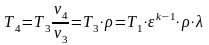
Изменение удельной энтропии газа в политропном процессе определяется по формуле:
Или для конечного изменения состояния

Политропный процесс на T,s-диаграмме изображается некоторой кривой, расположение которой зависит от показателя n (рис. 17).
Рисунок 17. |
Рисунок 18. |
На рисунке 18 показано расположение политропных процессов на p,υ-диаграмме, выходящих из одной и той же точки, в зависимости от значения показателя n.
Изменение удельной внутренней энергии в политропных процессах:
В изотермическом процессе при n=1 удельная внутренняя энергия газа не изменяется (u2=u1).
В изобарном процессе при n=0 удельная внутренняя энергия увеличивается.
В изохорном процессе при n=–∞ удельная внутренняя энергия возрастает.
Отсюда можно сделать вывод, что все политропные процессы, т.е. процессы расширения, расположенные над изотермой, при n<1, а процессы сжатия при n>1 протекают с увеличением удельной внутренней энергии газа.
Политропные процессы, т.е. процессы расширения, расположенные под изотермой при n>1, и процессы сжатия при n<1 протекают с уменьшением удельной внутренней энергии газа.
Изменения знака количества теплоты политропного процесса:
В адиабатном процессе теплота не подводится и не отводится.
Изохорный процесс расширения – n= –∞ – теплота подводится.
Изобарный процесс расширения – n=0 – теплота подводится.
Изотермический процесс расширения – n=1 – теплота подводится.
Следовательно, все политропные процессы, т.е. процессы расширения, расположенные адиабатой в пределах k>n>–∞, а процессы сжатия при ∞>n>k протекают с подводом количества теплоты к рабочему телу.
Политропные процессы расширения при ∞>n>k, а процессы сжатия при –∞<n<k протекают с отводом количества теплоты.
Процессы,
расположенные между адиабатой и
изотермой, имеют отрицательную
теплоемкость, так как знак
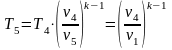 и
и
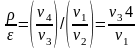 в этих процессах различный. Практически
это означает, что при подводе теплоты
в этих процессах температура уменьшается,
а при отводе – увеличивается.
в этих процессах различный. Практически
это означает, что при подводе теплоты
в этих процессах температура уменьшается,
а при отводе – увеличивается.