
- •Тема 6: «Теплоемкость газов. Энтропия» 33
- •Тема 7: «Термодинамические процессы идеальных газов» 43
- •Тема 8: «Второй закон термодинамики» 57
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем» 71
- •Тема 10: «Водяной пар» 83
- •Тема 11. Истечение газов и паров 89
- •Тема 1: Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •4. Внутренняя энергия.
- •5. Энтальпия,
- •6. Энтропия,
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •Тема 2: «Состояние идеального газа»
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Тема 4: «Реальные газы»
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнения м.П. Вукаловича и и.И. Новикова
- •Контрольные вопросы
- •Тема 5: «Первый закон термодинамики»
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •Тема 6: «Теплоемкость газов. Энтропия»
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессе
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •Тема 7: «Термодинамические процессы идеальных газов»
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •Тема 8: «Второй закон термодинамики»
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем»
- •Характеристические функции
- •Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •Тема 10: «Водяной пар»
- •10.1. Основные понятия и определения
- •Контрольные вопросы
- •Тема 11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
8.6. Математическое выражение второго закона термодинамики
Из выражения термического КПД следует, что
но для обратимого цикла Карно термический КПД еще выражается через температуры источников теплоты
и
или
Считаем подводимую теплоту Q1 величиной положительной, а отводимую Q2 – отрицательной, тогда
– Отношение подводимой или отводимой теплоты к соответствующей абсолютной температуре – приведенная теплота
– Алгебраическая сумма приведенных теплот для обратимого цикла Карно равна нулю
Этот вывод может быть использован и для любого произвольного обратимого цикла.
Рассмотрим какой-либо произвольный обратимый цикл 12341.
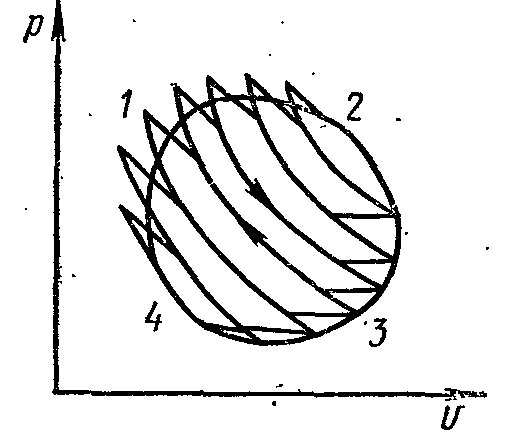
Рисунок 24 – Произвольный обратимый цикл.
Разобьем такой цикл адиабатами на бесконечно большое количество элементарных циклов. Каждый элементарный цикл можно считать элементарным циклом Карно. Бесконечно малые участки подвода и отвода теплоты можно считать изотермами, а адиабаты на величину полезной работы не влияют, так как каждая из них проходит два раза в противоположных направлениях.
Для каждого элементарного цикла Карно:
А для всего произвольного цикла
– математическое выражение второго закона термодинамики для произвольного обратимого цикла – первый интеграл Клаузиуса.
Знак
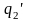 означает интегрирование по замкнутому
контуру.
означает интегрирование по замкнутому
контуру.
Таким образом, алгебраическая сумма приведенных теплот для любого обратимого цикла равна нулю.
Для необратимого цикла Карно термический КПД будет меньше соответствующего КПД обратимого цикла при одинаковых температурах теплоотдатчика и теплоприемника:
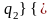
или
 ;
;
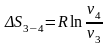 ;
;
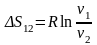 ;
;
Так
как
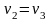 – величина отрицательная, то для
необратимого цикла Карно получаем
– величина отрицательная, то для
необратимого цикла Карно получаем
 или
или
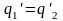
Алгебраическая сумма приведенных теплот для необратимого цикла Карно меньше нуля; она является величиной отрицательной.
Для произвольного необратимого цикла, составленного из бесконечно большого количества необратимых элементарных циклов, получаем
 – математическое
выражение второго закона термодинамики
для произвольного необратимого цикла
– второй
интеграл Клаузиуса.
– математическое
выражение второго закона термодинамики
для произвольного необратимого цикла
– второй
интеграл Клаузиуса.
Объединяя обе формулы (первый и второй интегралы Клаузиуса), получим математическое выражение второго закона термодинамики:
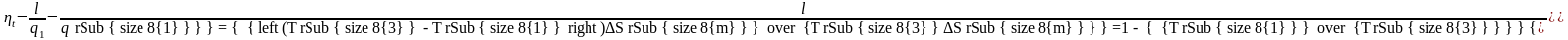 – знак равенства
относится к обратимым, а неравенства –
к необратимым циклам.
– знак равенства
относится к обратимым, а неравенства –
к необратимым циклам.
8.7. Изменение энтропии в обратимых и необратимых процессах
В обратимом круговом процессе интеграл по замкнутому контуру от равен нулю.
Поэтому отношение представляет собой полный дифференциал некоторой функции, которая зависит только от данного состояния тела. Эта функция обозначается S и называется энтропией.
Проинтегрировав данное выражение по какому-либо пути, получим
При обратимом адиабатном процессе, когда ,
и
Т.е. в адиабатном процессе энтропия не изменяется.
Рассмотрим изменение энтропии при необратимом процессе.
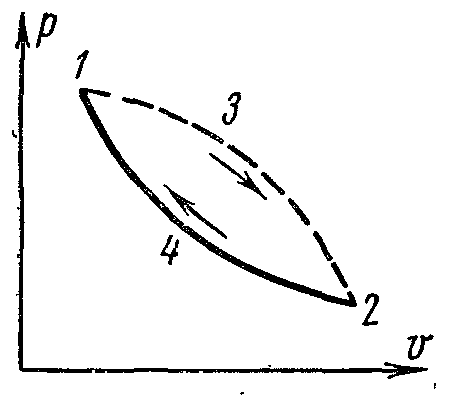
Рисунок 25.
Проведем между состояниями 1 и 2 обратимый процесс 241 и условно пунктиром – необратимый 132. Полученный в результате цикл будет необратимым.
Согласно уравнению получаем
Так как процесс 241 обратимый, то второй интеграл равен разности S1 – S2 поэтому
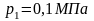
или
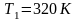
Знак неравенства указывает на то, что в случае необратимого процесса интеграл в правой части его уже не выражает разности энтропий, а меньше ее.
Объединяя уравнения для обратимого и необратимого процессов, получим
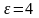
Энтропия есть функция состояния, поэтому изменение энтропии как для обратимого, так и для необратимого процессов будет одним и тем же.
Уравнение
показывает, что для обратимого процесса
 равен изменению энтропии, а для
необратимого он меньше, чем
равен изменению энтропии, а для
необратимого он меньше, чем
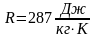 .
.
Для элементарного необратимого процесса
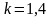
Для всякого процесса
где – количество теплоты, полученное телом от источника теплоты;
– абсолютная температура источника теплоты.
Знак равенства относится к обратимым процессам, знак «больше» – к необратимым.
Все вышеперечисленные формулы определяют изменение энтропии. Значение энтропии для какого-либо заданного состояния должно содержать некоторую постоянную величину S0 (константа интегрирования), которая представляет собой значение энтропии тела при температуре абсолютного нуля:
Где интегрирование производится вдоль произвольного обратимого процесса.
Числовое значение постоянной интегрирования S0 не может быть определено с помощью первого и второго законов термодинамики. Она определяется с помощью тепловой теоремы Нернста.
Для решения многих практических задача важным является не абсолютное значение энтропии, а ее изменение, поэтому величина S0 является несущественной.
Для изолированных систем, которые по определению не обмениваются теплотой с окружающей средой, выражение для энтропии примет вид
Знак равенства относится к обратимым, знак «больше» – к необратимым процессам.
Если в адиабатной изолированной системе осуществляются равновесные процессы, то энтропия системы остается постоянной
Самопроизвольные (неравновесные) процессы в изолированной системе всегда приводя к увеличению энтропии.
Таким образом, энтропия изолированных систем может оставаться постоянной при ее обратимых изменениях и возрастать при необратимых изменениях, но ни при каких условиях не может уменьшаться.
При этом необходимо отметить следующее замечание: энтропия отдельных тел в изолированной системе может не только увеличиваться, но и уменьшаться, например, при отдаче телом теплоты.
Все действительные процессы являются необратимыми, поэтому энтропия изолированной системы всегда увеличивается.
Сам факт увеличения энтропии, казалось бы, особого значения не имеет, однако возрастание энтропии при необратимых процессах связано с уменьшением работоспособности изолированной системы.
