
- •Тема 6: «Теплоемкость газов. Энтропия» 33
- •Тема 7: «Термодинамические процессы идеальных газов» 43
- •Тема 8: «Второй закон термодинамики» 57
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем» 71
- •Тема 10: «Водяной пар» 83
- •Тема 11. Истечение газов и паров 89
- •Тема 1: Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •4. Внутренняя энергия.
- •5. Энтальпия,
- •6. Энтропия,
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •Тема 2: «Состояние идеального газа»
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Тема 4: «Реальные газы»
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнения м.П. Вукаловича и и.И. Новикова
- •Контрольные вопросы
- •Тема 5: «Первый закон термодинамики»
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •Тема 6: «Теплоемкость газов. Энтропия»
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессе
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •Тема 7: «Термодинамические процессы идеальных газов»
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •Тема 8: «Второй закон термодинамики»
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем»
- •Характеристические функции
- •Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •Тема 10: «Водяной пар»
- •10.1. Основные понятия и определения
- •Контрольные вопросы
- •Тема 11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
Контрольные вопросы
Что понимают под удельной теплоемкостью?
Дать определение массовой, объемной и мольной теплоемкости.
Что называется средней теплоемкостью?
Что называется истинной теплоемкостью?
Что такое теплоемкость при постоянном объеме и теплоемкость при постоянном давлении?
Как записывается и какой смысл уравнения Р.Майера?
Какой смысл показателя адиабаты k и как он определяется?
Почему теплоемкость при постоянном давлении всегда больше теплоемкости при постоянном объеме?
Каким выражением устанавливается зависимость истинной теплоемкости реальных газов от температуры?
Какими уравнениями вычисляется средняя теплоемкость?
Что представляет собой теплоемкость газовой смеси и как она вычисляется?
Задача
Определить изменение внутренней энергии 2 кг кислорода при расширении в цилиндре с подвижным поршнем, если температура его изменяется от 600 до 100 °С. Задачу решить при постоянной теплоемкости и по таблицам. Определить процент ошибки.
Решение:
Изменение внутренней энергии кислорода при переменной теплоемкости
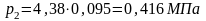
где
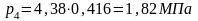
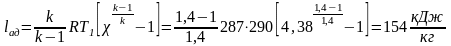
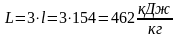
Изменение
внутренней энергии кислорода при
постоянной теплоемкости
 по молекулярно-кинетической теории
газов
по молекулярно-кинетической теории
газов
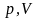
Процент ошибки
Тема 7: «Термодинамические процессы идеальных газов»
7.1. Основные определения
Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, изменением внутренней энергии и внешней работой газа, причем количество теплоты, отводимое от тела и подводимое к нему, зависит от характера процесса.
Основные термодинамические процессы:
1. изохорный (υ=const);
2. изобарный (р=const);
3. изотермический (Т=const);
4. адиабатный (протекающий при отсутствии теплообмена с окружающей средой).
Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными (характеризуются постоянством теплоемкости в процессе).
Для всех процессов устанавливается общий метод исследования, заключающийся в следующем:
1. выводится уравнение кривой процесса на р,υ- и Т,s-диаграммах;
2. устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса;
3. определяется изменение удельной внутренней энергии по формуле, справедливой для всех процессов идеального газа:
Или при постоянной теплоемкости
4. Вычисляется работа изменения объема газа по основной формуле:
5. Определяется удельное количество теплоты, участвующее в процессе:
6. Определяется изменение удельной энтальпии в процессе по формуле, справедливой для всех процессов:
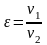
И для постоянной теплоемкости
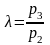
7. Определяется изменение удельной энтропии идеального газа по формулам:
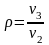
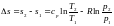
Рассматриваемые процессы считаются обратимыми.
7.2. Изохорный процесс
Изохорным называется процесс, протекающий при постоянном объеме. Кривая процесса называется изохора.
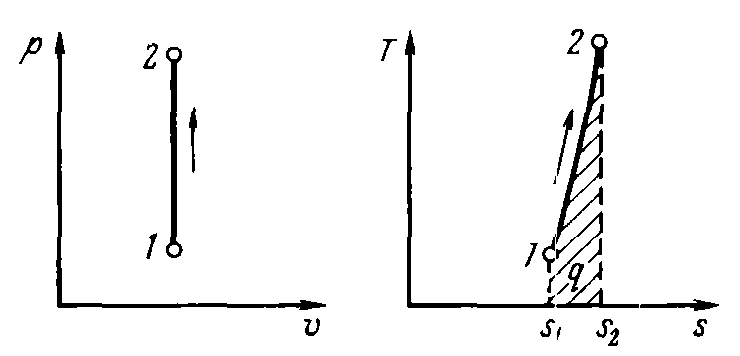
Рисунок 11 – р,υ- и T,s-диаграммы изохорного процесса.
Из уравнения состояния идеального газа
При υ=const давление газа изменяется прямо пропорционально абсолютным температурам:
Внешняя работа газа (работа расширения) при этом равна нулю.
Удельная располагаемая (полезная) внешняя работа l´, которая может быть передана внешнему объекту работы, определяется по формуле:
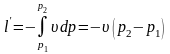
Основное уравнение первого закона термодинамики при δl=0 принимает вид:
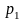
Количество теплоты, участвующее в процессе при постоянной теплоемкости, равно
Вся внешняя теплота расходуется только на изменение внутренней энергии.
При переменной теплоемкости
Если в процессе давление повышается, то удельное количество теплоты подводится, при этом увеличиваются внутренняя энергия и температура газа.
Если давление понижается, то теплота отводится, при этом уменьшаются внутренняя энергия и температура.
Изменение удельной энтропии в изохорном процессе при постоянной теплоемкости равно (рис. 12)
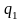
Данное уравнение показывает, что изохора на T,s-диаграмме представляет собой кривую 1–2.
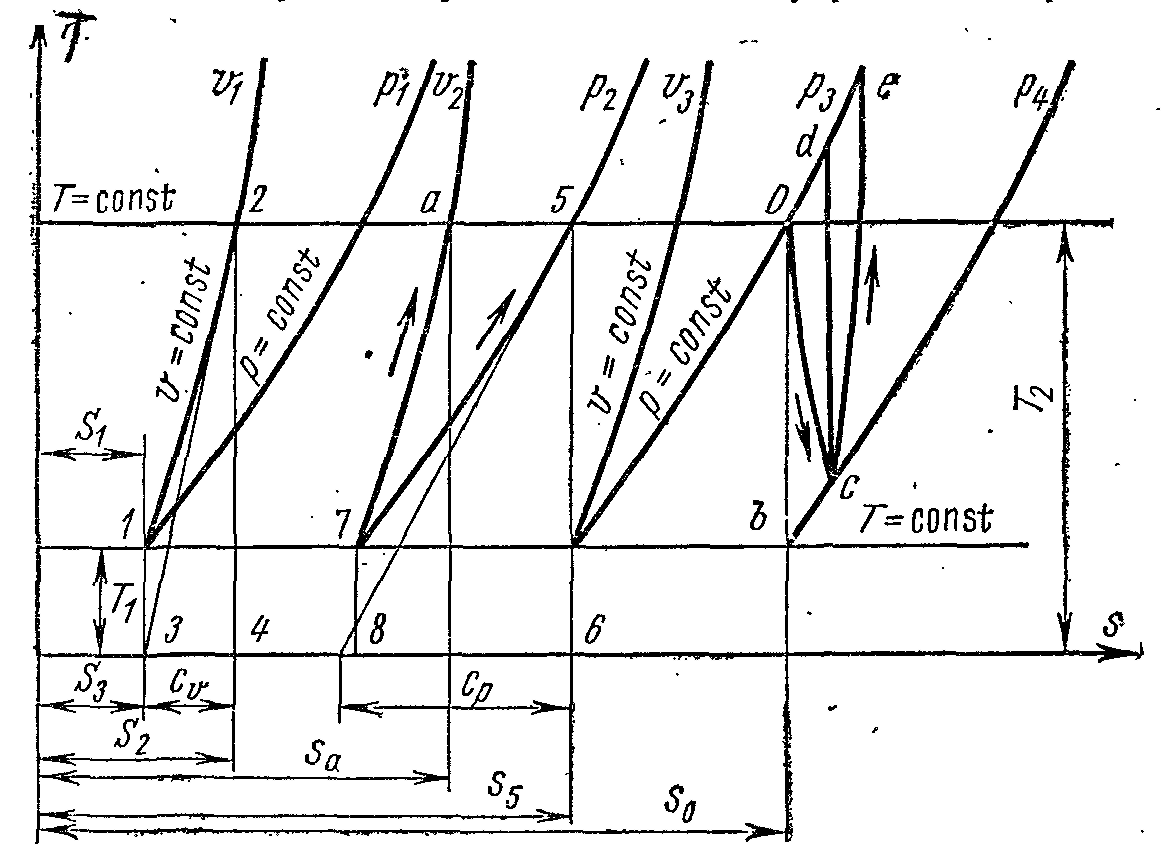
Рисунок 12.
Площадь под кривой в некотором масштабе изображает количество теплоты q, расходуемое на изменение внутренней энергии газа (u2–u1).
Изохоры, построенные для различных объемов, смещены друг относительно друга на расстояние, определяемое по уравнению при Т=const (рис. 12):
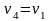
Чем больше объем газа, тем дальше находится изохора от оси ординат.
