
- •Тема 6: «Теплоемкость газов. Энтропия» 33
- •Тема 7: «Термодинамические процессы идеальных газов» 43
- •Тема 8: «Второй закон термодинамики» 57
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем» 71
- •Тема 10: «Водяной пар» 83
- •Тема 11. Истечение газов и паров 89
- •Тема 1: Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •4. Внутренняя энергия.
- •5. Энтальпия,
- •6. Энтропия,
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •Тема 2: «Состояние идеального газа»
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Тема 4: «Реальные газы»
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнения м.П. Вукаловича и и.И. Новикова
- •Контрольные вопросы
- •Тема 5: «Первый закон термодинамики»
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •Тема 6: «Теплоемкость газов. Энтропия»
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессе
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •Тема 7: «Термодинамические процессы идеальных газов»
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •Тема 8: «Второй закон термодинамики»
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •Тема 9: «Характеристические функции и термодинамические потенциалы. Равновесие систем»
- •Характеристические функции
- •Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •Тема 10: «Водяной пар»
- •10.1. Основные понятия и определения
- •Контрольные вопросы
- •Тема 11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
9.4. Общие условия равновесия термодинамической системы
Во всякой простой или сложной термодинамической системе, которая находится в неравновесном состоянии (в системе имеется разность давлений, температур и пр.), обязательно возникают самопроизвольные необратимые процессы, которые рано или поздно должны привести систему в состояние устойчивого равновесия.
Устойчивое равновесие характеризуется тем, что в системе устраняются причины, вызвавшие неравновесные процессы, а сама система самопроизвольно возвращается в первоначальное равновесное состояние. Любая термодинамическая система, взаимодействующая с окружающей средой, имеющей неизменные параметры, с течением времени приходит в устойчивое равновесие вне зависимости от начальных условий.
Термодинамические потенциалы, а также энтропия могут служить величинами, указывающими направление процесса и характеризовать условия устойчивого равновесия в любых термодинамических системах.
Пусть мы имеем изолированную от внешних влияний термодинамическую систему, в которой внутренняя энергия U и общий объем V имеют постоянное значение и в которой происходят какие угодно неравновесные процессы. Так как все эти процессы, будучи необратимыми, протекают в одном и том же направлении, то энтропия системы все время возрастает: dS>0. Когда в системе наступит устойчивое равновесие при постоянных внутренней энергии и объеме системы и все процессы в ней прекратятся, то остановится и возрастание энтропии, т.е. в состоянии устойчивого равновесия энтропия системы будет иметь максимальное значение:
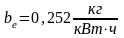 ;
;
Последнее равенство характеризует, как известно из математики, условие максимума S. Энтропия при адиабатном необратимом процессе может только возрастать, и, следовательно, устойчивое равновесие наступит тогда, когда энтропия достигнет максимума:
Из уравнения тождества
следует, что при S=const и V=const внутренняя энергия системы достигает минимума, т.е.
;
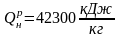
Вследствие этого при всех неравновесных изохорно-изоэнтропных процессах внутренняя энергия U может только убывать и в состоянии равновесия U=UМАКС.
Докажем, что и энтальпия в условиях равновесия принимает минимальное значение. Изменение энтальпии для необратимого процесса можно получить из уравнения тождества :
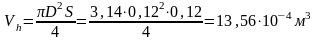
При постоянных р и S энтальпия I (изобарно-изоэнтропийный потенциал) достигает минимума:
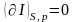 ;
;
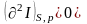
В связи с тем что энтальпия I при необратимом процессе и постоянных S и p уменьшается с приближением системы к равновесию, то в условиях устойчивого равновесия она принимает минимальное значение: I=IМИН.
Условия
устойчивого равновесия в системе при
постоянных значениях температуры Т
и объема V
можно получить, проанализировав уравнение
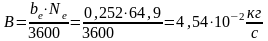 .
.
Из этого анализа следует, что в обратимых процессах изохорно-изотермный потенциал F остается постоянной величиной, а в необратимых процессах он всегда убывает:
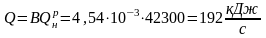
Поэтому в условиях равновесия системы изменение изохорном изотермного потенциала становится равным нулю:
;
а сам изохорно-изотермный потенциал принимает минимальное значение: F=FМИН.
Особого внимания заслуживает условие равновесия в изотермных системах, находящихся под постоянным давлением. В этом случае характеристической функцией, как было показано выше, будет изобарно-изотермный потенциал.
Из
уравнения
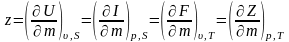
следует, что в системах, находящихся при Т=const и р=const, обратимые процессы протекают при постоянной величине изобарного потенциала; если же в системе протекают необратимые процессы, то изобарный потенциал может только уменьшаться:
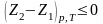
Следовательно, в условиях равновесия системы изменения изобарного потенциала составляют
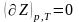 ;
;
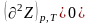
а сам изобарный потенциал принимает минимальное значение: Z=ZМИН.
Это правило находит большое применение в некоторых вопросах молекулярной физики и физической химии.
Таким образом, как изохорно-изотермный, так и изобарный потенциалы определяют направление процесса в системе и полностью характеризуют условие равновесия, а уравнения
;
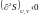
;
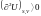
;
;
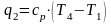
;
выражают общие условия равновесия в системе.
Выбор того или иного уравнения для изучения равновесия термодинамической системы зависит от того, какими параметрами характеризуется система.
Если dQ = 0, то ; и
Если
V
= const,
то
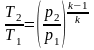 ;
;
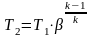 и U=UМАКС.
и U=UМАКС.
Если
р =
const,
то
;
и
 .
.
Если
Т, V
= const,
то
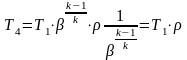 ;
;
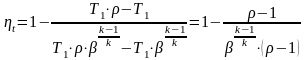 и F=FМИН.
и F=FМИН.
Если Т, р = const, то ; и Z=ZМИН.
Таким образом, условия равновесия требуют, чтобы термодинамические потенциалы имели минимальное значение при своих переменных, а энтропия имела максимальное значение при постоянстве внутренней энергии и объема системы.
