
RCL_11
.pdf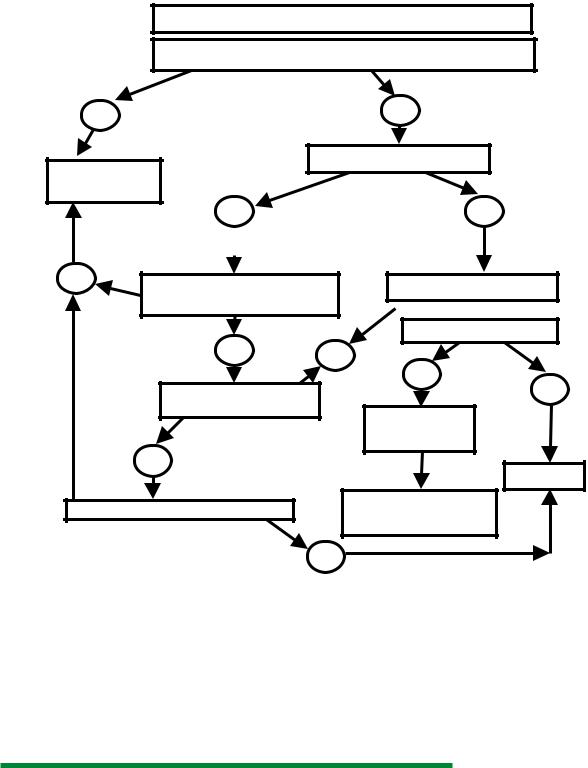
Раздел 5. Актуальные аспекты респираторной терапии |
241 |
|
|
Преоксигенация (если возможно) / Вентиляция маской (если необходимо)
Первая попытка оротрахеальной интубации успешна?
Да |
Нет |
|
|
|
Вентиляция маской возможна? |
Контроль положения трубки |
|
-ETCO2, SpO2
-аускультация
Да |
Нет |
Улучшение состояния |
|
Положение, анестезия, BURP |
|
Да |
ILMA, LMA, CT, LT, LT-S |
2 и 3-я попытка оротрахеальной |
|
интубации успешна? |
|
|
Оксигенация возможна? |
Нет |
Нет |
|
|
|
Да |
Интубация показана |
Нет |
|
|
абсолютно? |
Контроль положения трубки |
|
|
|
- ETCO2, SpO2 |
|
- аускультация |
Да
Кониотомия
Если эндотрахеальная интубация Интубация через ILMA возможна? действительно показана: интубация
с помощью бужа, ILMA
Нет
Рисунок 1. Алгоритм дыхательной реанимации
После установки интубационной трубки или альтернативного устройства необходимо проконтролировать правильность их установки. Общая продолжительность процесса обеспечения проходимости дыхательных путей у пациента, которому показана интубация трахеи, даже при развитии осложнений не должна превышать времени индивидуальной гипоксической толерантности пациента.
Литература
1. Benumof JL. Management of the difficult adult airway with special emphasis on awake tracheal intubation. Anesthesiology 1991; 75: 1087-110.
2. Thierbach A, Piepho T, Wolcke B, et al. Erfolgsraten und Komplikationen bei der praklinischen Sicherung der Atemwege. Der Anaesthesist 2004; 53: 543-50.
3. Landsman I. Cricoid pressure indications and complications. Paediatr Anaesth 2004; 14: 43-7.
4. Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Adjuncts for Oxygenation, Ventilation and Airway Control. Circulation 2000; 102:1-95-104.
5. Karch SB, Lewis T, Young S et al. Field intubation of trauma patients. Am J Emerg Med 1996; 14: 617-9.
6. Lawes EG, Baskett PJ. Pulmonary aspiration during unsuccessful cardiopulmonary resuscitation. Intensive Care Med 1987; 13: 379-82. 7. Stone BJ, Chantler PJ, Baskett PJF. The incidence of regurgitation during cardiopulmonary resuscitation: a compari-son between the bag
valve mask and laryngeal mask airway. Resuscitation 1998; 38: 3-6.
8. Wenzel V, Idris AH, Banner MJ et al. Influence of tidal volume on the distribution of gas between the lungs and the stomach in the nonintubated patient receiving positive pressure ventilation. Crit Care Med 1998; 26: 364-8.
9. Dorges V, Ocker H, Hagelberg S, et al. Smaller tidal volumes with room air are not sufficient to ensure adequate oxy-genation during bag-
242 |
Освежающий курс лекций. 11-й выпуск. |
|
|
valve-mask ventilation. Resuscitation 2000; 44: 37^41.
10.Wolcke B, Schneider T, Mauer D, et al. Ventilation volumes with different self-inflating bags with reference to ERC guidelines for airway management: comparison of two compression techniques. Resuscitation 2000; 47: 175-8.
11.Baskettt PJF, Bossaert L, Carli P et al. Guidelines for the advanced management of the airway and ventilation during resuscitation. Resuscitation 1996; 31: 201-30.
12.Gerlach K, Wenzel V, von Knobelsdorff G et al. A new universal laryngoscope blade: a preliminary comparison with Macintosh laryngoscope blades. Resuscitation 2003; 57:63-7. TM
13.Rumball CJ, McDonald D. The PTL, Combitube, laryngeal mask and oral airway: a randomized prehospital com-parative study of ventilatory device effectiveness and cost-effectiveness in 470 cases of cardiorespiratory arrest. Prehosp Emerg Care 1997, 1:1-10.
14.Brain Al, Me Ghee TD, McAteer EJ et al. The laryngeal mask airway. Development and preliminary trials of a new type of airway. Anaethesia 1985; 40: 356-61.
15.Brain Al, Verghese C, Addy EV et al. The intubating laryngeal mask. II: A preliminary clinical report of a new means of intubating the trachea. Br J Anaesth 1997; 79: 704-9.
16.Dorges V, Ocker H, Wenzel V. The laryngeal tube: a new simple airway device. Anesth Analg 2000; 90: 1220-2.
17.Dorges V, Ocker H, Wenzel V. The laryngeal tube S: a modified simple airway device. Anesth Analg 2003; 96: 618-21.
18.Barnes ÒÀ, MacDonald D, Nolan J et al. Gary resuscitation and emergency cardiovascular care. Airway devices. Ann Emerg Med 2001; 37: 145-51.

Раздел 5. Актуальные аспекты респираторной терапии |
243 |
|
|
МОНИТОРИНГ ГАЗООБМЕНА:
ОТ ТЕОРИИ ДО КЛИНИЧЕСКОЙ ПРАКТИКИ
О.Стенквист (Гетеборг, Швеция)
Введение
Газообмен в легких удобно изучать на основании модели, содержащей три условных зоны (компартмента, замкнутых объема) [1]. Первый компартмент находится в идеальных условиях, где вентиляция соответствует перфузии, во второй зоне присутствует перфузия, но отсутствует вентиляция, третий компартмент вентилируется, но без перфузии. Зона с перфузией, но без вентиляции отражает обменные процессы кислорода, а компартмент с вентиляцией, но без перфузии – обмен углекислоты. Соотношение между этими тремя компартментами дает наглядное представление о тяжести патологии в легких (Рис.1). Для того, чтобы получить необходимую информацию нам необходим мониторинг потребления кислорода и выведения двуокиси углерода.
|
ETCO2 3% |
|
|
|
V/Q = 1 |
Идеальные |
|
|
альвеолы |
ADS |
|
6% СО2 |
|
V/Q = ∞ |
V/Q = 0 |
0% СО2 |
|
O2 48% |
SO2 100% |
|
ШУНТ |
||
SvO2 48% |
SvO2 74% |
||
PvCO2 7/53kPa/mmHg |
PaCO |
2 |
6,2/47kPa/mmHg |
|
|
|
|
Рисунок 1. Модель легких с тремя компартментами. Половина объема вентиляции достигает идеальных альвеол, а половина попадает в альвеолярное мертвое пространство (АМП), зону, где отсутствует кровообращение. Половина углекислоты проходит через невентилируемую часть легких, сосудистый шунт, при этом SaO2 на выходе будет соответствовать венозной крови. Другая часть СО2 проходит через вентилируемое легкое, где кровь полностью насыщается кислородом. SaO2 артериальной крови будет составлять (100+48)/2=76 из-за смешивания ее с венозной кровью. Наличие альвеолярного мертвого пространства можно диагностировать на основании разности в артериальном PCO2 (êÏà) è CO2 в конце выдоха (%). СО2 в конце выдоха будет равняться (6+0)/2=3% и артериальная PCO2 составит 6 кПа, что указывает на то, что половина вентилируемого объема не имеет контакта с циркуляцией.
Метаболический газообмен
В нормальных условиях в состоянии покоя потребляется 250 мл/мин кислорода и вырабатывается 200 мл/мин СО2. Отношение выработки СО2 к потреблению кислорода составляет респираторный коэффициент (RQ), переменную, величина которой зависит от энергии используемого источника. Например, при использовании в качестве источника энергии жира RQ составляет 0,7; при использовании углеводов увеличивается до 1,0. Обычно RQ составляет 0,8. Это говорит о том, что в качестве источников энергии используются различные субстраты. Потребление кислорода увеличивается на 7-10% на каждый градус выше 37°С, возрастает при сепсисе и назначении агонистов бета-рецепторов. Седативные и бета-блокаторы уменьшают потребление кислорода. Выход СО2 изменяется аналогичным образом, но значи-
244 |
Освежающий курс лекций. 11-й выпуск. |
|
|
тельно медленнее, чем потребление кислорода в связи с разной степенью депонирования газов. Основные запасы кислорода в организме, способные быстро заменяться, находятся в легких и в виде химического соединения с гемоглобином, что составляет примерно 1 л. Общие запасы углекислоты превышают 100 л, причем в крови содержится лишь малая часть, которая способна быстро заменяться. Основным резервуаром СО2 являются костная и жировая ткань.
Поглощение кислорода (VO2) и выделение углекислоты (VCO2) измеряют методом непрямой колориметрии:
VO2=FiO2 x VI – FEO2 x VE
è
VCO2=FECO2 x VE
ãäå FiO2 – инспираторная фракция кислорода;
FEO2 – смешанная экспираторная фракция кислорода; VI – инспираторная минутная вентиляция;
VE – экспираторная минутная вентиляция;
FECO2 – смешанная экспираторная фракция углекислоты
Между инспираторной и экспираторной минутной вентиляцией существует некоторая разница, возникающая в результате различия между поглощением кислорода и выделением углекислоты. Ее невозможно адекватно рассчитать, но показатель инспираторной минутной вентиляции (VI) можно определить, зная экспираторную минутную вентиляцию (VE), если не принимая при этом в расчет обмен азота посредством трансформации Хальдана. Этот принцип положен в основу автоматического определения в приборах непрямой калориметрии. В отделениях, где нет такой аппаратуры можно воспользоваться оценкой метаболического газообмена по объему выделенного СО2. Это несложно выполнить, присоединив коробку для смешивания газов к выходному отверстию аппарата ИВЛ. Для этого используют обычную негерметичную картонную коробку объемом 5-6 литров. При этом газ способен свободно вытекать из нее в атмосферу. К отверстию забора проб капнографа подсоединяют трехходовой кран, позволяющий осуществлять отбор, либо через Y-образный тройник из дыхательного контура, либо из коробки смешивания газов для определения в ней концентрации СО2. Современные капнографы являются цифровыми приборами с программным обеспечением, позволяющим измерять концентрациию вдыхаемого газа и в конце выдоха. Если концентрация газа, отбираемого из коробки для смешивания, практически постоянна, программе требуется около 30 секунд, чтобы определить и вывести на дисплей показатели стабильной смешанной концентрации углекислоты. VCO2 рассчитывается умножением экспираторной концентрации углекислоты на минутную вентиляцию, отображаемую на экране аппарата ИВЛ. Например, если смешанная экспираторная концентрация СО2 составляет 2,2%, а минутная вентиляция 11 л/мин, то VCO2 будет равняться: 2,2 х 11/100 =0,242 л/мин. Если предположить, что RQ составляет 0,8; следовательно потребление кислорода составит: 0,242/0,8 = 0,303 л/ мин.
В дальнейшем можно рассчитать энергетические затраты (energy expenditure - EE). Известно, что 1 литр потребляемого кислорода равен 4,75 ккал при RQ = 0,8. В этом случае суточные EE будут составлять 0,303 х 60 х 24 х 4,75 = 2513 ккал/24 час.
Содержание кислорода и СО2 в крови
Содержание кислорода в крови включает О2, переносимый гемоглобином (при полном насыщении 1,34 мл/г Hb) и О2 физически растворенный в плазме (0,03 мл/мм рт. ст. или 0,23 мл/кПа). При уровне гемоглобина 150 г/л содержание кислорода равняется 200 мл/л (Hb x 1,34 x Sao2 + PaO2 x 0,03 ãäå Hb â ã/ë, SaO2 â %/100, PaO2 мм рт. ст.). Если минутный объем сердца составляет 5 л/мин, то доставка кислорода будет 1000 мл/мин. Т.к. потребление кислорода в норме составляет 250 мл/мин, в возвращаемой венозной крови будет содержаться 150 мл/л, а сатурация будет равняться 75%. Общая доставка кислорода зависит от

Раздел 5. Актуальные аспекты респираторной терапии |
245 |
|
|
показателей гемоглобина, уровень которого у пациентов ОИТ составляет в среднем 100 г/л. При минутном объеме сердца 5 л/мин она будет всего 667 мл/мин и при равном потреблении О2 конечная сатурация смешанной венозной крови снижается до 63%.
При дыхании атмосферным воздухом напряжение кислорода в артериальной крови составляет примерно 100 мм рт. ст., а в венозной – 40 мм рт. ст., а разница в содержании О2 составит 50 мл/л, что равняется содержанию его в венозной крови около 1 мл/мм рт. ст. (Рис.2).
SO2,% 100
CO2 a-v 50 мл/л
50
PO2 a-v kPa, 60 mmHg
|
|
|
|
|
PO2 |
0 |
|
|
|
|
kPa |
|
|
|
|
||
4,3 |
10 |
13,3 |
mmHg |
||
40 |
75 |
100 |
|
||
Рисунок 2. Кривая диссоциации кислорода. Обратите внимание на выраженную разницу парциального давления О2 в смешанной венозной крови (примерно 60 мм рт. ст. или 9 кПа) в сравнении с СО2.
Содержание окиси углерода в артериальной крови составляет примерно 500 мл/л и 520 мл/ л в смешанной венозной крови при равном парциальном давлении. Однако оно линейно снижается при снижении PCO2. В нормальных условиях в артериальной крови содержится 480 мл/ л. Артериовенозная СО2 разница составляет 40 мл/л, но разница напряжения СО2 в сравнении со смешанной венозной кровью равняется примерно лишь 6 мм рт. ст., в результате чего разница в содержании составляет примерно 7 мм/мм рт. ст. (Рис.3).
мл/л |
|
|
|
смешанная |
|
|
|
|
|
540 |
|
|
|
венозная кровь |
|
|
|
артериальная |
|
CCO2 |
a-v 40мл/л |
|
|
|
|
|
кровь |
||
500 |
|
|
|
|
460 |
|
PCO2 |
a-v 0,7 kPa 5mmHg |
|
|
|
|||
420 |
|
|
|
|
380 |
|
|
|
PCO2 |
|
|
|
|
|
|
|
|
|
kPa |
3 |
4 |
5 |
6 |
mmHg |
22,5 |
30 |
37,5 |
45 |
|
Рисунок 3. Кривая диссоциации углекислоты. Обратите внимание, что разница парциального |
||||
давления СО2 смешанной венозной и артериальной крови невелика <7,5 мм рт. ст. (1 кПа). |
||||

246 |
Освежающий курс лекций. 11-й выпуск. |
|
|
Вентиляция альвеол и мертвого пространства
Расчет альвеолярной вентиляции (alveolar ventilation – VA) производят исходя из величины выделения двуокиси углерода и ее концентрации в конце выдоха.
VA = VCO2/FETCO2
Отношение между вентиляцией мертвого пространства и общей вентиляцией определяют по формуле (PaCO2-PECO2)/PaCO2. В норме оно составляет 0,3, но увеличивается при остром поражении легких (acute lung injury – ALS) и остром респираторном дистресс синдроме взрослых (ARDS). Как невозможно судить о функции обмена кислорода в легких без информации об основных факторах (гемоглобин, минутный объем сердца, метаболизм – функция обмена углекислоты в легких), так и о мертвом пространстве нельзя судить только по вели- чине PaCO2. Для этого необходимо знать содержание углекислоты в конце выдоха и экскрецию СО2. Фракция мертвого пространства имеет два компонента: анатомический и альвеолярный. Альвеолярное мертвое пространство (альвеолы без перфузии) увеличивается при недостаточной перфузии легочных капилляров, а также в определенных участках (вентральных отделах легких) при увеличении внутрилегочного давления с соответственным повышением эндэкспираторного давления. Для определения альвеолярного мертвого пространства нужно знать не только PaCO2 è PECO2, но также эндэкспираторной/альвеолярное PETCO2, которые можно получить при обычной капнографии. Фракция альвеолярного мертвого пространства представляет собой разницу между общим мертвым пространством (PaCO2- PECO2)PaCO2 и анатомическим мертвым пространством (PETCO2-PECO2)/PETCO2 (Ðèñ.4.)
|
|
|
ETCO2 3% |
|
|
|
|
|
|
|
ETCO2 3% |
|
|
||||
|
|
|
|
|
|
|
|
CO |
50% |
|
|
|
|
|
|
|
|
|
|
|
|
|
50% VA |
|
|
|
|
|
|
|
75% VA |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
50% VA |
|
|
|
|
|
|
|
25% VA |
||||
|
|
|
|
|
|
|
|
|
|
Идеальные |
|
|
|||||
|
|
Идеальные |
|
|
|
|
|
|
|
|
|||||||
|
|
альвеолы |
ADS |
|
|
|
|
|
|
альвеолы |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
ADS |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
6% СО2 |
0% СО2 |
|
|
|
|
|
|
4% СО2 |
0% |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
СО2 |
|
|
||
|
PCO2 7/53 |
|
|
PCO |
2 |
|
|
PCO |
2 |
5/38 |
|
PCO |
2 |
|
|||
ШУНТ |
|
6/45 |
|
|
|
|
4/30 |
|
|||||||||
50% |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PvCO |
2 |
|
PaCO |
2 |
|
|
|
PvCO2 |
|
|
|
PaCO |
2 |
|||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
5/38kPa/mmHg |
|
|
|
|
|||||
|
7/53kPa/mmHg |
6,2/47 |
|
|
|
4,2/32 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 4. Эффект альвеолярного мертвого пространства на двуокись углерода. Альвеолярное мертвое пространство (ADS) получает 50% альвеолярной вентиляции (слева). PaCO2 примерно вдвое превышает PACO2. При увеличении легочного кровообращения (справа) за счет увеличения объема и инотропных препаратов ADS сокращается, на данном примере на 25% альвеолярной вентиляции. PaCO2 снижается на 25%, но показатель CO2 в конце выдоха остается неизменным.
Øóíò
Соотношение вентиляция/перфузия находится в функциональной зависимости от уровня гемоглобина, минутного объема сердца и метаболизма, в данном контексте – от потребления кислорода и выделения углекислоты. Например, у пациента с соотношением PaCO2/FiO2 равным 199, что соответствует наличию ARDS согласно определению NAECC (North

Раздел 5. Актуальные аспекты респираторной терапии |
247 |
|
|
American-European Consensus Conference – Североамериканско-Европейская согласительная конференция), величина шунта будет составлять 0,28 при гемоглобине 150 г/л, потреблении кислорода 300 мл/мин и минутном объеме сердца 6 л/мин и FiO2=1,0. У другого пациента с тем же соотношением PaCO2/FiO2 шунт составляет 0,15, т.к. уровень гемоглобина у него был 100 г/л, потребление кислорода 240 мл/мин, минутный объем сердца 4 л/мин и FiO2=0,5. Таким образом, несмотря на то, что соотношение PaO2/FiO2 у пациентов было равным, и его величина соответствовала наличию ARDS, уровень легочной дисфункции у них значительно отличался. У обоих имелась дыхательная недостаточность, но тяжесть патологии в легких на основании соотношения P/F трактовалась неверно. Данные цифры говорят о том, что показатель легочного шунта является более надежным критерием степени нарушения отношения вентиляция/перфузия.
|
|
FiO2 0,5 |
1,0 |
|
|
Идеальные |
|
|
Идеальные |
|
|
альвеолы |
ADS |
альвеолы |
ADS |
||
|
|
|
|
||
45% О2 |
|
|
95% О2 |
|
|
SO2 48% |
|
|
SO2 50% |
|
|
ШУНТ |
|
SO2 100% |
ШУНТ |
|
SO2 100% |
50% |
|
50% |
|
||
|
|
|
|
||
SvO2 48% |
|
SaO2 74% |
SvO2 50% |
|
SaO2 78% |
|
|
||||
|
|
||||
Рисунок 5. Эффект увеличения FiO2 с 0,5 до 1,0 при наличии 50% шунта легочного кровотока. Небольшое увеличение насыщения кислородом артериальной крови является результатом увеличения физически растворенного кислорода в крови, протекающей через вентилируемую зону.
Шунт рассчитывают по стандартной формуле:
(CcapO2 – CaO2)/(CcapO2 – CvO2)
ãäå CcapO2 – содержание кислорода в крови легочных капилляров |
|
CaO2 |
– содержание кислорода в артериальной крови |
CvO2 |
– содержание кислорода в смешанной венозной крови. |
CcapO2 можно точно определить, если предположить, что гемоглобин полностью насыщен. При этом к нему добавить кислород, растворенный в плазме, PAO2 умножить на 0,23 (PAO2(мм рт. ст.), а затем умножить на 0,03 мл (кПа=мм рт. ст./7,5). PAO2 (кПа) в клини- ческих целях можно рассматривать как эквивалент концентрации кислорода (%) в конце выдоха. PaO2 можно рассчитать как вдыхаемую концентрацию кислорода (%) минус концентрацию CO2 в конце выдоха (%). При отсутствии катетера в легочной артерии в качестве относительной замены SvO2 можно предложить показатель содержания кислорода в центральных венах [2,3], однако величину шунта можно также подсчитать с помощью значений по умолчанию для разности содержания кислорода в смешанной венозной крови. Было предложено значение 50 мл, которое соответствовало значениям истинного шунта [4,5] , но у пациентов с гипердинамическим типом кровообращения значение 40 мл, вероятно, следует счи- тать более адекватным (Рис. 5,6,7,8,9 и,10).

248 |
Освежающий курс лекций. 11-й выпуск. |
|
|
|
МОС |
50% |
|
a-v |
50% |
Идеальные |
|
Идеальные |
альвеолы |
ADS |
альвеолы ADS |
|
|
SO2 48% |
|
|
SO2 72% |
|
|
ШУНТ |
|
SO2 100% |
ШУНТ |
|
SO2 100% |
50% |
|
50% |
|
||
|
|
|
|
||
SvO2 48% |
|
SaO2 74% |
SvO2 72% |
|
SaO2 86% |
|
|
||||
|
|
Рисунок 6. Эффект увеличения сердечного выброса у пациентов с 50% шунтом. Отмечается значительное увеличе- ние сатурации с 74 до 86%, т.к. увеличение минутного объема сердца вызывает сокращение артериовенозной разницы по кислороду, что вызывает также увеличение насыщения кислорода в смешанной венозной крови с 48 до 72%.
Hb120  150
150
Идеальные |
Идеальные |
|
альвеолы |
альвеолы |
ADS |
|
ADS |
|
SO2 32% |
|
|
SO2 48% |
|
|
ШУНТ |
|
SO2 100% |
ШУНТ |
|
SO2 100% |
50% |
|
50% |
|
||
|
|
|
|
||
SvO2 32% |
|
SaO2 66% |
SvO2 48% |
|
SaO2 74% |
|
|
||||
|
|
Рисунок 7. Эффект увеличения концентрации гемоглобина у пациента с 50% шунтом. Увеличение сатурации явилось результатом снижения артериовенозной разницы по кислороду вследствие увеличения уровня гемоглобина.

Раздел 4. Вопросы интенсивной терапии |
249 |
|
|
ОКИСЬ АЗОТА
Идеальные |
Идеальные |
|
альвеолы |
альвеолы |
ADS |
|
ADS |
|
NO
SO2 48% |
|
|
SO2 64% |
|
|
ШУНТ |
|
SO2 100% |
ШУНТ |
|
SO2 100% |
50% |
|
25% |
|
||
|
|
|
|
||
SvO2 48% |
|
SaO2 74% |
SvO2 64% |
|
SaO2 91% |
|
|
||||
|
|
Рисунок 8. Эффект ингаляции окиси азота у пациента с 50% шунтом. Заметное увеличение артериальной сатурации кислорода явилось результатом селективной дилятации легочных сосудов в вентилируемых зонах легких, которые вызывают отток крови от зоны шунта к вентилируемым участкам.
Идеальные
альвеолы
ADS
VO2 50% a-v 50%
Идеальные альвеолы ADS
NO
SO2 48% |
|
|
SO2 72% |
|
|
ШУНТ |
|
SO2 100% |
ШУНТ |
|
SO2 100% |
50% |
|
50% |
|
||
|
|
|
|
||
SvO2 48% |
|
SaO2 74% |
SvO2 72% |
|
SaO2 86% |
|
|
||||
|
|
Рисунок 9. Эффект снижения соотношения метаболизм/потребление кислорода у пациента с 50% шунтом. Значи- тельное увеличение сатурации кислорода явилось результатом уменьшения артериовенозной разницы при снижении отдачи кислорода тканям.

250 |
Освежающий курс лекций. 11-й выпуск |
|
|
|
|
Рекрутмент |
|
Идеальные |
|
+ |
|
ADS |
ПДКВ |
||
альвеолы |
|||
|
|
Идеальные альвеолы ADS
NO
SO2 48% |
|
|
SO2 64% |
|
|
ШУНТ |
|
SO2 100% |
ШУНТ |
|
SO2 100% |
50% |
|
25% |
|
||
|
|
|
|
||
SvO2 48% |
|
SaO2 74% |
SvO2 64% |
|
SaO2 91% |
|
|
||||
|
|
Рисунок 10. Эффект маневра рекрутмента и последующего увеличения ПДКВ у пациента с 50% шунтом. Маневр рекрутмента раскрывает коллабированное легкое и количество невентилируемых зон уменьшается. Артериальное насыщение кислорода существенно возрастает.
Литература
1. Riley RL CA, Donald KW: Factors affecting partial pressures of O2 and CO2 in gas and blood of lung: Methods. J Appl Physiol 1951, 4: 102-120 2. Ladakis C, Myrianhefs P, Karabinis A, Karatzas G: Central venous and mixed venous oxygen saturation in critically ill patient.
Respiration 2001, 68: 279-85
3. Rivers EP, Ander DS, Powell D: Central venous oxygen saturation monitoring in the critically ill patient. Curr Opin Crit Care 2001, 7: 204-11 4. Zetterstrom H: Assessment of the efficiency of pulmonary oxygenation. The choice of oxygenation index. Acta Anaesthesiol Scand
1988, 32: 579-84
5. Benatar SR, Hewlett AM, Nunn JF: The use of iso-shunt lines for control of oxigen therapy. Br J Anaesth 1973, 45:: 711-8
