
RCL_11
.pdfРаздел 4. Вопросы интенсивной терапии |
211 |
|
|
у тех, кому она не проводилась, и все же отмечена тенденция к низкой выживаемости у пациентов, не подвергшихся гемотрансфузии.
Интересно отметить, что наибольшим отличием между двумя европейскими исследованиями (SOAP и ABC) было то, что уменьшение количества лейкоцитов отмечено достоверно чаще в первом, нежели во втором. Таким образом, противоречащие результаты этих двух исследований могут наводить на мысль о возможной роли лейкоцитов в патогенезе неблагоприятного клинического исхода после гемотрансфузии.
5. Толерантность к анемии – гемотрансфузия у пациентов группы риска
В последних рекомендациях уровень гемоглобина, при котором необходимо проводить гемотрансфузию, считают ≤60 г/л [10]. При уровне гемоглобина от 60 до 100 г/л необходимо индивидуально подходить к гемотрансфузии, с учетом степени риска возникновения осложнений у данного пациента [10]. Пациенты с сопутствующими сердечно-сосудистыми заболеваниями (ССЗ) находятся в группе повышенного риска, например, при патологии коронарных артерий невозможно адекватное повышение коронарного кровотока в ответ на снижение концентрации гемоглобина, в результате чего может развиться ишемия участка миокарда. В дополнение к этому, нарушенная сократимость миокарда может ограничивать компенсаторное повышение СВ. Ретроспективное когортное исследование у 1958 пациентов, отказавшихся от проведения гемотрансфузий по религиозным соображениям, подтвердило эту гипотезу [11]. Было обнаружено, что чем ниже уровень исходного гемоглобина относительно цифры 100-110 г/л, тем выше смертность как у больных с ССЗ, так и без них, однако наиболее сильно эта тенденция прослеживается в группе с ССЗ.
При анализе влияния уровня анемии и стратегии гемотрансфузии на смертность, Hebert и соавт. обнаружили связь между уровнем анемии и риском смерти у критических больных с заболеваниями сердечно-сосудистой системы. Была установлено, что у пациентов с высоким уровнем гемоглобина выживаемость лучше. Однако субгрупповой анализ в исследовании TRICC у пациентов с ССЗ не выявил каких-либо различий в уровне смертности между группами ограниченной и неограниченной инфузии [12]. Хотя авторы были осведомлены о возможных ограничениях данного анализа, они считали уровень гемоглобина, равный 70 г/л, безопасным для пациента с заболеваниями сердечно-сосудистой системы [12]. Исключение составляли лишь пациенты с острым коронарным синдромом и нестабильной стенокардией. В одном из недавно проведенных исследований было показано, что гемотрансфузия у пациентов с острым коронарным синдромом и уровнем гематокрита от 20 до 25% (или концентрацией гемоглобина от 70 до 80 г/л, соответственно) не приводит к увеличению 30дневной летальности в сравнении с пациентами, у которых гемотрансфузия не проводилась [13]. Интересно, что проведение гемотрансфузии приводит к возрастанию 30-дневной летальности у пациентов с острым коронарным синдромом и уровнем гематокрита 30% (или концентрацией гемоглобина ≥100 г/л, соответственно), в сравнении с пациентами, не получавшими гемотрансфузию. Тем не менее, как и у пациентов без сопутствующих заболеваний, основными критериями целесообразности проведения гемотрансфузии должны быть клинические признаки неадекватной оксигенации тканей [10,14]. У пациентов с ССЗ появление депрессии сегмента ST > 0,1 mV либо его элевации > 0,2 mV или выявление новых аномалий движения стенки сердца при трансэзофагеальной эхокардиографии могут быть достоверными критериями неадекватной оксигенации миокарда [14]. Важно помнить, что миокардиальная ишемия, связанная с гемодилюцией, обратима за счет небольшого повышения концентрации гемоглобина или повышения ЧСС.
Осложнения, связанные с гемотрансфузией
Все осложнения, связанные с гемотрансфузией, могут быть разделены на инфекционные, иммунологические осложнения и переливание несовместимой крови.

212 |
Освежающий курс лекций. 11-й выпуск |
|
|
1. Инфекционные осложнения
Гемотрансфузии, проводимые в западных странах, в настоящее время более безопасны, нежели ранее, несмотря на сохраняющуюся опасность передачи при гемотрансфузии вирусов гепатита, таких как HIV, HBV, HCV [15]. Риск инфекционных осложнений имеет тенденцию к снижению, в первую очередь, благодаря возрастающей чувствительности различных тестов, позволяющих выявить наличие вируса в компонентах красной крови. Примерная оценка риска представлена в таблице 1.
Таблица 1. Осложнения, связанные с гемотрансфузией (с модификациями [15])
Вид осложнения |
Оценка степени риска (частота возникновения |
|
|
инфекции на единицу населения) |
|
|
|
|
|
Индекс развития (ИР) |
|
Инфекции |
Высокоразвитые страны |
Развивающиеся страны |
Вирусные |
|
|
ÂÈ× |
1:1.486.000-1:4.700.000 |
1:50-1:2578 |
Вирус гепатита В |
1:31.000-1:205.000 |
1:74-1:1000 |
Вирус гепатита С |
1:1.935.000-1:3.100.000 |
1:2578 |
Бактериальные |
1:2.000-1:8.000 (ïóë |
|
|
тромбоцитов)/1:28.000- |
|
Паразитарные |
1:143.000 (эритроциты) |
? |
|
|
|
Малярия |
1:4.000.000 |
Около 1:3 |
Прион |
|
|
Вариант болезни |
Описано 2 возможных |
|
Крейтцфильда-Якоба |
случая переноса |
? |
Иммунологические реакции |
|
|
Гемолитические реакции |
|
|
Острые |
1:13.000 |
? |
Замедленные |
1:9.000 |
? |
Аллоиммунизация |
1:1.600 |
? |
Аутоиммунизация |
? |
? |
Иммуносупрессия |
1:0.1 |
? |
ОПЛ, связанное |
1:70.000 |
? |
с гемотрансфузией |
|
|
Переливание несовместимой |
1:14.000-1:18.000 |
? |
крови |
|
|
В противоположность западным странам, вирусные инфекционные осложнения остаются основной проблемой развивающихся стран (индекс развития, базирующийся на средней продолжительности жизни, уровне грамотности, проценте учащихся в средних учебных заведениях, доходе на душу населения) (см. табл.1). Высокая частота встречаемости этих заболеваний в общей популяции этих стран, плохо организованная система донорства, плохая диагностика этих заболеваний становятся определяющими факторами [15]. По сравнению с вирусными заболеваниями в западных (высокоразвитых) странах остается достаточно высокий процент осложнений, связанных с бактериальными инфекциями и посттрансфузионным сепсисом [16]. Наиболее часто встречается заражение пула тромбоцитов, нежели переливание зараженной бактериями крови.
Раздел 4. Вопросы интенсивной терапии |
213 |
|
|
Недавно был описан случай гемотрансфузионного переноса варианта болезни Крейтцфельда-Якоба (вБКЯ) [17,18]. Вероятность того, что данный случай связан не с гемотрансфузионным переносом данного заболевания, равен примерно 1:15,000- 1:30,000. Гипотетический инкубационный период этой болезни равен 6,5 лет [17]. 2 случай, отмеченный в Великобритании, мог быть следствием переливания зараженной крови, заготовленной в 1999 г [18]. Этот пациент умер от причины, не связанной с вБКЯ. Как и в первом случае, пациенту перелили эритроцитарную массу, не обедненную лейкоцитами, от донора, у которого после сдачи крови развились симптомы данного заболевания. Вскрытие показало наличие протеина прионов в селезенке пациента и шейных лимфоузлах, но не в лимфоидной ткани кишечника и миндалин, которые, как предполагалось, могли быть источником для передачи инфекции [18].
Принимая во внимание инкубационный период (6,5 лет), установленный после первого случая заражения, отсутствие симптоматики при таком длинном периоде инкубации наводит на мысль о возможности ятрогенного инфицирования крови или контаминирования хирургического инструментария [18]. Интересно, что обеднение крови лейкоцитами способно эффективно снизить частоту переноса многих заболеваний, но неспособно предотвратить зависимый от клеток белой крови перенос губчатой энцефалопатии (ГЭ) [19]. По всей видимости, за перенос ГЭ ответственна также и плазма крови [19]. Таким образом, методика обеднения крови лейкоцитами как способ борьбы с переносом инфекции должна подвергнуться пересмотру.
2. Иммунологические осложнения
В противоположность развивающимся странам, где преимущественно встречаются инфекционные осложнения, иммунологические осложнения более характерны для стран высокоразвитых [15] (см. табл.1). Гемотрансфузия, среди прочих, обладает еще и иммуномодулирующим эффектом, механизм которого остается до сих пор не совсем ясным. Хотя некоторые исследования и показали, что клетки белой крови способны вызвать данный эффект, компоненты крови, выступающие медиаторами, пока неизвестны.
3. Переливание несовместимой крови
Данное осложнение встречается с частотой 1:14,000-1:18,000 и это одно из самых опасных осложнений [20]. Это одна из наиболее частых причин высокой заболеваемости и смертности.
Практические рекомендации
Показания для гемотрансфузии, основанные на концентрации гемоглобина, в настоящее время не принимаются во внимание из-за индивидуальных особенностей каждого человека приспосабливаться к анемии. Соответствующие практические рекомендации должны быть основаны на оценке физиологических параметров, тогда как уровень гемоглобина должен служить основным критерием только в той ситуации, когда невозможно оценить региональную или глобальную степень оксигенации тканей пациента. Перед оценкой физиологических параметров очень важно компенсировать гиповолемию, оптимизировать анестезиологическое пособие и, если необходимо, купировать исходно существующую анемию. Те физиологические параметры, которые описывают региональную или глобальную степень оксигенации тканей пациента, суммированы в таблице 2.
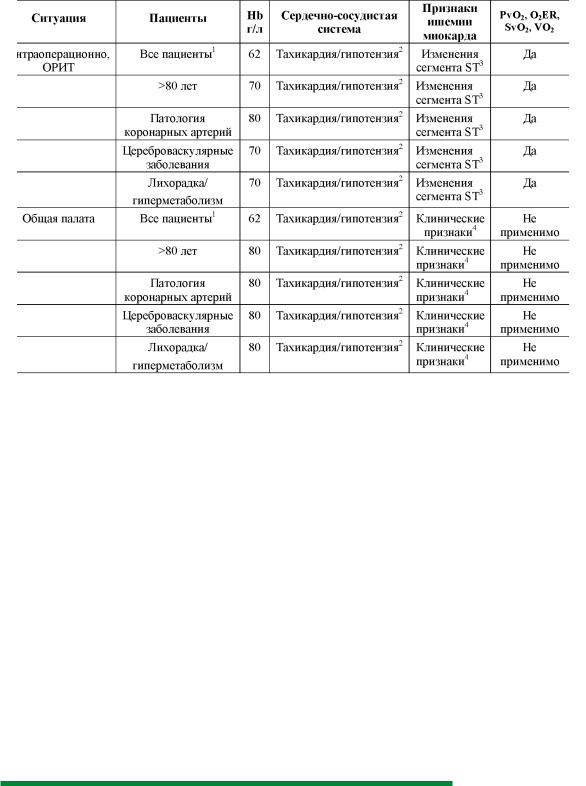
214 |
Освежающий курс лекций. 11-й выпуск |
|
|
Таблица2. Концентрация гемоглобина и физиологические параметры пациента, определяющие необходимость проведения гемотрансфузии (с модификациями [15])
1 – включая всех пациентов. Исключение – пациенты старше 80 лет, пациенты с патологией коронарных артерий, с цереброваскулярными заболеваниями и пациенты с лихорадкой/гиперметаболизмом 2 – относительная тахикардия с ЧСС >120-130% от исходного уровня или > 110-130 уд/
мин, относительная гипотензия с уровнем АДñð< 70-80% от исходного уровня или <60 мм.рт.ст. (<55 мм.рт.ст. у молодых и здоровых пациентов, <70-80 мм.рт.ст. у пациентов с патологией коронарных сосудов, цереброваскулярными заболеваниями, у пациентов с исходной гипертензией или выше у пациентов с очень высокими исходными цифрами АД)
3- депрессия сегмента ST> 0,1 mV или элевация сегмента ST> 0,1 mV 4- подтвержденная ЭКГ и/или анализом уровня тропонина
Гемотрансфузия показана, если доступен один из перечисленных критериев: пороговое значение Hb, критерии со стороны сердечно-сосудистой системы, миокардиальная ишемия или один из параметров оксигенации (PvO2, O2ER, SvO2, VO2). Для всех физиологических параметров необходимо наличие у пациента нормоволемии, оптимизации анестезиологического пособия и купирование тахикардии, а анемия должна рассматриваться как одна из возможных причин.
Литература
1. Meier J, Kemming GI, Kisch-Wedel H, Wolkhammer S, Habler OP. Hyperoxic ventilation reduces 6-hour mortality at the critical hemoglobin concentration/ Anesthesiology 2004;100:70-6.
2. Morisaki H, Sibbald WJ. Tissue oxygenation delivery and the microcirculation. Crit Care Clin 2004;20:213-23.
3. Hebert PC, McDonald BJ, Tinmouth A. Clinical consequences of anemia and red cell transfusion in the critically ill. Crit Care Clin 2004;20:225-35.
4. Sehgal LR, Zebala LP, Takagi I, Curran RD, Votapka TV, Caprini JA. Evaluation of oxygen extraction ratio as a physiological transfusion trigger in coronary artery bypass graft surgery patients. Transfusion 2001;41:591-5.
5. Hebert PC, Wells G, Blajchman MA, Marshall J, Martin C, Pagliarello G, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999;340:409-17.
6. Carson JL, Hill S, Carless P, Hebert P, Henry D. Transfusion triggers: a systematic review of the literature. Transfus Med Rev 2002;16:187-99.
7. Corwin HL, Gettinger A, Pearl RG, Fink MP, Levy MM, Abraham E, et al. The CRIT Study: Anemia and blood transfusion in the critically
Раздел 4. Вопросы интенсивной терапии |
215 |
|
|
ill - Current clinical practice in the United States. Crit Care Med 2004;32:39-52.
8. Vincent JL, Baron JF, Reinhart K, Gattinoni L, Thijs L, Webb A, et al. Anemia and blood transfusion in critically ill patients. JAMA 2002;288:1499-507.
9. Vincent JL, Sakr Y, LeGall JR, Gerlach H, Reinhart K, Sprung C, et al. Is Red Blood Cell Transfusion Associated with Worse Outcome? Results of the SOAP Study. Chest 2003;124:125S-126S.
10.Practice Guidelines for blood component therapy: A report by the American Society of Anesthesiologists Task Force On Blood Component Therapy. Anesthesiology 1996;84:732-47.
11.Carson JL, Duff A, Poses RM, Berlin JA, Spence RK, Trout R, et al. Effect of anemia and cardiovascular disease on surgical mortality and morbidity. Lancet 1996;348:1055-60.
12.Hebert PC, Yetisir E, Martin C, Blajchman MA, Wells G, Marshall J, et al. Is a low transfusion threshold safe in critically ill patients with cardiovascular diseases? Crit Care Med 2001;29:227-34.
13.Rao SV, Jollis JG, Harrington RA, Granger CB, Newby LK, Armstrong PW, et al. Relationship of blood transfusion and clinical outcomes in patients with acute coronary syndromes. JAMA 2004;292:1555-62.
14.Spahn DR, Dettori N, Kocian R, Chassot PG. Transfusion in the cardiac patients. Crit Care Clin 2004;20:269-79.
15.Marcucci C, Madjdpour C, Spahn DR. Allogenic blood transfusions: benefit, risks and clinical indications in countries with a low or high human development index. Br Med Bull 2004;70:15-28.
16.Wagner SJ. Transfusion-transmitted bacterial infection: risks, sources and interventions. Vox Sang 2004;363:417-21.
17.Llewelyn CA, Hewitt PE, Knight RS, Amar k, Cousens S, Mackenzie J, et al. Possible transmission of variant Creutzfeldt-Jakob disease by blood transfusion. Lancet 2004;363:417-21.
18.Peden AH, Head MW, Ritchie DL, Bell JE, Ironside JW. Preclinical vCJD after blood transfusion in a PRNP codon 129 heterozygous patient. Lancet 2004;364:527-9.
19.Gregori L, McCombie N, Palmer D, Birch P, Sowemimo-Coker SO, Guilivi A, et al. Effectiveness of leucoreduction for removal of infectivity of transmissible spongiform encephalopathies from blood. Lancet 2004;364:529-31.
20.Kleinman S, Chan P, Robillard P. Risks associated with transfusion of cellular blood components in Canada. Transfuse Med Rev 2003;17:120-62.

216 |
Освежающий курс лекций. 11-й выпуск |
|
|
ГОРМОНАЛЬНАЯ ТЕРАПИЯ СЕПТИЧЕСКОГО ШОКА.
Х.Герлах (Берлин, Германия)
Введение.
Надпочечники является важным эндокринным органом, который помогает организму противодействовать факторам, влияющим на целостность организма, как остро, так и в течение длительного времени. При реализации ответа на стресс, центральная нервная система (ЦНС) инициирует активацию как симпатоадреналовой системы (САС), что приводит к высвобождению катехоламинов, так и гипоталамо-гипофизарной системы (ГГС), способствуя выделению стероидных гормонов (глюко- и минералокортикиоды). Все это способствует поддержанию гомеостаза путем воздействия на метаболические, иммунологические, кардиоваскулярные и эндокринные функции. В этом контексте надпочечники играют ключевую роль, способствуя синтезу и экспрессии катехоламинов, глюкокортикоидов (ГК), а также андрогенных гормонов и компонентов ренин-ангиотензин-альдостероновой системы (РАА).
Острые и хронические воспалительные заболевания стимулируют активацию ГГС через иммунную систему, тем самым приводя к морфологическим и функциональным изменениям, особенно в коре надпочечников. Этот феномен исходно был описан при острых инфекционных заболеваниях, но он также имеет место при тяжелом сепсисе и септическом шоке. Однако, у пациентов с септическим шоком негативные результаты исследований применения высоких доз ГК в последние годы способствовали некоторому скептицизму в отношении данного метода. Однако в исследованиях с использованием низких доз ГК у пациентов с септическим шоком были получены положительные результаты. До сих пор остается нерешенным вопрос о том, у каких пациентов данная терапия наиболее эффективна, а также как распознать и оценить нарушения со стороны надпочечников.
Физиология гипоталамо-гипофизарно-адреналовой системы.
Надпочечники являются частью системы, синтезирующей взаимодействующие гормоны для поддержания физиологической целостности организма, особенно во время стресса [1]. Эта система называется гипоталамо-гипофизарно-адреналовая (ГГА) и состоит из гипоталамической зоны, где образуются рилизинг-гормоны, способствующие высвобождению кортикотропина из гипофиза. Передний гипофиз секретирует кортикотропин (КТ) в результате воздействия на него рилизинг-гормона. КТ, в свою очередь, стимулирует синтез и выделение глюкокортикоидов, минералокортикоидов и андрогенов из надпочечников.
ГГА система запускается не только физическим или физиологическим стрессом, но также и пептидами, такими как антидиуретический гормон (АДГ) и цитокины. Таким образом, эта система играет важную роль во время инфекций и иммунологических нарушений [2]. Вполне возможно, что ГГА система является самым важным компонентом в ответе на стресс, благодаря ее взаимодействию с ренин-ангиотензин-альдостероновой системой (РААС), регулирующей водно-электролитный баланс, с синтезом андрогенов, влияющих на механизмы иммуномодуляции и симпатоадреналовой системой. Активация иммунной системы при инфекционных заболеваниях стимулирует высвобождение провоспалительных цитокинов, таких как фактор некроза опухоли (ФНО-б), интерлейкин (ИЛ) - 1в или ИЛ-6. Эти цитокины стимулируют как гипоталамус, так и передний гипофиз, что в конечном итоге приводит к высвобождению глюкокортикоидов. ИЛ-6 способен непосредственно влиять на выделение стероидов из надпочечников. В условиях острого инфекционного процесса это способствует поддержанию метаболической и энергетической ценности. Когда процесс переходит в хрони- ческий, ГГА система адаптируется к постоянному стрессу. Это проявляется типичными клиническими признаками, такими как гиперкатаболическое состояние, гипергликемия, подавление синтеза андрогенов, гормона роста и тиреоидных гормонов. Все эти изменения могут

Раздел 4. Вопросы интенсивной терапии |
217 |
|
|
увеличить риск возникновения вторичной инфекции. Повышенный уровень кортизола подавляет высшие регуляторные центры ГГА системы через механизм отрицательной обратной связи. Поэтому высокая концентрация кортизола и низкая концентрация кортикотропина часто обнаруживаются у пациентов после обширных оперативных вмешательств, а также на фоне тяжелого сепсиса или септического шока. Даже назначение дексаметазона или рили- зинг-гормона не способно подавить возросшую концентрацию кортизола у данной категории пациентов [3]. Этот феномен заставляет нас задуматься о том, что вызывает высвобождение кортизола. Некоторые исследования демонстрируют, что синтез кортизола у критических больных регулируется не кортикотропином, а паракринными путями через эндотелин, предсердный натрийуретический пептид (ПНП) или цитокины, такие как ИЛ-6 [4]. ИЛ-6 напрямую влияет на кору надпочечников, что способствует высвобождению кортизола, причем, чем дольше продолжается это воздействие, тем хуже становится прогноз.
Относительная надпочечниковая недостаточность.
Классическая форма надпочечниковой недостаточности (НН), которая приводит к абсолютной стероидной недостаточности, среди критических пациентов встречается достаточно редко (0-3%) [5]. Вместо этого она характеризуется морфологическими изменениями в ГГА системе. Для отражения того, что субнормальная продукция кортикостероидов надпочечниками может иметь место во время острого заболевания без очевидных структурных дефектов в ГГА системе, был использован термин, отражающий дисрегуляцию в данной системе – функциональная надпочечниковая недостаточность (ФНН) [6]. ФНН может развиться во время заболевания и, как правило, кратковременна [7]. У критических больных часто наблюдается снижение уровня глюкокортикоидов, которое может быть довольно значимым при его возникновении у здоровых людей, однако на фоне стресса, когда потребность в гормонах повышена, данное снижение не играет столь значимой роли. Тем не менее, оно может приводить к развитию относительной надпочечниковой недостаточности (ОНН). Главной причи- ной возникновения ОНН является неадекватный синтез кортизола в результате клеточной дисфункции. В отличие от абсолютной надпочечниковой недостаточности морфологические изменения при ОНН могут быть минимальны, они характеризуются клеточной гиперплазией коры надпочечников. Эти изменения часто сочетаются с резистентностью клеток-мишеней к глюкокортикоидам, что может быть вызвано воспалением и ухудшает течение болезни, хотя, абсолютный уровень кортизола сыворотки может быть нормальным [8].
При септическом шоке ОНН может быть следствием нарушения выделения кортикотропина, ослабляя ответ надпочечников на этот гормон и приводя к снижению синтеза кортизола [7]. Кроме того, может наблюдаться уменьшение транспорта кортизола к точкам приложения, а также ухудшение реакции на кортизол на тканевом уровне. Данный феномен происходит в результате воздействия цитокинов, которые модулируют аффинность рецепторов к кортизолу и/ или глюкокортикоидам [9]. В клинических исследованиях было продемонстрировано, что длительное лечение системной воспалительной реакции у пациентов с ОРДС с помощью метилпреднизолона способствует улучшению ответа на глюкокортикоиды (ГК) путем увеличения аффинности ГК рецепторов и снижению опосредованной NF-кB связывания и транскрипции провоспалительных цитокинов [10]. Таким образом, при верифицированной ОНН гормональная терапия даст хороший результат [7]. Частота встречаемости ОНН среди критических больных варьирует от 0 до 0,77%, увеличиваясь до 50-75% у больных с септическим шоком [7, 11].
Оценка надпочечниковой недостаточности.
У критических пациентов этиология развития абсолютной или относительной надпочечниковой недостаточности многообразна, поэтому первопричину часто невозможно найти. Септический шок или любое другое угрожающее жизни состояние с повышенной потребностью к катехоламинам должно требовать оценки состояния функции надпочечников. Ранее для постановки диагноза было достаточно уровня кортизола <20 мкг/дл. Подтверждено, что раз-

218 |
Освежающий курс лекций. 11-й выпуск |
|
|
личные факторы влияют на исследование ГГА системы у критических больных. При условии доступности у критических больных для выявления надпочечниковой недостаточности можно использовать краткосрочный кортикотропиновый тест. ОНН присутствует у большинства критических больных, особенно у больных с тяжелым сепсисом и септическим шоком. Однако четкого определения ОНН до сих пор нет, это полиэтиологичное состояние, поэтому достаточно сложно определить как базальную плазменную концентрацию кортизола, так и увеличение концентрации после кортикотропинового теста. Принимая во внимание свободный кортизол или увеличение концентрации свободного кортизола после теста, мы должны более аккуратно проводить и интерпретировать результаты функциональных тестов надпо- чечников [9]. Следует помнить, что экстраполяция данных, полученных от здоровых пациентов или пациентов с недостаточностью ГГА системы, может быть неверной, так как у пациентов с септическим шоком нормальная или повышенная концентрация кортизола может быть отражением неадекватного ответа надпочечников на стресс. На большой группе пациентов, используя ROC-анализ, была достигнута высокая чувствительность (68%) и специфичность (65%) для опорного значения <9 мкг/дл (возрастающий прирост) для определения нечувствительных пациентов [11]. Базальный уровень кортизола, равный 34 мкг/дл и последующее возрастание на 9 мкг/дл после стимуляции было лучшим критерием различия выживших и умерших. Чем выше был базальный уровень кортизола, и чем слабее ответ на стимуляцию, тем выше была вероятность летального исхода.
Заместительная гормонотерапия у пациентов с септическим шоком.
У пациентов с тяжелым сепсисом и септическим шоком течение заболевания индивидуально. Трудно определить как первичный источник, так и иммунологические факторы (цитокины), способствующие поражению ГГА системы. В раннюю фазу септического шока выделение кортизола надпочечниками может восстановиться, что приведет к развитию ОНН с абсолютным уровнем стероидов, близким к норме или даже превышающим ее. При рефрактерном септическом шоке частота ОНН может достигать 50-75% [11]. Тем не менее, динамические тесты до сих пор недоступны в ОРИТ, что делает сложным принятие решения о необходимости начала заместительной гормонотерапии, а решение должно быть принято через часы после начала развития септического шока для улучшения прогноза.
Логическим обоснованием применения высоких доз кортикостероидов при инфекционных процессах, сепсисе и септическом шоке служит факт наличия у них противовоспалительных свойств и влияния на гемодинамику. Предполагаемые защитные механизмы включают в себя улучшение гемодинамики, метаболической, эндокринной функции, а также функционирование фагоцитов, что приводит к сохранению нормального функционирования тканей мозга, сердца, почек, надпочечников. Кроме того, доказана способность глюкокортикоидов ингибировать ключевые механизмы воспаления: активацию эндотелиоцитов и их повреждение, капиллярную утечку, активацию гранулоцитов, адгезию и агрегацию, активацию системы комплемента, образование и высвобождение метаболитов эйкозаноидов, свободных кислородных радикалов и лизосомальных ферментов [12].
Проспективное исследование, в которое за восьмилетний период было включено 179 пациентов с септическим шоком, оценивало эффективность высоких доз ГКС. Были использованы высокие дозы метилпреднизолона (30-60 мг/кг) или дексаметазона (2-4 мг/кг), что привело к снижению летальности с 38% до 10% [13]. Другое исследование доказало, что увеличение времени лечения дает положительные результаты. Уменьшение выраженности септического шока и увеличение выживаемости наблюдается уже после болюсного назначения ГКС на ранних стадиях заболевания, но этот эффект исчезает спустя несколько дней [14]. Два мета-анали- за пациентов с тяжелым сепсисом или септическим шоком, получавших ГКС в дозе, эквивалентной 42 г гидрокортизона, обнаружили, что высокие дозы ГКС неэффективны [15] или вредны [16]. Это было подтверждено большим рандомизированным исследованием, проведенном в 1987 г. [17]. В одном исследовании было доказано, что применение ГКС ухудшает исход. При-
Раздел 4. Вопросы интенсивной терапии |
219 |
|
|
менение высоких доз ГКС ассоциируется с увеличением риска возникновения вторичной инфекции, увеличением летальности и возрастанием случаев возникновения почечной и печеноч- ной дисфункции [16]. Кроме того, применение высоких доз ГКС не подтвердило своей эффективности при септическом шоке, что, скорее всего, связано с угнетением иммунной системы.
Несколько рандомизированных контролированных исследований, в которых использовались низкие дозы ГКС у пациентов с септическим шоком, продемонстрировали уменьшение выраженности шока и снижение доз симпатомиметиков через несколько дней после начала терапии у большинства пациентов [18-20]. В похожем исследовании, при использовании низких доз ГКС отмечалось повышение среднего артериального давления, общего перифери- ческого сосудистого сопротивления, ЧСС, сердечного индекса, а также значительное уменьшение дозы норадреналина [21]. После прекращения использования гидрокортизона отмеча- лась обратимость всех вышеперечисленных изменений. В некоторых исследованиях отме- чали, что кортикостероид-индуцированное возрастание чувствительности к норадреналину более характерно для пациентов с ОНН, чем для пациентов без нее [22]. Существует несколько механизмов, через которые кортикостероиды могут модулировать сосудистый тонус. Доказанный факт, что цитокин-индуцированное образование оксида азота (NO) играет центральную роль в развитии вазодилатации, устойчивости к катехоламинам, перераспределению кровотока, митохондриальной и органной дисфункции, и количество образованного оксида азота коррелирует с тяжестью шока и исходом заболевания [23]. В вышеупомянутом исследовании доза норадреналина уменьшилась на фоне назначения низких доз ГКС практи- чески у всех пациентов за 1-2 дня. Терапия гидрокортизоном также вызвала выраженное и длительное падение уровня нитратов/нитритов, что отчетливо коррелирует с уменьшением дозы норадреналина во время инфузии ГКС [2]. Подводя итог, можно предположить, что оксид азота – это не единственная точка приложения ГКС, однако именно ингибирование гидрокортизоном синтеза NO приводит к уменьшению выраженности шока.
Установлено, что ГКС модулируют стрессовый ответ различными способами, которые включают не только противовоспалительное и иммуносупрессивное действие, способствующие защите организма от чрезмерной воспалительной реакции, но и улучшение иммунного ответа. Эффективность ГКС зависит от многих факторов: доза, тип клеток или ткани, время действия, баланс про- и противовоспалительных факторов. В конечном итоге, ГКС значи- тельно уменьшают воспалительную и противовоспалительную реакции, количество гранулоцитов, моноцитов, активность эндотелия. В заключение следует напомнить, что иммунные эффекты низких доз ГКС могут характеризоваться как иммуномодуляцией, так и иммуносупрессией. Уменьшение выраженности воспаления без значительной иммуносупрессии может быть обнадеживающим результатом, который ведет к стабилизации гемодинамики.
Хотя данные об исходах заболевания при использовании низких доз ГКС у пациентов с септическим шоком ограничены, считается, что назначение до 300 мг гидрокортизона в день улучшает выживаемость. В большинстве исследований, где были использованы низкие дозы ГКС [18-20], 28-дневная летальность была ниже, чем у пациентов, получавших высокие дозы ГКС, где значительного эффекта отмечено не было. В мультицентровом исследовании 300 человек с рефрактерным септическим шоком выживаемость была выше у пациентов с ОНН [20]. Подобные результаты были получены при анализе госпитальной летальности и летальности в ОРИТ, но не при анализе одногодичной летальности.
В настоящий момент ни одного случая серьезных осложнений при терапии низкими дозами ГКС отмечено не было. Частота возникновения желудочно-кишечных кровотечений, суперинфекции или гипергликемии не отличалась у пациентов, получавших низкие дозы ГКС и плацебо, а частота возникновения раневой инфекции была ниже в группе пациентов, получавших ГКС [20]. При терапии гидрокортизоном возможно возникновение гипернатриемии > 155 ммоль/л, которая преимущественно встречается при продолжительном лечении [19]. Тем не

220 |
Освежающий курс лекций. 11-й выпуск |
|
|
менее, при назначении низких доз ГКС должен быть учтен возможный риск возникновения осложнений, а сам курс терапии должен быть как можно короче.
Дозы гидрокортизона, применяемые при септическом шоке, похожи на дозировки, применяемые при надпочечниковой недостаточности (100 мг болюс, затем от 200 до 300 мг ежедневно), с постепенным снижением дозировок по мере стабилизации состояния пациента. Предпочтительнее использовать гидрокортизон, хотя сравнительные исследования эффективности ГКС при септическом шоке не проводились с тех пор, как был доказан благоприятный эффект низких доз ГКС. К тому же, гидрокортизон является синтезированным эквивалентом физиологически активного кортизола, таким образом, терапия гидрокортизоном является заместительной. В отличие от дексаметазона, гидрокортизон обладает собственной внутренней минералокортикоидной активностью. Применение флюдрокортизона может быть оправдано в случае необходимости использования ГКС без минералокортикоидной активности.
Не установлено, предпочтительнее ли расчет дозы на килограмм веса тела (т.е. 0,18 мг/ кг/ч) или фиксированная дозировка, к тому же сравнительное исследование этих двух режимов до сих пор не проводилось. Пациентам необходимо прекратить назначение ГКС через несколько дней после начала терапии, чтобы избежать неблагоприятных эффектов со стороны гемодинамики и иммунной системы («эффект отдачи»). У пациентов с септическим шоком при внезапной отмене ГКС может наблюдаться значительная инверсия гемодинамических и иммунологических параметров даже после короткого курса терапии ГКС [21].
Функциональные тесты надпочечников (ФТН), проводимые с использованием 250 мкг кортикотропина, могут быть проведены и у пациентов с септическим шоком, однако в настоящее время проведение таких тестов у этой категории больных не рекомендуется [7]. При базальной плазменной концентрации кортизола у больных с септическим шоком <15 мкг/дл низкие дозы гидрокортизона могут быть рекомендованы для интенсивной терапии, а плазменный уровень более 34 мкг/дл считается повышенным. При уровне плазменной концентрации кортизола между 15 и 34 мкг/дл повышение уровня кортизола менее, чем на 9 мкг/дл позволяет предполагать наличие относительной надпочечниковой недостаточности. В этом случае ГКС могут быть назначены исходя из клинической ситуации [7]. Рутинное использование ФТН низкими дозами кортикотропина (1 мкг) у пациентов с септическим шоком не может быть рекомендовано, так как к настоящему времени недостаточно информации по этому вопросу.
Важно подчеркнуть, что все вышеперечисленные исследования проводились у пациентов с катехоламинрезистентным септическим шоком. До настоящего времени убедительных данных, аргументирующих использование низких доз стероидов при сепсисе и септическом шоке нет. Значительное влияние на исход заболевания был описан лишь у пациентов с систолическим давлением менее 90 мм.рт.ст. несмотря на проводимую терапию вазопрессорами [20]. Также достаточно хорошо известно, что низкие дозы ГКС эффективны у пациентов с более легким течением септического шока. Наконец, убедительные данные об использовании ГКС у пациентов с септи- ческим шоком отсутствуют, а использование дозировок 200-300 мг ежедневно основано лишь на эмпирических исследованиях, а значит необходимы дополнительные данные.
Заключение
Сниженная продукция гормонов надпочечников может привести к развитию серьезных заболеваний. Глюкокортикостероиды играют важную роль в промежуточном метаболизме, находясь во взаимно противоположных отношениях с инсулином, модулируя воспалительную реакцию и иммунный ответ, оптимизируют сердечно-сосудистую и центральную нервную систему. Поэтому заболевания, ведущие к первичной или вторичной надпочечниковой недостаточности, могут иметь серьезные последствия, часто жизнеугрожающие. Концепция относительной надпочечниковой недостаточности у критических пациентов с функциональными расстройствами гипоталамо-гипофизарно-надпочечниковой системы привлекает повышенное внимание со стороны специалистов в последние годы. У пациентов с тяжелым сепсисом или септическим шоком лечение ОНН вносит значимый вклад в улучшение исхода заболевания и прогноза для жизни. Как абсолютная, так и относительная надпочечниковая недоста-
