
- •1.Научная дисциплина «Механика жидкости и газа». Ее место в системе естественнонаучных знаний.
- •2.Основные гипотезы мжг гипотеза сплошности и гипотеза о локальном термодинамическом равновесии.
- •3.Изучение движения сплошной среды в переменных Эйлера и в переменных Лагранжа.
- •4.Уравнения состояния. Идеальный и совершенный газ. Отношение теплоемкостей. Уравнения состояния капельных жидкостей.
- •5.Силы, действующие в сплошной среде. Нормальные и касательные напряжения. Тензор напряжений. Тензор вязких напряжений.
- •6.Силы, действующие в жидкости. Гипотеза Ньютона. Коэффициент вязкости. Обобщенная гипотеза Ньютона. «Ньютоновские» и реологические жидкости.
- •7.Модели жидкой среды. Несжимаемая и сжимаемая жидкость. Идеальная и вязкая жидкость.
- •12. Уравнения движения в напряжениях. Уравнения гидростатики.
- •13. Сила гидростатического давления. Равнодействующая гидростатических сил. Закон Архимеда.
- •15. Уравнения в форме Громеки-Лэмба. Преобразуем уравнения
- •16.Интегралы Коши-Лагранжа и Бернулли.
- •17.Тензор напряжений в идеальной жидкости. Потенциальное движение
- •18. Динамика идеальной жидкости. Теоремы Томсона и Гельмгольца.
- •19.Парадокс Даламбера.
- •20.Гипотеза Ньютона. Обобщенная гипотеза Ньютона. Закон Фика. Число Прандтля. Уравнения Навье-Стокса для сжимаемой среды.
- •21.Уравнения Навье-Стокса для несжимаемой среды.
- •22Ламинарный режим течения. Течение Пуазейля. Решение уравнений Навье-Стокса для течения в плоской щели.
- •23.Устойчивость ламинарного движения и его переход к турбулентному.
- •24.Турбулентное течение. Число Рейнольдса. Критическое число Рейнольдса.
- •25.Подходы к математическому моделированию турбулентных течений.
- •26.Методология расчета осредненного турбулентного течения. Осреднение уравнений Навье-Стокса по Рейнольдсу и по Фавру.
- •31. Свободная турбулентность. Теория локально изотропной турбулентности Колмогорова-Обухова.
- •32. Пристенное турбулентное движение.
- •33. Течение жидкости и газа по трубам. Коэффициент потерь на трение (формула Дарси-Вейсбаха).
- •34. Течение жидкости и газа по трубам. Напряжение и тепловой поток на стенке. Аналогия Рейнольдса.
- •35. Режимы течения жидкости и газа по трубам. Вывод формул для коэффициентов потерь. Формулы Блазиуса и Никурадзе.
- •41.Соотношения для осредненных профилей скорости, температуры, концентрации в свободных турбулентных струях.
- •42.Размерные и безразмерные величины. Функциональные связи.
- •44.Подобие. Условия подобия. Числа подобия. Критерии подобия
- •45.Подобие при течении жидкостей в пс и в трубах. Условия подобия при обтекании тел
- •46. Особенности до- и сверхзвуковых пространственных течений газов.
- •47. Законы сохранения для стационарных течениях одномерном приближении.
- •48. Течение в идеальном сопле (канале). Параметры и газодинамические функции стационарного торможения. Число м.
- •49.Течение в идеальном сужающемся сопле. Критический режим и критическая скорость. Приведенная скорость λ.
- •50.Сверхзвуковое течение. Задача о стационарном истечении в вакуум.
- •54. Потери полного давления на скачке уплотнения. Адиабата Гюгонио
- •57. Задание начальных и граничных условий в задачах нестационарной газовой динамики.
- •58.Параметры и газодинамические функции нестационарного торможения.
- •59.Волны конечной амплитуды (вка). Простые и изоэнтропные вка. Соотношения при переходе через фронт изоэнтропной вка.
- •61. Воздействие на уединенную вка профилированием трубопровода по длине.
- •62.Отражение вка от открытого и от закрытого концов трубопровода.
- •63.Закономерности наполнения и опорожнения емкости через трубопровод («кривошипная камера», «ресивер», «цилиндр»).
- •64.Генерирование вка движущимся поршнем. Задача о нестационарном истечении в вакуум.
- •65. Задача о распаде произвольного разрыва.
- •66. Распад разрыва на скачке сечения.
- •67.Распад разрыва на стыке емкости и канала.
- •68. Распад разрыва при отводе и подводе энергии в форме работы.
- •69. Распад разрыва на отверстии в боковой стенке канала.
- •70. Распад разрыва в месте разветвления.
- •71. Метод характеристик и сеточно-характеристический метод.
- •72. Метод распада произвольного разрыва с. К. Годунова.
- •73.Метод Годунова для решения пространственных задач мжг по уравнениям Эйлера.
3.Изучение движения сплошной среды в переменных Эйлера и в переменных Лагранжа.
Движение
можно описать лишь
по отношению к некоторой
системе отсчета-системе
координат. Выделяют
два метода изучения движения сплошной
среды-метод Лагранжа
и метод Эйлера. Движение
газа можно считать определенным только
в том случае,
если
известно все поле скоростей
 Состояние движущегося газа считается
определенным, если
известно поле
двух термодинамических величин, например
давления и плотности.
Состояние движущегося газа считается
определенным, если
известно поле
двух термодинамических величин, например
давления и плотности.
При изучении движения газа методом Лагранжа необходимо следить за «судьбой» каждой из частиц. Это можно сделать, если обозначить каждую частицу ее начальными координатами (a,b,c) в начальный момент времени (t=t0). Координаты (a,b,c) называются переменными Лагранжа. Движение считается определенным, если известно решение системы уравнений:

 (1)
(1)

Уравнения (1) описывают семейство траектории всех частиц газа.
Если при исследовании интерес то, что происходит в разные моменты времени в данной точке пространства, то используется метод Эйлера. Независимые переменные здесь- x,y,z,t. Они носят название переменных Эйлера. Движение в этом случае считается известным, если скорость задана как функция х,у,z и t, т.е. функции
 (2)
(2)

определены.
Для перехода к решениям в форме Эйлера от решений в форме Лагранжа нужно разрешить систему уравнений (1) относительно переменных Лагранжа (а,b, с):

 (3)
(3)

Если скорость задана в соответствии с точкой зрения Лагранжа



то, подставляя вместо переменных(a,b,c) их значения из (3), находим скорость (как и другие параметры движущегося газа) как функцию переменных Эйлера (х, у, z). Очевидно, что описание движения газа по методу Лагранжа и Эйлера в механическом отношении совершенно эквивалентно друг другу.
Однако с точки зрения процесса получения решений как аналитических, так и численных выбор метода может сыграть решающую роль. Существуют эффективные численные методы для расчета нестационарных течений газа, в которых одновременно используются как переменные Лагранжа, так и переменные Эйлера (например, метод частиц в ячейках, метод крупных частиц
и др.).
4.Уравнения состояния. Идеальный и совершенный газ. Отношение теплоемкостей. Уравнения состояния капельных жидкостей.
Уравнения состояния обычного вида будет поэтому допустимо использовать во всех случаях, когда возможно вычислить значение некоторого термодинамического параметра, как зависимого. Для связи между собой собственно параметров состояния сжимаемой (в общем случае) жидкости необходимо и достаточно знать два независимых уравнения — термическое УС вида

и калорическое УС вида

где е — удельная внутренняя энергия данной жидкости, ρ и Т термодинамическое давление и температура: т. е., по известным температуре Т и плотности ρ в некоторой точке, совершенно справедливо давление вычислять по (1), а удельную внутреннюю энергию — по (2).
Идеальный и совершенный газ. В пределе достаточно больших температур и малых плотностей вещество в газовой фазе ведет себя как идеальный газ (англ. ideal gas), когда собственный объем частиц и силы из взаимного притяжения становится пренебрежимо малы. Зависимость давления идеального газа от его плотности и температуры описывается термическим УС, которое есть, частый случай общей формулы (1):

где R — удельная газовая постоянная, определяемая соотношением R = R0/W. в котором R0=8,3142 Дж/ (моль·К) — универсальная газовая постоянная. W — масса 1 моля газа. Для воздуха с W ≈0,0289 кг/моль. R≈287,1 Дж/(кг-К).
Укачанные выше особенности среды, близкой к идеально-газовому состоянию обуславливают зависимость внутренней энергии только от температуры, как меры средней кинетической энергии молекул а хаотическом движении. Температурную зависимость е(Т) дли идеального газа принято выражать известным из термодинамики тождеством

где cv(T) — температурная зависимость удельной теплоемкости при постоянном давлении.
Дли идеального газа (или постоянного состава смеси таких газов) уровень величины е(T0) может быть задан произвольно, как и «базовое» значение температуры T0. например, при e(0)=0
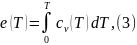
Во
многих задачах охватываемый интервал
температур не так велик, чтобы могло
заметно проявиться отличие cv(T)
от
постоянного значения, и, соответственно,
отличие зависимости е(Т)
от
линейной. По укачанным выше соображениям
в этом случае рационально применять
линеаризованный вариант зависимости
(3) — с некоторым постоянным значением
теплоемкости cv0,
характерным для применяемого интервалa
температур, например, средней
теплоемкости –
 . Гипотетический газ, обладающий таким
свойством, называется (калорическим)совершенным
газом, англ.
(calorically)
perfect
gas.
Обозначаем
здесь и в дальнейшем постоянное значение
теплоемкости как сv.
Текущее
значение
(для данной Т) или саму зависимость будем
обозначать сv(Т).
Запишем
калорическое уравнение состояния для
совершенного газа:
. Гипотетический газ, обладающий таким
свойством, называется (калорическим)совершенным
газом, англ.
(calorically)
perfect
gas.
Обозначаем
здесь и в дальнейшем постоянное значение
теплоемкости как сv.
Текущее
значение
(для данной Т) или саму зависимость будем
обозначать сv(Т).
Запишем
калорическое уравнение состояния для
совершенного газа:

Так
как pакон
Майера
 справедлив
и в частном случае совершенного
газа, то
при сv
= const
теплоемкость
при постоянном давлении ср
также
постоянна, и отношение
теплоемкостей-
справедлив
и в частном случае совершенного
газа, то
при сv
= const
теплоемкость
при постоянном давлении ср
также
постоянна, и отношение
теплоемкостей-

ость постоянная величина. При температурах до 1000 К можно принять, что для одноатомных газов и их смесей γ =1,67, для двухатомных и смесей γ=1,40, для трех- и многоатомных — γ=1,25. Для продуктов сгорания углеводородных топлив в выпускных трактах тепловых двигателей принимают γ=1,33…1,36.
Уравнения состояния капельных жидкостей. Такие жидкости обладают значительной «жесткостью», в том смысле, что значительное повышение давления вызывает лишь малое приращение плотности. Это часто отражается самим ни дом полуэмпирической зависимости, используемой в качестве УС капельной жидкости. Для воды и ряда других капельных жидкостей при высоких давлениях часто используют уравнениесостояния Тэта
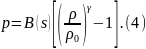
В этом уравнении В- слабо зависящая от энтропии s величина (обычно считают В = const), а ρ0 —плотность при нормальном давлении), γ – коэффициент для УС Тета.
