
- •Кристаллография и минералогия
- •Для студентов высших учебных заведений
- •Предисловие
- •Содержание
- •Введение
- •Основы кристаллографии
- •Глава 1. Аморфные и кристаллические вещества
- •Историческая справка о развитии геолого-минералогических наук. Закон Стенона
- •1.3 Аморфные и кристаллические вещества
- •1.4 Основные свойства кристаллов
- •Глава 2. Зарождение и рост кристаллов
- •2.1 Пути образования кристаллов
- •2.2 Выращивание кристаллов из растворов
- •Факторы, влияющие на облик кристаллов
- •Практическое значение кристаллизации растворов в технологии силикатов
- •2.5 Кристаллизация из расплавов и стекол
- •2.6. Промышленные методы выращивания кристаллов
- •Глава 3. Симметрия кристаллов и их классификация
- •3.1 Элементы симметрии
- •Р исунок 3.1 - Центр симметрии
- •3.2 Взаимодействие между элементами симметрии в кристалле
- •3.3 Классификация кристаллов
- •Глава 4. Простые формы и их комбинации в кристаллах различных сингоний
- •4.1 Распределение простых форм по сингониям и категориям
- •Расшифровка комбинированных форм
- •Глава 5. Установка кристаллов. Определение индексов граней
- •5.1 Понятие о кристаллографических символах
- •Установка кристаллов
- •5.3 Закон Гаюи
- •5.4 Практические рекомендации по определению кристаллографических символов
- •Глава 6. Стереографические проекции кристаллов
- •6.1 Принципы стереографического проектирования
- •6.2 Проектирование элементов симметрии кристаллов
- •Глава 7. Изучение пространственной решетки
- •7.1 Решетки Браве
- •7.2 Определение формульной единицы
- •7.3 Координационные числа и координационные многогранники
- •Глава 8. Плотнейшие упаковки
- •8.1 Понятие о кристаллохимическом радиусе
- •8.2 Виды плотнейших упаковок в структурах
- •8.3 Доля заполненных пустот
- •Глава 9. Типы физико-химических связей в кристаллах
- •9.1 Типы кристаллических структур
- •9.2 Металлический тип связи
- •9.3 Ионная или гетерополярная связь
- •9.4 Ковалентная (гомеополярная) или атомная связь
- •9.6 Водородная связь
- •9.7 Явление поляризации в кристаллических телах
- •Глава 10. Полиморфизм, изоморфизм
- •10.1 Определение полиморфизма, его типы
- •10.2 Примеры полиморфных переходов
- •10.3. Полиморфные превращения в системе SiO2
- •10.4 Понятие об изоморфизме
- •10.5 Виды изоморфизма
- •Глава 11. Главнейшие типы кристаллических структур
- •11.1 Способы моделирования кристаллов. Метод координационных полиэдров
- •11.2 Понятие о структурном типе
- •11.3 Примеры основных структурных типов
- •Тема 12. Кремнекислородные структуры
- •12.1 Особенности строения силикатов
- •12.2 Состав силикатов в виде структурных формул
- •12.3 Классификация силикатов по типу кремнекислородных группировок (радикалов, мотивов)
- •12.4 Особенности структур кварца, тридимита, кристобалита
- •Глава 13. Дефекты кристаллической решетки
- •13.1 Классификация дефектов кристаллической решетки
- •13.2 Нульмерные (точечные) дефекты
- •13.3 Линейные дефекты
- •13.4 Свойства дислокации
- •13.5 Влияние дислокации на скорость роста кристаллов
- •Минералогия
- •Глава 14. Минералогия. Свойства минералов
- •14.1 Наука «минералогия» и объекты ее исследования. Написание формул минералов
- •14.2 Морфология минералов
- •14.3 Явление двойникования и эпитаксии в реальных кристаллах
- •14.4 Физико-химические свойства минералов
- •Тема 15. Геологические процессы образования минералов
- •15.1. Классификация минералов и горных пород по генезису
- •15.2.Эндогенные процессы образования минералов и пород
- •15.3 Экзогенные процессы минералообразования
- •15.4 Метаморфические процессы минералообразования
- •Глава 16. Классификация минералов. Особенности различных классов минералов
- •16.1 Классификация минералов по с.Д. Четверикову
- •16.2 Класс самородных элементов
- •16.3 Сульфиды. Сульфаты
- •16.4 Галоидные соединения. Бораты. Фосфаты
- •16.5 Карбонаты. Нитраты
- •16.6 Оксиды и гидроксиды
- •Глава 17. Силикаты
- •Основные сведения о силикатах
- •17.2 Островные силикаты
- •17.3 Цепочечные и ленточные силикаты
- •17.4 Слоистые силикаты
- •17.5 Каркасные силикаты
- •Литература
Тема 12. Кремнекислородные структуры
12.1 Особенности строения силикатов
Силикатами являются почти все породообразующие минералы, составляющие около ½ массы земной коры, а также искусственно получены продукты – керамика, стекло, цемент.
Они представляют собой особый класс неорганических соединений, основной структурной единицей которых являются изолированные или связанные между собой кремнекислородные группы [SiO4]4-. Отношение радиусов кремния и кислорода в ортосиликатной группе составляет 0,37, что соответствует координационному числу 4. Координационным многогранником является тетраэдр, в котором катион кремния устойчиво координирован (окружен) четырьмя анионами кислорода (рис. 12.1).
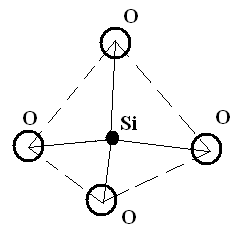
Рисунок 12.1 – Кремнекислородный радикал [SiO4]4-
Единичная связь Si – O является промежуточной между ионной и ковалентной. Процент доли ковалентной связи, вычисленной по отношению электроотрицательностей ионов Si4+ и О2-, составляет примерно 50%. Связь Si – O обладает относительно большой прочностью, она равна 470 кДж/моль.
Тетраэдрические группы [SiO4]4- объединяются друг с другом через общие (мостиковые) ионы кислорода, нейтрализуя валентности последних. Такое объединение может происходить только путем обобщения вершин тетраэдра, а не ребер и граней (т.е. у двух соседних тетраэдров общим может быть только один анион кислорода). В зависимости от количества обобщенных вершин (одна, две, три или четыре), создаются различные кремнекислородные комплексы, они носят название кремнекислородного мотива и на их характере основывается современная классификация структуры силикатов.
Кроме кремнекислородных комплексов в состав силикатов входит много других ионов: Li, Na, K, Be, Mg, Ca, Ti, Zr, Mn, Fe, Zn, B, Al, Ba, O, H, F и др. Роль этих компонентов заключается в том, что они компенсируют валентности немостиковых анионов кислорода и соединяют кремнекислородные группировки между собой, как бы «сшивая» их.
Некоторые из этих катионов, прежде всего Al, В, Be обладают способностью частично замещать кремний в кремнекислородном мотиве. В результате такого изоморфного замещения образуются смешанные мотивы, например алюмокремнекислородный, а также боро-, берилло-, титано- и цирконокремнекислородные.
Особенно интересна и важна в силикатах роль алюминия и бора. Ион алюминия крупнее иона кремния, поэтому в силикатах алюминий может встречаться по отношению к кислороду как в тетраэдрической координации (в этом случае он замещает кремний в кремнекислородном мотиве, - алюмосиликаты), так и в октаэдрической (в этом случае он находится вне кремнекислородного мотива, - силикаты алюминия).
В силикатные кремнекислородные мотивы могут входить и некоторые катионы F-, (oh)- и нейтральные молекулы воды Н2О, замещая ионы кислорода. Причем не все анионы кислорода обязательно входят в кремнекислородный мотив.
Катионы щелочных (Li, Na, K), щелочно-земельных (Mg, Ca, Ba), переходных металлов (Ti, Zr, Mn, Fe) в кремнекислородные мотивы не входят. Они нейтрализуют валентности необобществленных (активных) анионов кислорода в кремнекислородном мотиве и связывают кремнекислородные радикалы между собой.
Обычным координационным числом для большинства металлов (Li, Mg, Ca, Ti, Sr, Mn, Fe) по кислороду является 6, а координационным многогранником – октаэдр. Тетраэдрическая координация в силикатах встречается у Ti, Zr, Fe. Размеры таких тетраэдров значительно превышают размеры кремнекислородных, поэтому эти элементы, как правило, не входят в кремнекислородные мотивы. Крупные и одновалентные катионы (Na, K) могут иметь в силикатах структурный тип корунда (тип Д5), координационное число по кислороду, равное 8 и больше.
Одной из особенностей структур силикатов является тот факт, что большинство из них не образуют плотнейших упаковок. Связано это, в частности, с низким координационным числом кислорода по кремнию (анион кислорода координируется только двумя катионами Si4+). Исключением является форстерит 2MgO·SiO2.
