
- •Кристаллография и минералогия
- •Для студентов высших учебных заведений
- •Предисловие
- •Содержание
- •Введение
- •Основы кристаллографии
- •Глава 1. Аморфные и кристаллические вещества
- •Историческая справка о развитии геолого-минералогических наук. Закон Стенона
- •1.3 Аморфные и кристаллические вещества
- •1.4 Основные свойства кристаллов
- •Глава 2. Зарождение и рост кристаллов
- •2.1 Пути образования кристаллов
- •2.2 Выращивание кристаллов из растворов
- •Факторы, влияющие на облик кристаллов
- •Практическое значение кристаллизации растворов в технологии силикатов
- •2.5 Кристаллизация из расплавов и стекол
- •2.6. Промышленные методы выращивания кристаллов
- •Глава 3. Симметрия кристаллов и их классификация
- •3.1 Элементы симметрии
- •Р исунок 3.1 - Центр симметрии
- •3.2 Взаимодействие между элементами симметрии в кристалле
- •3.3 Классификация кристаллов
- •Глава 4. Простые формы и их комбинации в кристаллах различных сингоний
- •4.1 Распределение простых форм по сингониям и категориям
- •Расшифровка комбинированных форм
- •Глава 5. Установка кристаллов. Определение индексов граней
- •5.1 Понятие о кристаллографических символах
- •Установка кристаллов
- •5.3 Закон Гаюи
- •5.4 Практические рекомендации по определению кристаллографических символов
- •Глава 6. Стереографические проекции кристаллов
- •6.1 Принципы стереографического проектирования
- •6.2 Проектирование элементов симметрии кристаллов
- •Глава 7. Изучение пространственной решетки
- •7.1 Решетки Браве
- •7.2 Определение формульной единицы
- •7.3 Координационные числа и координационные многогранники
- •Глава 8. Плотнейшие упаковки
- •8.1 Понятие о кристаллохимическом радиусе
- •8.2 Виды плотнейших упаковок в структурах
- •8.3 Доля заполненных пустот
- •Глава 9. Типы физико-химических связей в кристаллах
- •9.1 Типы кристаллических структур
- •9.2 Металлический тип связи
- •9.3 Ионная или гетерополярная связь
- •9.4 Ковалентная (гомеополярная) или атомная связь
- •9.6 Водородная связь
- •9.7 Явление поляризации в кристаллических телах
- •Глава 10. Полиморфизм, изоморфизм
- •10.1 Определение полиморфизма, его типы
- •10.2 Примеры полиморфных переходов
- •10.3. Полиморфные превращения в системе SiO2
- •10.4 Понятие об изоморфизме
- •10.5 Виды изоморфизма
- •Глава 11. Главнейшие типы кристаллических структур
- •11.1 Способы моделирования кристаллов. Метод координационных полиэдров
- •11.2 Понятие о структурном типе
- •11.3 Примеры основных структурных типов
- •Тема 12. Кремнекислородные структуры
- •12.1 Особенности строения силикатов
- •12.2 Состав силикатов в виде структурных формул
- •12.3 Классификация силикатов по типу кремнекислородных группировок (радикалов, мотивов)
- •12.4 Особенности структур кварца, тридимита, кристобалита
- •Глава 13. Дефекты кристаллической решетки
- •13.1 Классификация дефектов кристаллической решетки
- •13.2 Нульмерные (точечные) дефекты
- •13.3 Линейные дефекты
- •13.4 Свойства дислокации
- •13.5 Влияние дислокации на скорость роста кристаллов
- •Минералогия
- •Глава 14. Минералогия. Свойства минералов
- •14.1 Наука «минералогия» и объекты ее исследования. Написание формул минералов
- •14.2 Морфология минералов
- •14.3 Явление двойникования и эпитаксии в реальных кристаллах
- •14.4 Физико-химические свойства минералов
- •Тема 15. Геологические процессы образования минералов
- •15.1. Классификация минералов и горных пород по генезису
- •15.2.Эндогенные процессы образования минералов и пород
- •15.3 Экзогенные процессы минералообразования
- •15.4 Метаморфические процессы минералообразования
- •Глава 16. Классификация минералов. Особенности различных классов минералов
- •16.1 Классификация минералов по с.Д. Четверикову
- •16.2 Класс самородных элементов
- •16.3 Сульфиды. Сульфаты
- •16.4 Галоидные соединения. Бораты. Фосфаты
- •16.5 Карбонаты. Нитраты
- •16.6 Оксиды и гидроксиды
- •Глава 17. Силикаты
- •Основные сведения о силикатах
- •17.2 Островные силикаты
- •17.3 Цепочечные и ленточные силикаты
- •17.4 Слоистые силикаты
- •17.5 Каркасные силикаты
- •Литература
Глава 8. Плотнейшие упаковки
8.1 Понятие о кристаллохимическом радиусе
Точечное расположение атомов в кристаллической решетке, каким пользуются для ее условного изображения, представляет собой упрощенную картинку, т.к. атомы и ионы обладают конечными размерами. При образовании кристаллической решетки атомы, ионы или молекулы располагаются друг от друга на определенных расстояниях. Эти расстояния определяются взаимодействием сил притяжения и отталкивания. Каждому атому или иону приписывают некоторую сферу действия, внутрь которой он не пропускает соседние атомы (ионы).
Эффективным кристаллохимическим радиусом называется минимальное расстояние, на которое центр сферы данного атома или иона может приблизиться к поверхности сфер соседних атомов.
Атомные и ионные радиусы определены экспериментально с помощью рентгеноструктурного анализа и вычислены теоретически на основе квантовомеханических представлений.
Пример вычисления кристаллохимического радиуса r для меди.
При помощи рентгеноструктурного анализа определено межплоскостное расстояние d и тип решетки Браве: гранецентрированная кубическая решетка.
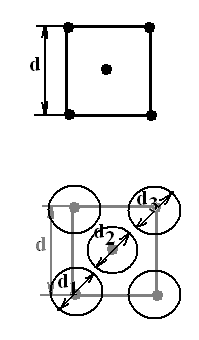
d (Cu) = 3,61 Å
d1d3 = 4r
d1d32 = d2 + d2 = 2d2
d1d3 = √ 2d2 = 1,4d
4r=1,4d
r= 1,43,61/4=1,28 Å
8.2 Виды плотнейших упаковок в структурах
При описании структуры в терминах плотнейших упаковок атомы, ионы или молекулы представляют в виде несжимаемых шаров одинакового размера. Чтобы структура была устойчивой, она должна обладать минимальной потенциальной энергией. Это условие соблюдается при максимальном сближении атомов в структуре, то есть при образовании в структуре плотнейших упаковок. Они присущи для всех химических соединений, но чаще всего присутствуют в ионных и металлических структурах.
Рассмотрим принципы образования плотнейших упаковок.
В первом слое наиболее плотная упаковка достигается в том случае, когда каждый шар окружен шестью соседними шарами и шестью треугольными лунками.
Второй слой шаров укладывается наиболее плотно, если шар размещается над лункой, а не шар над шаром. При этом заполняется половина лунок и образуется два вида пустот (рис. 8.1):
- тетраэдрические – пустоты, окруженные четырьмя шарами: тремя одного слоя и одним шаром (над или под ним) другого слоя, при соединении центров этих шаров образуется тетраэдр;
- октаэдрические – пустоты, окруженные шестью шарами: тремя одного и тремя другого слоя, при соединении центров этих шаров образуется октаэдр.
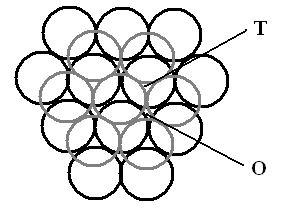
Рисунок 8.1 – Виды пустот: Т – тетраэдрическая, О - окраэдрическая
При укладке третьего слоя можно использовать один или другой вид пустот. Если третий слой уложить по тетраэдрическим пустотам, то конфигурация третьего слоя повторит конфигурацию первого слоя – такой вид упаковки называется гексагональной плотнейшей упаковкой (двухслойной – АВ//АВ//АВ…), структура имеет ось симметрии L3. Гексагональная плотнейшая упаковка может встречаться или в тригональной или гексагональной сингониях.
Если третий слой шаров уложить по октаэдрическим пустотам, то лишь четвертый слой при такой укладке повторит конфигурацию первого слоя – при этом образуется кубическая плотнейшая упаковка (трехслойная АВС//АВС//АВС…), структура имеет оси симметрии 4L3. Последняя встречается только в кубической сингонии и соответствует гранецентрированной кубической решетке.
В обоих типах плотнейших упаковок число тетраэдрических пустот вдвое больше числа шаров упаковки, а число октаэдрических пустот равно числу шаров упаковки. В сложных структурах (например NaCl) плотнейшую упаковку образуют чаще всего более крупные анионы (в данном случае Cl-), а более мелкие катионы занимают пустоты. Если ион занимает тетраэдрическую пустоту, то его координационное число равно 4, если катион занимает октаэдрическую пустоту, то его координационное число по аниону равно 6.
В плотнейших упаковках в любом слое каждый шар окружен шестью своими соседними и тремя шарами сверху и тремя – снизу, то есть координационное число атомов, которые образуют плотнейшую упаковку равно 12.
Высокое координационное число – признак плотнейшей упаковки.
Плотность заполнения пространства в обоих случаях плотнейших упаковок одинаково и составляет 74,05% или ¾ пространства занято шарами и ¼ - это пустоты.
Г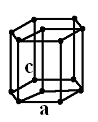 ексагональная
плотнейшая упаковка присуща Mg,
Zn, Cd и др.
Во всех случаях величина атомов,
расстояние между атомами различные, но
постоянным остается соотношение высоты
элементарной ячейки и ее ширины с/а=1,633.
ексагональная
плотнейшая упаковка присуща Mg,
Zn, Cd и др.
Во всех случаях величина атомов,
расстояние между атомами различные, но
постоянным остается соотношение высоты
элементарной ячейки и ее ширины с/а=1,633.
Кубическая плотнейшая упаковка – Au, Cu, Ag, Al.
В структурах встречается иногда так называемая объемоцентрированная кубическая упаковка. Она не является плотнейшей, но является достаточно плотной с коэффициентом заполнения пространства 68%.
В других структурах встречаются многослойные плотнейшие упаковки; все они представляют собой сочетание различных мотивов двух и трехслойной упаковок. Для всех них коэффициент заполнения меньше 74,05%.
По правилу Соболева переход к более высокому координационному числу приводит к уплотнению упаковки ионов, экономии пространства, уменьшению удельного объема, в связи с чем растет плотность, показатель преломлении, твердость, прочность кристаллической решетки, ее химическая стойкость.
