- •Кристаллография и минералогия
- •Для студентов высших учебных заведений
- •Предисловие
- •Содержание
- •Введение
- •Основы кристаллографии
- •Глава 1. Аморфные и кристаллические вещества
- •Историческая справка о развитии геолого-минералогических наук. Закон Стенона
- •1.3 Аморфные и кристаллические вещества
- •1.4 Основные свойства кристаллов
- •Глава 2. Зарождение и рост кристаллов
- •2.1 Пути образования кристаллов
- •2.2 Выращивание кристаллов из растворов
- •Факторы, влияющие на облик кристаллов
- •Практическое значение кристаллизации растворов в технологии силикатов
- •2.5 Кристаллизация из расплавов и стекол
- •2.6. Промышленные методы выращивания кристаллов
- •Глава 3. Симметрия кристаллов и их классификация
- •3.1 Элементы симметрии
- •Р исунок 3.1 - Центр симметрии
- •3.2 Взаимодействие между элементами симметрии в кристалле
- •3.3 Классификация кристаллов
- •Глава 4. Простые формы и их комбинации в кристаллах различных сингоний
- •4.1 Распределение простых форм по сингониям и категориям
- •Расшифровка комбинированных форм
- •Глава 5. Установка кристаллов. Определение индексов граней
- •5.1 Понятие о кристаллографических символах
- •Установка кристаллов
- •5.3 Закон Гаюи
- •5.4 Практические рекомендации по определению кристаллографических символов
- •Глава 6. Стереографические проекции кристаллов
- •6.1 Принципы стереографического проектирования
- •6.2 Проектирование элементов симметрии кристаллов
- •Глава 7. Изучение пространственной решетки
- •7.1 Решетки Браве
- •7.2 Определение формульной единицы
- •7.3 Координационные числа и координационные многогранники
- •Глава 8. Плотнейшие упаковки
- •8.1 Понятие о кристаллохимическом радиусе
- •8.2 Виды плотнейших упаковок в структурах
- •8.3 Доля заполненных пустот
- •Глава 9. Типы физико-химических связей в кристаллах
- •9.1 Типы кристаллических структур
- •9.2 Металлический тип связи
- •9.3 Ионная или гетерополярная связь
- •9.4 Ковалентная (гомеополярная) или атомная связь
- •9.6 Водородная связь
- •9.7 Явление поляризации в кристаллических телах
- •Глава 10. Полиморфизм, изоморфизм
- •10.1 Определение полиморфизма, его типы
- •10.2 Примеры полиморфных переходов
- •10.3. Полиморфные превращения в системе SiO2
- •10.4 Понятие об изоморфизме
- •10.5 Виды изоморфизма
- •Глава 11. Главнейшие типы кристаллических структур
- •11.1 Способы моделирования кристаллов. Метод координационных полиэдров
- •11.2 Понятие о структурном типе
- •11.3 Примеры основных структурных типов
- •Тема 12. Кремнекислородные структуры
- •12.1 Особенности строения силикатов
- •12.2 Состав силикатов в виде структурных формул
- •12.3 Классификация силикатов по типу кремнекислородных группировок (радикалов, мотивов)
- •12.4 Особенности структур кварца, тридимита, кристобалита
- •Глава 13. Дефекты кристаллической решетки
- •13.1 Классификация дефектов кристаллической решетки
- •13.2 Нульмерные (точечные) дефекты
- •13.3 Линейные дефекты
- •13.4 Свойства дислокации
- •13.5 Влияние дислокации на скорость роста кристаллов
- •Минералогия
- •Глава 14. Минералогия. Свойства минералов
- •14.1 Наука «минералогия» и объекты ее исследования. Написание формул минералов
- •14.2 Морфология минералов
- •14.3 Явление двойникования и эпитаксии в реальных кристаллах
- •14.4 Физико-химические свойства минералов
- •Тема 15. Геологические процессы образования минералов
- •15.1. Классификация минералов и горных пород по генезису
- •15.2.Эндогенные процессы образования минералов и пород
- •15.3 Экзогенные процессы минералообразования
- •15.4 Метаморфические процессы минералообразования
- •Глава 16. Классификация минералов. Особенности различных классов минералов
- •16.1 Классификация минералов по с.Д. Четверикову
- •16.2 Класс самородных элементов
- •16.3 Сульфиды. Сульфаты
- •16.4 Галоидные соединения. Бораты. Фосфаты
- •16.5 Карбонаты. Нитраты
- •16.6 Оксиды и гидроксиды
- •Глава 17. Силикаты
- •Основные сведения о силикатах
- •17.2 Островные силикаты
- •17.3 Цепочечные и ленточные силикаты
- •17.4 Слоистые силикаты
- •17.5 Каркасные силикаты
- •Литература
11.2 Понятие о структурном типе
На основе первого способа моделирования виделены главнейшие(основные) структурные типы кристалов. Структурный тип - это определенный порядок расположения частиц в пространстве.
Структуры кристаллов, принадлежащие к одному структурному типу, одинаковы с точностью до подобия.
Чтобы описать конкретную структуру надо указать структурный тип и параметры структуры (например, d, нм – кратчайшее расстояние между атомами).
В Международном структурном справочнике принята следующая классификация:
А – элементы;
В – соединения типа АВ (NaCl, CsCl);
С – соеденения типа АВ2 ( CaF2, TiO2);
D – соеденения типа АnBm (Al2O3);
Е – соединения, образованные больше, чем двумя сортами атомов, без радикалов или комплексных ионов (CuFeS);
F – структуры соединений с двух или трехатомными ионами (KCNS, NaHF2);
G – соединения с четырехатомными ионами (CaSO3, NaClO3);
Н – соединения с пятиатомными ионами (CaSO42H2O, CaWO4);
L – сплавы;
S – силикаты.
Разновидности типов внутри групп отличаются номерами.
Рассмотрим некоторые основные типы.
11.3 Примеры основных структурных типов
Структурный тип меди (тип А)
В данном структурном типе кристаллизируются многие металлы: Au, Ag, Ni, Al, Ca, Pb и др.
|
Рисунок 11.1 – Кристаллическая решетка меди |
Описывая структуру, например Аl, можно сказать, что он имеет структурный тип меди, а его межплоскостное расстояние равно: d=0,286 нм. Этого описания достаточно для полной характеристики кристаллической решетки алюминия.
Структурный тип магния (тип А3)
В данном структурном типе кристаллизуются гексагональные металлы: Cd, Be, Ni, Cr.
|
Рисунок 11.2 – Кристаллическая решетка магния |
Атомы расположены в вершинах ячейки, а также в центрах трех из шести тригональных призм (если мысленно разделить гексагональную призму на шесть тригональных).
Каждый атом магния окружен двенадцатью ближайшими атомами: шесть в том же слое, три в соседнем слое сверху и три - в соседнем слое снизу, то есть к.ч.=12, что служит признаком плотнейшей упаковки. Координационный многогранник – гексагональный кубоктаэдр. Плотнейшая гексагональная упаковка (двухслойная АВ//АВ) – перпендикулярна оси L6.
В идеальных, плотно упакованных гексагональных металлах отношение высоты элементарной ячейки с к расстоянию а между соседними атомами в базисной плоскости с/а = 1,663, хотя сами параметры с и а для разных веществ различны.
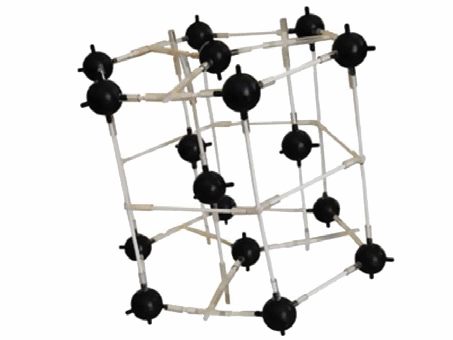
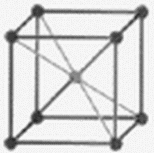
Структурный тип железа (тип А2)- рис. 11.3.
|
Рисунок 11.3 – Кристаллическая решетка железа |
Причем -Fe имеет структуру ОЦК в области температуры ниже 910о и выше 1400оС, а в области 910-1400оС оно имеет ГЦК – структуру.
Элементарная ячейка – обьемоцентрированный куб, Z=1/88+1=2 атома. ОЦК - структура не имеет плотнейшей упаковки.
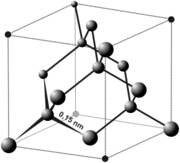
Структурный тип алмаза (тип А4)
Кристаллизуются важнейшие элементарные полупроводники, элементы IV групп периодической системы: германий, кремний, серое олово ().
|
Рисунок 11.4 – Кристаллическая решетка алмаза |
Все связи в структуре алмаза направлены по <111> (т.е. по вершинам тетраэдра) и составляют друг с другом углы 109о28’ (кстати, у кремния этот угол такой же), d алмаза=0,375 нм, (d кремния=0,543 нм). Каждый атом окружен четырьмя такими же атомами, т.е. координационное число равно четырем, координационный многогранник - тетраедр.
На одну элементарную ячейку приходится восемь атомов (Z=1/88+1/26+4=8).
Плотнейшей упаковки в структуре нет. Однако в направлении перпендикулярно оси L3 есть плоскости, упакованные плотнее, чем любые другие плоскости. Эти слои двойные, как бы слагаются из двух подслоев: один состоит из атомов, у которого вертикально расположенные связи направлены вверх, а у другого - вниз. В подслоях три связи на атом, а два соседних двойных слоя одной соединяются одной связью на атом. По ним проходит спайность алмаза.
В структуре существуют шестисторонние «каналы» в направлениях <110> (диагонали в грани куба) проходящие насквозь. По этим каналам легко идет диффузия примесей в кристаллическую решетку, которые окрашивают алмаз.
Структурный тип графита (тип А9) рис. 11.5.
Гексагональная модификация углерода термодинамически устойчивая при температуре ниже 1000оС.
|
Рисунок 11.5 – Кристаллическая решетка алмаза |
Элементарная ячейка – ромбическая призма. Атомы расположены в вершинах, середине всех длинных ребер, в центре одной тригональной призмы и в основаниях второй: Z=1/88+1/44+1/22+1=4.
Упаковка не плотнейшая. Расстояние между слоями в структуре значительно больше (3,40 Å = 0,340 нм), чем расстояние между атомами внутри слоя (1,40Å = 0,140 нм). Внутри слоя действуют прочные ковалентные связи, между слоями – слабые Ван-дер-Ваальсовские. Этим объясняется сильное различие свойств вдоль и поперек главной оси симметрии. Электропроводность вдоль оси С в 105 раз больше, чем в поперечных направлениях. Весьма совершенная спайность по (0001).
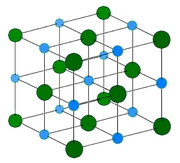
|
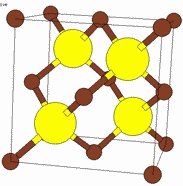
Рисунок 11.6 – Кристаллическая решетка NaСl |
Среди бинарных соединений типа АВ – наиболее распространен: хлориды, фториды, бромиды, йодиды Li, Na, K; оксиды Mg, Ca, Sr, Ba, Cd, Mn, Fe, Co, Ni (т.е. переходных элементов), сульфиды, селениды Ca, Sr, Ba, Pb, Mn.
Структуру можно описать как две кубические гранецентрированные решетки ионов Na и Сl (рис. 11.6), сдвинутых одна относительно другой так, что узел [[000]] одной ячейки совпадает с узлом [[½, ½, ½]] другой ячейки.
Координационное число NaCl = ClNa = 6, координационный многогранник – октаэдр.
Можно сказать, что здесь взаимопроникающие упаковки: одна из атомов хлора, другая – из атомов натрия. Анионы хлора образуют кубическую плотнейшую упаковку, а катионы натрия заполняют все октаэдрические пустоты.
ZNaСl = 4.
Спайность по кубу.
Структурный тип сфалерита ( тип В3 )
Кубический сфалерит – цинковая обманка - ZnS.
|
Рисунок 11.7 – Кристаллическая решетка сфалерита |
Координационное число Zn/S= S/Zn = 4, координационный многогранник – тетраэдр; ZZnS = 4.
В этой структуре (также как и в структуре вюрцита -ZnS) нет центра симметрии, эти структуры полярны, т.е. в них возможны полярные физические свойства. Это могут быть полупроводники, пьезоэлектрики.
По типу сфалерита кристаллизуются AgI, CuCl, SiC, HgS, SiC и др.
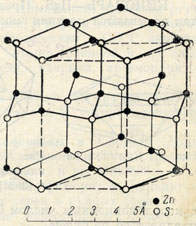
Структурный тип вюртцита (тип В4)
|
Рисунок 11.8 – Кристаллическая решетка вюртцита |
Элементарную ячейку вюртцита можно представить в виде двух тригональных призм, составленных в ромбическую призму с =120о. Внутри одной из призм нет ионов, а в другой - на линии, соединяющей центры ее оснований, есть по одному катиону и аниону. Кроме того, анионы расположены по вершинам ромбической призмы, а катионы - по ребрам.
ZZnS=2, координационные числа Zn/S= S/Zn =4.
Можно также описывать такую структуру гексагональной призмой, составленной из шести элементарных тригональных призм.
Плотнейшая упаковка в структуре вюртцита образована параллельными слоями анионов, катионы заполняют половину тетраэдрических пустот. Нужно заметить, что оба вида ионов образуют гексагональную плотнейшую упаковку.
По типу вюртцита кристаллизуются ZnО, CdS, BeO.
|
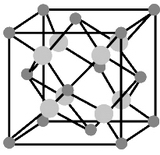
Рисунок 11.9 – Кристаллическая решетка вюртцита |
Ионы кальция – по узлам ГЦК, ионы фтора – в центрах каждого октанта.
ZCa=4, ZF=8 ZCaF2= 4
Координационное число Ca/F=8, F/Ca=4.
Координационные многогранники: куб, тетраэдр.
Ионы кальция образуют плотнейшую кубическую упаковку, в которой ионы фтора располагаются в тетраэдрических пустотах. Эта структура характерна для некоторых галоидов BaF2, двуокисей UO2, ThО2.
Антифлюоритовый тип структуры - геометрически подобен флюоритовому, но в нем места катионов занимают анионы, а анионов - катионы. Такую структуру имеют многие соединения типа А2В (аргентин Ag2S, халькозин Cu2S).
Структурный тип рутила ТіО2 (типС4)
|
Рисунок 11.10 – Кристаллическая решетка рутила |
Координационное число Ti/О=6, O/Ti=3.
Координационные многогранники: октаэдр, треугольник.
В направлении оси L4 октаэдры, соединяясь друг с другом ребрами, образуют цепочки, следствием чего является характерный длиннопризматический, до игольчатого облик кристаллов рутила, вытянутых по оси С.
Структуру рутила имеют касситерит SnO2, полианит MnO2, платтенерит PbO2.
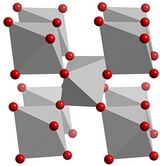
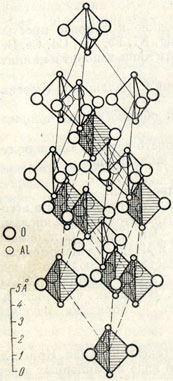
Структурный тип корунда (тип Д5) рис. 11.11.
Структуру корунда можно описать как ромбоэдрически деформированную структуру NaCl, в которой ион Na или Cl заменен группой Al2O3.
Двухвалентные ионы кислорода образуют гексагональную плотнейшую упаковку, а трехвалентные ионы алюминия заполняют 2/3 октаэдрических пустот, лежащих в направлениях <1010>. Корунд кристаллизуется в тригональной сингонии.
|
Рисунок 11.11 – Кристаллическая решетка корунда |
В тоже время, сильное электростатическое притяжение, наряду с плотной упаковкой, обусловливает высокую твердость корунда (самый твердый после алмаза).
Чистые кристаллы корунда бесцветны. Примеси, которые легко входят в структуру, окрашивают корунд в разные цвета: хром – от бледно-розового до темно-красного (рубины), титан – в синий (сапфир), кобальт – в зеленый, железо и никель – желтый.
В рубине происходит изоморфное замещение Al3+ на Cr3+.
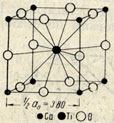
Структурный тип перовскита (тип Е2)
|
Рисунок 11.12 – Кристаллическая решетка перовксита |
В элементарной ячейке (кубической) – в вершинах - ионы титана, в серединах ребер - ионы кислорода (рис.11.12), а ионы кальция - внутри ячейки. Решетка не обьемоцентрированная, а примитивная, т.к. внутри и по вершинам располагаются разные атомы. Если выбрать начало координат в одном из ионов титана, тогда координаты ионов: титана [[000]], кальция [[1/2 1/2 1/2]], кислорода [[0 1/2 1/2]], [[1/2, 0 1/2]], [[1/2 ½ 0]].
Ион кальция принадлежит ячейке целиком. Ионы титана находящиеся в вершинах, дают вклад 81/8=1, ионы кислорода 121/4=3. Стехиометрическое отношение Са :Ti :O=1:1:3, то есть ZCaTiO3=1
Координационные числа и многогранники:
Ti по Ca 8 – куб;
Ti по O 6 –октаэдр;
О по Ті 2 – гантель;
О по Са 4 – квадрат;
Са по О 12– кубооктаэдр.
Ионы Са и О сообща образуют плотнейшую упаковку, т.е. катион Са очень большого размера, примерно такого же, как и кислород, занимает положение шаров плотнейшей упаковки.