
- •Кристаллография и минералогия
- •Для студентов высших учебных заведений
- •Предисловие
- •Содержание
- •Введение
- •Основы кристаллографии
- •Глава 1. Аморфные и кристаллические вещества
- •Историческая справка о развитии геолого-минералогических наук. Закон Стенона
- •1.3 Аморфные и кристаллические вещества
- •1.4 Основные свойства кристаллов
- •Глава 2. Зарождение и рост кристаллов
- •2.1 Пути образования кристаллов
- •2.2 Выращивание кристаллов из растворов
- •Факторы, влияющие на облик кристаллов
- •Практическое значение кристаллизации растворов в технологии силикатов
- •2.5 Кристаллизация из расплавов и стекол
- •2.6. Промышленные методы выращивания кристаллов
- •Глава 3. Симметрия кристаллов и их классификация
- •3.1 Элементы симметрии
- •Р исунок 3.1 - Центр симметрии
- •3.2 Взаимодействие между элементами симметрии в кристалле
- •3.3 Классификация кристаллов
- •Глава 4. Простые формы и их комбинации в кристаллах различных сингоний
- •4.1 Распределение простых форм по сингониям и категориям
- •Расшифровка комбинированных форм
- •Глава 5. Установка кристаллов. Определение индексов граней
- •5.1 Понятие о кристаллографических символах
- •Установка кристаллов
- •5.3 Закон Гаюи
- •5.4 Практические рекомендации по определению кристаллографических символов
- •Глава 6. Стереографические проекции кристаллов
- •6.1 Принципы стереографического проектирования
- •6.2 Проектирование элементов симметрии кристаллов
- •Глава 7. Изучение пространственной решетки
- •7.1 Решетки Браве
- •7.2 Определение формульной единицы
- •7.3 Координационные числа и координационные многогранники
- •Глава 8. Плотнейшие упаковки
- •8.1 Понятие о кристаллохимическом радиусе
- •8.2 Виды плотнейших упаковок в структурах
- •8.3 Доля заполненных пустот
- •Глава 9. Типы физико-химических связей в кристаллах
- •9.1 Типы кристаллических структур
- •9.2 Металлический тип связи
- •9.3 Ионная или гетерополярная связь
- •9.4 Ковалентная (гомеополярная) или атомная связь
- •9.6 Водородная связь
- •9.7 Явление поляризации в кристаллических телах
- •Глава 10. Полиморфизм, изоморфизм
- •10.1 Определение полиморфизма, его типы
- •10.2 Примеры полиморфных переходов
- •10.3. Полиморфные превращения в системе SiO2
- •10.4 Понятие об изоморфизме
- •10.5 Виды изоморфизма
- •Глава 11. Главнейшие типы кристаллических структур
- •11.1 Способы моделирования кристаллов. Метод координационных полиэдров
- •11.2 Понятие о структурном типе
- •11.3 Примеры основных структурных типов
- •Тема 12. Кремнекислородные структуры
- •12.1 Особенности строения силикатов
- •12.2 Состав силикатов в виде структурных формул
- •12.3 Классификация силикатов по типу кремнекислородных группировок (радикалов, мотивов)
- •12.4 Особенности структур кварца, тридимита, кристобалита
- •Глава 13. Дефекты кристаллической решетки
- •13.1 Классификация дефектов кристаллической решетки
- •13.2 Нульмерные (точечные) дефекты
- •13.3 Линейные дефекты
- •13.4 Свойства дислокации
- •13.5 Влияние дислокации на скорость роста кристаллов
- •Минералогия
- •Глава 14. Минералогия. Свойства минералов
- •14.1 Наука «минералогия» и объекты ее исследования. Написание формул минералов
- •14.2 Морфология минералов
- •14.3 Явление двойникования и эпитаксии в реальных кристаллах
- •14.4 Физико-химические свойства минералов
- •Тема 15. Геологические процессы образования минералов
- •15.1. Классификация минералов и горных пород по генезису
- •15.2.Эндогенные процессы образования минералов и пород
- •15.3 Экзогенные процессы минералообразования
- •15.4 Метаморфические процессы минералообразования
- •Глава 16. Классификация минералов. Особенности различных классов минералов
- •16.1 Классификация минералов по с.Д. Четверикову
- •16.2 Класс самородных элементов
- •16.3 Сульфиды. Сульфаты
- •16.4 Галоидные соединения. Бораты. Фосфаты
- •16.5 Карбонаты. Нитраты
- •16.6 Оксиды и гидроксиды
- •Глава 17. Силикаты
- •Основные сведения о силикатах
- •17.2 Островные силикаты
- •17.3 Цепочечные и ленточные силикаты
- •17.4 Слоистые силикаты
- •17.5 Каркасные силикаты
- •Литература
7.2 Определение формульной единицы
Формульная единица (Z) – это количество атомов, ионов, молекул, принадлежащих одной элементарной ячейке.
При подсчете формульной единицы следует учитывать следующее:
- атом, находящийся в вершине элементарной ячейки, принадлежит одновременно 8 ячейкам, поэтому одной ячейке он принадлежит на 1/8 часть;
- атом, лежащий на гране ячейки, принадлежит ячейке на ½ часть;
- атом, находящийся внутри ячейки, принадлежит ей нацело (то есть на единицу);
- атом, находящийся на ребре – на ¼ часть.
Количество атомов, принадлежащих 1-й элементарной ячейке для различных типов решеток Браве, рассчитывается следующим образом:
![]()
![]()
![]()
![]()
Связь между плотностью вещества d, количеством атомов, принадлежащих одной элементарной ячейке Z, и объемом ячейки V, выражается следующей формулой:
![]()
A – атомная масса вещества
mH - масса атома водорода, 1,6510-24 г
7.3 Координационные числа и координационные многогранники
Координационным числом называют число атомов или ионов противоположного знака, находящихся в ближайшем окружении атома или иона, принятого за центральный. Ближайшее окружение – атомы или ионы, находящиеся на минимально равных расстояниях от центрального атома. Геометрическая фигура, образующая при соединении центров атомов ближайшего окружения называется координационным многогранником.
Координационные числа в структурах кристаллов в значительной степени определяются природой сил, действующих между частицами, т.е. типом связи . Структуры металлоидов обладают наименьшими координационными числами 3-4 (ковалентная связь). Металлические структуры стремятся к высокой координации 12 и8 (металлическая связь). К высокой координации стремятся также и ионные кристаллы, в которых каждый ион старается окружить себя максимальным числом противоположно-заряженных частиц 6-8 (ионная связь)
Согласно правилу Гольдшмидта, устойчивость ионных структур определяется соотношением радиусов катионов к радиусу анионов. Устойчивой считается та структура, которая исключает соприкосновение одноименно заряженных сфер (рис. 7.2).
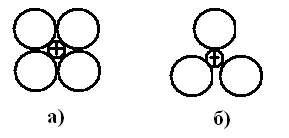
Рисунок 7.2 – Пример неустойчивой (а) и устойчивой (б) ионной структуры
Таблица 7.2 – Зависимость координационного числа и координационного многогранника от соотношения радиуса rк/ rа
Координационное число |
Координационный многогранник |
Пределы отношений rк/ rа |
2 |
Гантель |
0 ÷ 0,15 |
3 |
Треугольник |
0,15 ÷ 0,22 |
4 |
Тетраэдр |
0,22 ÷ 0,41 |
6 |
Октаэдр |
0,41 ÷ 0,73 |
8 |
Куб |
0,73 ÷ 1,0 |
12 |
Кубоктаэдр |
более 1,0 |
Капустинский А.Ф. 30-годах прошлого столетия высказал предположение, что в природе наиболее распространены соединения с четными к.ч.: 4,6,8,12. Нечетные к.ч. 3,5,7,9,11 – менее распространены и играют незначительную роль.
Координационные многогранника могут быть и более сложными по форме (например, трехшапочная тригональная призма, ромбододекаэдр, притупленный октаэдр и др.). Одному и тому же координационному числу могут соответствовать различные виды координационных многогранников. Например: к.ч. 6 – октаэдр и тетрагональная призма.
В простых бинарных соединениях по соотношениям координационных чисел можно определить химическую формулу, пользуясь правилом: обратные отношения координационных чисел соответствуют количеству элементов в химической формуле.
К
 .ч.
Si/O = 4 2
.ч.
Si/O = 4 2
К.ч. O/Si = 2 1
SiO2 – кварц
Таким образом, можно проверить правильность найденных координационных чисел или определить химическую формулу вещества.
