
- •Кафедра химической технологии переработки
- •Органическая химия
- •Москва, 2007
- •Введение
- •1. Основные теоретические положения органической химии
- •1.1. Классификация органических соединений
- •Органические соединения
- •Важнейшие классы органических соединений.
- •Названия наиболее часто встречающихся радикалов:
- •1.2. Номенклатура
- •1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
- •1.5 Типы органических реакций
- •1.6. Механизмы химических реакций
- •Рост стабильности радикалов
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •2. Алканы
- •Химические свойства
- •Алкены Общая характеристика
- •Химические свойства
- •Реакции присоединения (а)
- •4. Диеновые углеводороды (алкадиены или диолефины)
- •Химические свойства дивинила и его гомологов Реакции присоединения
- •Диеновые синтезы (синтезы Дильса-Альдера)
- •Реакции полимеризации
- •5. Алкины (непредельные углеводороды ряда ацетилена )
- •Реакции присоединения
- •Реакции окисления
- •Реакции замещения
- •6. Алициклические соединения
- •6.1 Химические свойства
- •6.2. «Теория напряжения» Байера
- •6.3. Пространственное расположение атомов углерода в циклопарафинах.
- •Оптическая изомерия
- •7. Ароматический ряд. Арены
- •7.1. Строение бензола
- •7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям
- •7.3. Химические свойства бензола
- •Реакции электрофильного замещения se
- •Механизм реакции электрофильного замещения
- •Влияние заместителей I-п рода на реакционную способность кольца и ориентацию при реакциях электрофильного замещения (sе)
- •Заместители I рода орто- и пара-ориентанты
- •Заместители п рода -мета ориентанты
- •8. Галогенопроизводные углеводородов
- •Галогенопроизводные предельных углеводородов (галогеналкилы)
- •Химические свойства
- •Галогенопроизводные непредельных углеводородов
- •Ароматические галогенопроизводные
- •Влияние заместителей в кольце на реакционную способность галогена
- •9. Кислородсодержащие соединения
- •9.1. Спирты Спирты алифатического ряда.
- •Реакции гидроксильного водорода.
- •Реакции гидроксила
- •Окисление
- •Одноатомные непредельные спирты
- •Химические свойства
- •Взаимодействие со щелочами
- •Реакции электрофильного замещения se
- •Влияние заместителей на кислотные свойства фенолов
- •Ароматические спирты
- •9.2 Альдегиды и кетоны
- •Альдегиды и кетоны алифатического ряда Общая характеристика
- •Влияние акцепторных групп
- •Окисление альдегидов и кетонов
- •Реакции конденсации (уплотнения)
- •Механизм реакции
- •Непредельные альдегиды и кетоны
- •Основные химические реакции
- •Ароматические альдегиды и кетоны
- •9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
- •Основные химические реакции
- •Непредельные карбоновые кислоты.
- •Свойства кислот
- •Двухосновные или дикарбоновые кислоты (предельные и непредельные).
- •Ароматические карбоновые кислоты
- •Кислотные свойства
- •Реакция этерификации
- •10. Нитросоединения Нитросоединения алифатического ряда r - nо2
- •Нитросоединения с нитрогруппой в боковой цепи
- •11. Аминосоединеиия
- •Ароматические амины Общая характеристика
- •Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
- •Реакции электрофильного замещения (sе)
- •12. Диазосоединения
- •Реакция диазотирования
- •Реакции солей диазония без выделения азота
- •Реакция сочетания с фенолом и ароматическими аминами
- •Влияние заместителей на реакцию азосочетания
- •13. Азосоединения
- •14. Вопросы для подготовки к зачету
- •Тема 1. Электрофильное и радикальное присоединение и замещение у алкенов. Элиминирование.
- •Тема 2. Нуклеофильные и радикальные (галогенирование, нитрование) реакции у насыщенного атома углерода
- •Тема 3. Окислительно-восстановительный процесс и дегидрирование
- •Тема 4. Электрофильное замещение в ароматических соединениях. Правила ориентации
- •Тема. 5. Нуклеофильное замещение у ароматических соединений. Кислотно-основные свойства органических соединений
- •Тема 6. Полимеризация, конденсация, поликонденсация. Диазосоединения и синтезы на их основе
- •15. Список рекомендуемой литературы Основной
- •Дополнительный
-
Алкены Общая характеристика
Химические свойства алкенов (олефинов или этиленовых углеводородов) определяет двойная углерод-углеродная связь. Углерод находится во II валентном состоянии sр2 -гибридизация.
Рассмотрим основные характеристики двойной связи:
|
Связь |
Длина, нм |
Энергия, кДж/моль |
Полярность, Кл • м |
Поляризуемость, см3 • моль |
|
C=С |
0,134 |
612,3 |
0 |
4,17 |
|
С–С |
0,154 |
346,9 |
0 |
1,29 |
Анализ таблицы показывает, что ;
1. σ-связь более прочная, чем π-связь.
2. π-электроны более чувствительны к влиянию внешнего электрического поля чем σ-связь. В присутствии заряженной частицы электронное облако π-связи легко смещается в сторону положительного заряда.
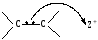
Следовательно: в определенных условиях π-связь может разрываться гетеролитически (по ионному механизму).
Химические свойства
Алкены вступают в реакции:
1. Присоединение по π-связи, наименее прочной и более реакционноспособной. Образующие ее π-электроны более доступны для реагента, чем электроны σ-связи.
2. Имеются реакции замещения ( S ) в аллильное положение.
![]()
Реакции присоединения (а)
Гидрирование. Следует подчеркнуть, что гидрирование алкенов протекает только в присутствии катализатора. Без катализатора водород Н2 или [H] в момент выделения не присоединяется к алкенам.
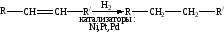
Галогенирование. К алкенам легко присоединяется галоген:
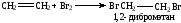
Легче идет присоединение Сl2, труднее J2. Следует подчеркнуть, что в зависимости от условий реакция может идти по радикальному или ионному механизмам.
Механизм радикального присоединения
Под действием света, при нагревании или в присутствии других радикалов реакция присоединения протекает по радикальному (гомолити-ческому) механизму.
Первая стадия – инициирование:
![]()
Вторая стадия – рост цепи:
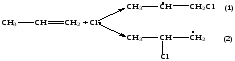
Реакция (1) – основная, идет через образование стабильного вторичного радикала.
Третья стадия – обрыв цепи:
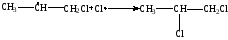
Механизм ионного присоединения
Галоген
и олефин в темноте не взаимодействуют,
но если взять влажные продукты, то
реакция идет даже в темноте. Н2О
вызывает поляризацию галогена, при этом
ка-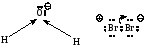
тион Br+ является более активной частицей.
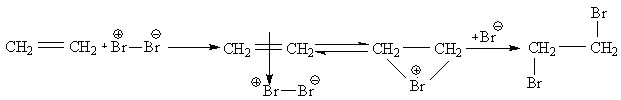 π-комплекс бромониевый
ион
π-комплекс бромониевый
ион
Получаются только трансизомеры, т.к. анион Br– не может присоединиться к той стороне где уже имеется Br.
Гидрогалогенирование. Галогеноводороды легко присоединяются к олефинам. В зависимости от условий реакция может протекать по ионному или радикальному механизмам. При взаимодействии жидких веществ в присутствии кислоты или основания в растворе воды или какого – либо полярного растворителя наиболее вероятным является ионный механизм реакции.
Механизм ионного (электрофильного) присоединения
Рассмотрим взаимодействие пропилена (несимметричного олефина) с бромводородом. НBr диссоциирует в воде с образованием протона, который и взаимодействует с электронами p-связи пропилена:
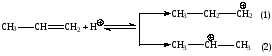
Предпочтительнее протекание реакции (2), с образованием более устойчивого вторичного карбкатиона, который затем взаимодействует с анионом Br -.
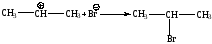
В результате образуется вторичный алкилгалогенид.
Такая специфичность присоединения к несимметричным алкенам известна под названием правила Марковникова – реакция присоединения к атому углерода в олефине протекает с образованием наиболее устойчивого промежуточного карбкатиона.
Правило Марковникова соблюдается только при ионном (гетеролитическом) механизме присоединения.
Если реакцию инициирует свет, высокая температура или вещества, образующие при разложении свободные радикалы (H2O2, O2, R-O-O-R и др.) она протекает по радикальному механизму.
Механизм радикального присоединения
(перекисный эффект Караша )
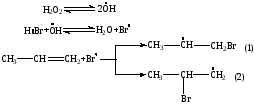
Основное направление реакции – 1, т.к. образуется более стабильный вторичный радикал:
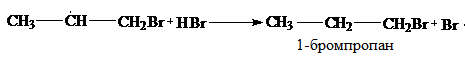
Первичный алкилгалогенид (1-бромпропан) является основным продуктом этой реакции, вторичный алкилгалогенид ( 2-бромпропан ) и вторичный спирт ( пропанол –2 ) – побочными.
