- •Кафедра химической технологии переработки
- •Органическая химия
- •Москва, 2007
- •Введение
- •1. Основные теоретические положения органической химии
- •1.1. Классификация органических соединений
- •Органические соединения
- •Важнейшие классы органических соединений.
- •Названия наиболее часто встречающихся радикалов:
- •1.2. Номенклатура
- •1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
- •1.5 Типы органических реакций
- •1.6. Механизмы химических реакций
- •Рост стабильности радикалов
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •2. Алканы
- •Химические свойства
- •Алкены Общая характеристика
- •Химические свойства
- •Реакции присоединения (а)
- •4. Диеновые углеводороды (алкадиены или диолефины)
- •Химические свойства дивинила и его гомологов Реакции присоединения
- •Диеновые синтезы (синтезы Дильса-Альдера)
- •Реакции полимеризации
- •5. Алкины (непредельные углеводороды ряда ацетилена )
- •Реакции присоединения
- •Реакции окисления
- •Реакции замещения
- •6. Алициклические соединения
- •6.1 Химические свойства
- •6.2. «Теория напряжения» Байера
- •6.3. Пространственное расположение атомов углерода в циклопарафинах.
- •Оптическая изомерия
- •7. Ароматический ряд. Арены
- •7.1. Строение бензола
- •7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям
- •7.3. Химические свойства бензола
- •Реакции электрофильного замещения se
- •Механизм реакции электрофильного замещения
- •Влияние заместителей I-п рода на реакционную способность кольца и ориентацию при реакциях электрофильного замещения (sе)
- •Заместители I рода орто- и пара-ориентанты
- •Заместители п рода -мета ориентанты
- •8. Галогенопроизводные углеводородов
- •Галогенопроизводные предельных углеводородов (галогеналкилы)
- •Химические свойства
- •Галогенопроизводные непредельных углеводородов
- •Ароматические галогенопроизводные
- •Влияние заместителей в кольце на реакционную способность галогена
- •9. Кислородсодержащие соединения
- •9.1. Спирты Спирты алифатического ряда.
- •Реакции гидроксильного водорода.
- •Реакции гидроксила
- •Окисление
- •Одноатомные непредельные спирты
- •Химические свойства
- •Взаимодействие со щелочами
- •Реакции электрофильного замещения se
- •Влияние заместителей на кислотные свойства фенолов
- •Ароматические спирты
- •9.2 Альдегиды и кетоны
- •Альдегиды и кетоны алифатического ряда Общая характеристика
- •Влияние акцепторных групп
- •Окисление альдегидов и кетонов
- •Реакции конденсации (уплотнения)
- •Механизм реакции
- •Непредельные альдегиды и кетоны
- •Основные химические реакции
- •Ароматические альдегиды и кетоны
- •9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
- •Основные химические реакции
- •Непредельные карбоновые кислоты.
- •Свойства кислот
- •Двухосновные или дикарбоновые кислоты (предельные и непредельные).
- •Ароматические карбоновые кислоты
- •Кислотные свойства
- •Реакция этерификации
- •10. Нитросоединения Нитросоединения алифатического ряда r - nо2
- •Нитросоединения с нитрогруппой в боковой цепи
- •11. Аминосоединеиия
- •Ароматические амины Общая характеристика
- •Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
- •Реакции электрофильного замещения (sе)
- •12. Диазосоединения
- •Реакция диазотирования
- •Реакции солей диазония без выделения азота
- •Реакция сочетания с фенолом и ароматическими аминами
- •Влияние заместителей на реакцию азосочетания
- •13. Азосоединения
- •14. Вопросы для подготовки к зачету
- •Тема 1. Электрофильное и радикальное присоединение и замещение у алкенов. Элиминирование.
- •Тема 2. Нуклеофильные и радикальные (галогенирование, нитрование) реакции у насыщенного атома углерода
- •Тема 3. Окислительно-восстановительный процесс и дегидрирование
- •Тема 4. Электрофильное замещение в ароматических соединениях. Правила ориентации
- •Тема. 5. Нуклеофильное замещение у ароматических соединений. Кислотно-основные свойства органических соединений
- •Тема 6. Полимеризация, конденсация, поликонденсация. Диазосоединения и синтезы на их основе
- •15. Список рекомендуемой литературы Основной
- •Дополнительный
9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
Кислотный характер карбоновых кислот ярко выражен, так как электроотрицательный кислород карбонильной группы смещает π - электронную плотность таким образом, что на углеродном атоме карбонила появляется заряд +δ . Это вызывает смещение неподеленной пары электронов атома кислорода гидроксильной группы в сторону атома С, что в свою очередь, приводит к перемещению электронной плотности связи О – Н в сторону кислорода. В результате этого облегчается отрыв атома водорода в виде протона – происходит процесс кислотной диссоциации:

Рентгеноструктурные исследования показали, что в карбоксилат анионе оба кислорода равноценны, электронная плотность в нем распределена равномерно. Схематически это можно представить так:

Сравним константы диссоциации различных кислот:
|
|
Константа диссоциации |
|
|
Муравьиная |
|
2,14 х 10-4 |
|
Уксусная |
|
1,76 х 10-5 |
|
Пропановая |
|
1,33 х 10 -5 |
|
Угольная |
|
4,4 х 10 -7 |
|
Фосфорная |
|
7,6 х 10 -3 |
|
Спирт |
|
~10-18 |
Из таблицы видно, что:
1) органические карбоновые кислоты слабее минеральной Н3Р04 , но сильнее угольной Н2СОз. Их кислотные свойства выражены сильнее, чем у спирта;
2) электронодонорные группы (-СН3 и др.) уменьшают кислотность, так как проявляют +I эф, уменьшая частичный положительный заряд +δ на углероде, подвижность водорода также уменьшается.
Рассмотрим влияние электроноакцепторных групп:

+δ4 >+δ3 > +δ2 > +δ1
Галогены - электроноакцепторные атомы, оттягивая электроны, увеличивают частичный положительный заряд +δ на углероде и, следовательно, подвижность атома_водорода увеличивается.
Основные химические реакции
Характерная особенность карбоновых кислот - способность образовывать со спиртами в присутствии минеральных кислот сложные эфиры - реакция этерификации.
Отметим, что с помощью меченых атомов было показано, что вода образуется за счет водорода спирта и гидроксила кислоты:
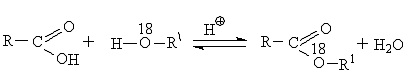
О18 - тяжелый изотоп кислорода
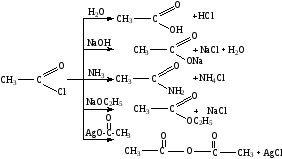
Замещение гидроксильных групп в карбоновых кислотах приводит к образованию галогенангидридов, обладающих высокой реакционной способностью:

Атом галогена, связанный с группой –С=О, чрезвычайно подвижен и легко вступает в реакции обмена. Это происходит при взаимодействии галогенангидридов с соединениями, содержащими атом металла или активный (подвижный) водород. Такие реакции называются ацилированием, так как они позволяют ввести в молекулы многих веществ ацильный радикал. Например: