
- •Кафедра химической технологии переработки
- •Органическая химия
- •Москва, 2007
- •Введение
- •1. Основные теоретические положения органической химии
- •1.1. Классификация органических соединений
- •Органические соединения
- •Важнейшие классы органических соединений.
- •Названия наиболее часто встречающихся радикалов:
- •1.2. Номенклатура
- •1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
- •1.5 Типы органических реакций
- •1.6. Механизмы химических реакций
- •Рост стабильности радикалов
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •2. Алканы
- •Химические свойства
- •Алкены Общая характеристика
- •Химические свойства
- •Реакции присоединения (а)
- •4. Диеновые углеводороды (алкадиены или диолефины)
- •Химические свойства дивинила и его гомологов Реакции присоединения
- •Диеновые синтезы (синтезы Дильса-Альдера)
- •Реакции полимеризации
- •5. Алкины (непредельные углеводороды ряда ацетилена )
- •Реакции присоединения
- •Реакции окисления
- •Реакции замещения
- •6. Алициклические соединения
- •6.1 Химические свойства
- •6.2. «Теория напряжения» Байера
- •6.3. Пространственное расположение атомов углерода в циклопарафинах.
- •Оптическая изомерия
- •7. Ароматический ряд. Арены
- •7.1. Строение бензола
- •7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям
- •7.3. Химические свойства бензола
- •Реакции электрофильного замещения se
- •Механизм реакции электрофильного замещения
- •Влияние заместителей I-п рода на реакционную способность кольца и ориентацию при реакциях электрофильного замещения (sе)
- •Заместители I рода орто- и пара-ориентанты
- •Заместители п рода -мета ориентанты
- •8. Галогенопроизводные углеводородов
- •Галогенопроизводные предельных углеводородов (галогеналкилы)
- •Химические свойства
- •Галогенопроизводные непредельных углеводородов
- •Ароматические галогенопроизводные
- •Влияние заместителей в кольце на реакционную способность галогена
- •9. Кислородсодержащие соединения
- •9.1. Спирты Спирты алифатического ряда.
- •Реакции гидроксильного водорода.
- •Реакции гидроксила
- •Окисление
- •Одноатомные непредельные спирты
- •Химические свойства
- •Взаимодействие со щелочами
- •Реакции электрофильного замещения se
- •Влияние заместителей на кислотные свойства фенолов
- •Ароматические спирты
- •9.2 Альдегиды и кетоны
- •Альдегиды и кетоны алифатического ряда Общая характеристика
- •Влияние акцепторных групп
- •Окисление альдегидов и кетонов
- •Реакции конденсации (уплотнения)
- •Механизм реакции
- •Непредельные альдегиды и кетоны
- •Основные химические реакции
- •Ароматические альдегиды и кетоны
- •9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
- •Основные химические реакции
- •Непредельные карбоновые кислоты.
- •Свойства кислот
- •Двухосновные или дикарбоновые кислоты (предельные и непредельные).
- •Ароматические карбоновые кислоты
- •Кислотные свойства
- •Реакция этерификации
- •10. Нитросоединения Нитросоединения алифатического ряда r - nо2
- •Нитросоединения с нитрогруппой в боковой цепи
- •11. Аминосоединеиия
- •Ароматические амины Общая характеристика
- •Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
- •Реакции электрофильного замещения (sе)
- •12. Диазосоединения
- •Реакция диазотирования
- •Реакции солей диазония без выделения азота
- •Реакция сочетания с фенолом и ароматическими аминами
- •Влияние заместителей на реакцию азосочетания
- •13. Азосоединения
- •14. Вопросы для подготовки к зачету
- •Тема 1. Электрофильное и радикальное присоединение и замещение у алкенов. Элиминирование.
- •Тема 2. Нуклеофильные и радикальные (галогенирование, нитрование) реакции у насыщенного атома углерода
- •Тема 3. Окислительно-восстановительный процесс и дегидрирование
- •Тема 4. Электрофильное замещение в ароматических соединениях. Правила ориентации
- •Тема. 5. Нуклеофильное замещение у ароматических соединений. Кислотно-основные свойства органических соединений
- •Тема 6. Полимеризация, конденсация, поликонденсация. Диазосоединения и синтезы на их основе
- •15. Список рекомендуемой литературы Основной
- •Дополнительный
Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
NO2 –группа за счет мезомерного эффекта сопряжения ( М) оттягивает электроны из кольца на себя. Электронная плотность в кольце понижается, это приводит к тому, что сопряжение свободных электоронов атома азота в NН2 – группе с кольцом увеличивается и способность притянуть протон, т.е. основной характер уменьшается.
Донорный заместитель увеличивает основность
Электронная
плотность в кольце увеличивается за
счет мезомерного эффекта сопряжения
электронов кислородного атома ОН–группы
с кольцом, это приводит к тому, что
сопряжение свободных электоронов атома
азота в NН2–
группе с кольцом уменьшается, способность
притянуть протон, а следовательно
основность увеличивается.
Реакции электрофильного замещения (sе)
Ароматические амины легко вступают в реакции нитрования, галогенирования, сульфирования, т.к. NH2– группа является заместителем 1 рода (орто- и пара- ориентант).
Однако, в кислой среде аминогруппа переходит в аммонийную группу, которая является уже ориентантом II рода и направляет электрофилъную частицу Е+ в мета-положение:

Для получения о – и n - изомеров необходимо провести "защиту" аминогруппы, в основе которой лежит реакция ацилирования:

Галогенирование анилина свободными галогенами обычно также дает смесь продуктов различной степени замещения и сопровождения окислением. Поэтому галогенируют не сами амины, а их ацильные производные:

Сульфирование
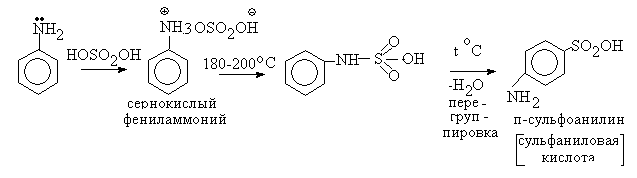
Сульфаниловая
кислота - соединение
с 2 различными функциональными группами
(NH2
- основные свойства, SO2OH
- кислые).
Поэтому это соединение существует
в виде внутренней соли:
12. Диазосоединения
Ароматические диазосоединения - вещества, содержащие азогруппу ––N=N–, связанную одновременно с ароматическим радика- лом и остатком сильной кислоты (чаще с галогеном) или гидроксилом.
Важнейшие
представители этого класса
соли диазония – хлорид фенилдиазония
(солянокислый фенилдиазония).
Реакция диазотирования
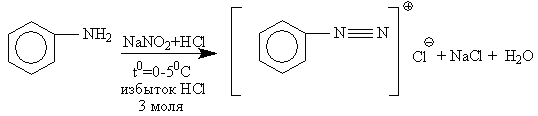
Механизм реакции можно представить следующим образом:
в водном растворе азотистая кислота в сильно кислой среде образует несколько диазотирующих электронных агентов:

При взаимодействии с анилином нитрозамин превращается в свою таутомерную форму диазогидрат, который при действии кислоты переходит в соль диазония.
Скорость процесса определяет стадия присоединения электрофильной частицы.
В зависимости от рН среды диазосоединения существует в двух таутомерных формах: в кислой среде — в виде солей диазония, в щелочной — диазогидрата.

Диазогидраты, в свою очередь, в зависимости от рН среды также могут существовать в двух разных таутомерных формах:
Слабощелочная Сильнощелочная

Реакции солей диазония без выделения азота
1. Восстановление диазосоединений:

Используется при производстве красящих веществ и лекарств
2. Взаимодействие с первичными ароматическими аминами:

В нейтральной и слабокислой среде азогруппа вступает не в ароматическое ядро, а в аминогруппу.
