
- •Кафедра химической технологии переработки
- •Органическая химия
- •Москва, 2007
- •Введение
- •1. Основные теоретические положения органической химии
- •1.1. Классификация органических соединений
- •Органические соединения
- •Важнейшие классы органических соединений.
- •Названия наиболее часто встречающихся радикалов:
- •1.2. Номенклатура
- •1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
- •1.5 Типы органических реакций
- •1.6. Механизмы химических реакций
- •Рост стабильности радикалов
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •2. Алканы
- •Химические свойства
- •Алкены Общая характеристика
- •Химические свойства
- •Реакции присоединения (а)
- •4. Диеновые углеводороды (алкадиены или диолефины)
- •Химические свойства дивинила и его гомологов Реакции присоединения
- •Диеновые синтезы (синтезы Дильса-Альдера)
- •Реакции полимеризации
- •5. Алкины (непредельные углеводороды ряда ацетилена )
- •Реакции присоединения
- •Реакции окисления
- •Реакции замещения
- •6. Алициклические соединения
- •6.1 Химические свойства
- •6.2. «Теория напряжения» Байера
- •6.3. Пространственное расположение атомов углерода в циклопарафинах.
- •Оптическая изомерия
- •7. Ароматический ряд. Арены
- •7.1. Строение бензола
- •7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям
- •7.3. Химические свойства бензола
- •Реакции электрофильного замещения se
- •Механизм реакции электрофильного замещения
- •Влияние заместителей I-п рода на реакционную способность кольца и ориентацию при реакциях электрофильного замещения (sе)
- •Заместители I рода орто- и пара-ориентанты
- •Заместители п рода -мета ориентанты
- •8. Галогенопроизводные углеводородов
- •Галогенопроизводные предельных углеводородов (галогеналкилы)
- •Химические свойства
- •Галогенопроизводные непредельных углеводородов
- •Ароматические галогенопроизводные
- •Влияние заместителей в кольце на реакционную способность галогена
- •9. Кислородсодержащие соединения
- •9.1. Спирты Спирты алифатического ряда.
- •Реакции гидроксильного водорода.
- •Реакции гидроксила
- •Окисление
- •Одноатомные непредельные спирты
- •Химические свойства
- •Взаимодействие со щелочами
- •Реакции электрофильного замещения se
- •Влияние заместителей на кислотные свойства фенолов
- •Ароматические спирты
- •9.2 Альдегиды и кетоны
- •Альдегиды и кетоны алифатического ряда Общая характеристика
- •Влияние акцепторных групп
- •Окисление альдегидов и кетонов
- •Реакции конденсации (уплотнения)
- •Механизм реакции
- •Непредельные альдегиды и кетоны
- •Основные химические реакции
- •Ароматические альдегиды и кетоны
- •9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
- •Основные химические реакции
- •Непредельные карбоновые кислоты.
- •Свойства кислот
- •Двухосновные или дикарбоновые кислоты (предельные и непредельные).
- •Ароматические карбоновые кислоты
- •Кислотные свойства
- •Реакция этерификации
- •10. Нитросоединения Нитросоединения алифатического ряда r - nо2
- •Нитросоединения с нитрогруппой в боковой цепи
- •11. Аминосоединеиия
- •Ароматические амины Общая характеристика
- •Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
- •Реакции электрофильного замещения (sе)
- •12. Диазосоединения
- •Реакция диазотирования
- •Реакции солей диазония без выделения азота
- •Реакция сочетания с фенолом и ароматическими аминами
- •Влияние заместителей на реакцию азосочетания
- •13. Азосоединения
- •14. Вопросы для подготовки к зачету
- •Тема 1. Электрофильное и радикальное присоединение и замещение у алкенов. Элиминирование.
- •Тема 2. Нуклеофильные и радикальные (галогенирование, нитрование) реакции у насыщенного атома углерода
- •Тема 3. Окислительно-восстановительный процесс и дегидрирование
- •Тема 4. Электрофильное замещение в ароматических соединениях. Правила ориентации
- •Тема. 5. Нуклеофильное замещение у ароматических соединений. Кислотно-основные свойства органических соединений
- •Тема 6. Полимеризация, конденсация, поликонденсация. Диазосоединения и синтезы на их основе
- •15. Список рекомендуемой литературы Основной
- •Дополнительный
1.5 Типы органических реакций
Все химические реакции сопровождаются разрывом одних химических связей и возникновением других. Распад ковалентной связи между двумя атомами может протекать с образованием свободных радикалов - гомолитический или ионов - гетеролитический распад.
Гомолитический или радикальный распад ковалентной связи можно представить следующей схемой:
А• | • В = А• +• В
Активный свет, кислород и другие радикалы способствуют гомолитическому распаду молекул. Свободные радикалы имеют неспаренный (холостой) электрон; они образуются, главным образом, в газовой фазе, т.е. при нагревании, и в растворах неполярных растворителей. Открыть их присутствие в реакционной системе можно с использованием методов электронной спектроскопии.
Гетеролитический или ионный распад связи схематически можно описать следующим образом:
А : ) В ↔ А:−+В+
или А ( : В ↔ А + + : В−
При разрыве связи одна их частей молекулы захватывает оба электрона ковалентной связи, образуются отрицательные карбанионы и карбкатионы. Ионный распад происходит в присутствии катализаторов А1С13,FеС13и др. кислот Льюиса, протекает в полярных растворителях, на холоде и в темноте.
По характеру химических превращений можно выделить три основных типа реакций.
Реакции замещения S (S - от англ. Substitution):
CH4+Cl2→CH3Cl+HCl
хлорметан
Реакции присоединения А (А - от англ. Addition - присоединение):
CH2=CH2+Br2→CH2Br-CH2Br
1,2-дибромэтан
К реакциям присоединения относят и реакции восстановления (присоединение атомов водорода): [ Н]

ацетон изопропиловый спирт
К этому типу реакций можно также отнести реакции полимеризации, когда в результате присоединения друг к другу большого числа простых веществ (мономеров) образуется новое вещество сложного строения с большей молекулярной массой:
n CH2=CH2 → [-CH2-CH2-]n
Сюда относят также реакции конденсации и поликонденсации, когда образуется более сложное вещество в результате соединения нескольких молекул и выделения простых веществ (воды, аммиака и др.):
HO-CH2-CH2-OH + HO-CH2-CH2-OH→HO-CH2-CH2-O-CH2-CH2-OH
этиленгликоль -H2O димер этиленгликоля
n HO-CH2-CH2-OH → [-CH2-CH2-O-]n + n H2O
Реакции отщепления (элиминирования) Е (Е-от англ. Elimination-исключение, устранение):
Н+,t
CH3-CH2-CH2OH → CH3 -CH=CH2 + H2O
Однако химические реакции удобнее классифицировать по механизмам.
1.6. Механизмы химических реакций
С электронной точки зрения под механизмом химической реакции понимают способ нарушения валентных связей в молекулах и последовательность состояний, через которые проходят реагирующие вещества до превращения в продукты реакций, т. е. подробную, схему реакции. Выяснение механизма реакции необходимо для выбора оптимальных технологических условий ведения процесса.
В зависимости от характера атакующего реагента и природы связей в реагирующей молекуле реакция может протекать по двум основным механизмам:
- гетеролитическому или ионному;
- гомолитическому или радикальному.
Рассмотрим более подробно классификацию химических реакций в зависимости от атакующей частицы.
Пример 1: Реакция - замещения S.
Реагент - электрофильный Е+
A++:B-+E+→ A++B:E
или A:-+B++E+→ A:E+B+
Электрофильный или элетроноакцепторный реагент Е+ для образования новой связи использует пару электронов, принадлежащую реагирующей молекуле.
Электрофилы или электроноакцепторы:
катионы – H+,Cl+,NO2+,SO3H+,R+,R-C+=O;
молекулы со свободными орбиталями – AlCl3, FeCl3, ZnCl3, BF3.
Реакции, идущие с участием таких реагентов, называются электрофильными. Это могут быть реакции замещения, присоединения и отщепления. Пример 2: Реакция - замещения S.
Реагент - нуклеофильный Nu:
A+ + :В- + Nu:- → A:Nu + :В-
или А:-+ В + + Nu:- → А:- + B:Nu
Нуклеофильный реагент для образования новой связи предоставляет электронную пару.
Нуклеофилы или электронодоноры:
анионы - НО - , RO -, Cl-, RCOO -, CN -, R-, NH2- ;
молекулы, содержащие атомы с неподеленными электронными парами – H2O, C2H5O Н.
Реакции, идущие с участием этих реагентов, называются нуклеофильными. Это могут быть реакции замещения, присоединения и отщепления.
Пример 3: Реакция - замещения S.
Реагент - радикал Х•.
А • | • В + Х • → А••X + В•
или А •│• В + Х • → А• + В••Х
По радикальному механизму могут протекать реакции замещения, присоединения или отщепления. Однако, реакции присоединения и отщепления чаще всего протекают по ионному (гетеролитическому) механизму.
Устойчивость радикалов и ионов карбония
Место вступления реагента в молекулу углеводорода определяется вероятностью образования и стабильностью возникающего радикала или иона.
Изменение устойчивости радикалов при переходе от первичного радикала к третичному:
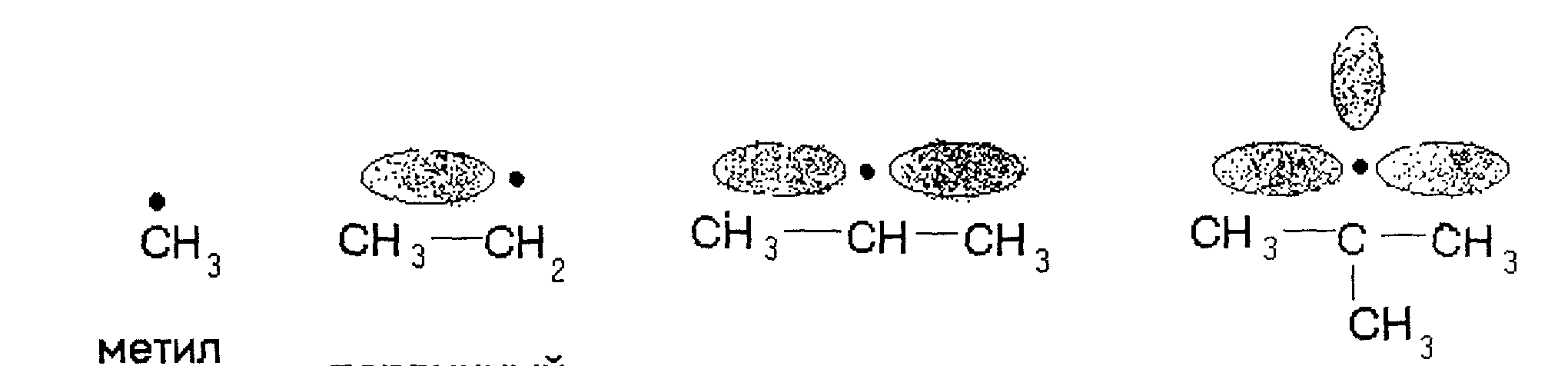
первичный вторичный третичный
