
- •Кафедра химической технологии переработки
- •Органическая химия
- •Москва, 2007
- •Введение
- •1. Основные теоретические положения органической химии
- •1.1. Классификация органических соединений
- •Органические соединения
- •Важнейшие классы органических соединений.
- •Названия наиболее часто встречающихся радикалов:
- •1.2. Номенклатура
- •1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
- •1.5 Типы органических реакций
- •1.6. Механизмы химических реакций
- •Рост стабильности радикалов
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •2. Алканы
- •Химические свойства
- •Алкены Общая характеристика
- •Химические свойства
- •Реакции присоединения (а)
- •4. Диеновые углеводороды (алкадиены или диолефины)
- •Химические свойства дивинила и его гомологов Реакции присоединения
- •Диеновые синтезы (синтезы Дильса-Альдера)
- •Реакции полимеризации
- •5. Алкины (непредельные углеводороды ряда ацетилена )
- •Реакции присоединения
- •Реакции окисления
- •Реакции замещения
- •6. Алициклические соединения
- •6.1 Химические свойства
- •6.2. «Теория напряжения» Байера
- •6.3. Пространственное расположение атомов углерода в циклопарафинах.
- •Оптическая изомерия
- •7. Ароматический ряд. Арены
- •7.1. Строение бензола
- •7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям
- •7.3. Химические свойства бензола
- •Реакции электрофильного замещения se
- •Механизм реакции электрофильного замещения
- •Влияние заместителей I-п рода на реакционную способность кольца и ориентацию при реакциях электрофильного замещения (sе)
- •Заместители I рода орто- и пара-ориентанты
- •Заместители п рода -мета ориентанты
- •8. Галогенопроизводные углеводородов
- •Галогенопроизводные предельных углеводородов (галогеналкилы)
- •Химические свойства
- •Галогенопроизводные непредельных углеводородов
- •Ароматические галогенопроизводные
- •Влияние заместителей в кольце на реакционную способность галогена
- •9. Кислородсодержащие соединения
- •9.1. Спирты Спирты алифатического ряда.
- •Реакции гидроксильного водорода.
- •Реакции гидроксила
- •Окисление
- •Одноатомные непредельные спирты
- •Химические свойства
- •Взаимодействие со щелочами
- •Реакции электрофильного замещения se
- •Влияние заместителей на кислотные свойства фенолов
- •Ароматические спирты
- •9.2 Альдегиды и кетоны
- •Альдегиды и кетоны алифатического ряда Общая характеристика
- •Влияние акцепторных групп
- •Окисление альдегидов и кетонов
- •Реакции конденсации (уплотнения)
- •Механизм реакции
- •Непредельные альдегиды и кетоны
- •Основные химические реакции
- •Ароматические альдегиды и кетоны
- •9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
- •Основные химические реакции
- •Непредельные карбоновые кислоты.
- •Свойства кислот
- •Двухосновные или дикарбоновые кислоты (предельные и непредельные).
- •Ароматические карбоновые кислоты
- •Кислотные свойства
- •Реакция этерификации
- •10. Нитросоединения Нитросоединения алифатического ряда r - nо2
- •Нитросоединения с нитрогруппой в боковой цепи
- •11. Аминосоединеиия
- •Ароматические амины Общая характеристика
- •Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
- •Реакции электрофильного замещения (sе)
- •12. Диазосоединения
- •Реакция диазотирования
- •Реакции солей диазония без выделения азота
- •Реакция сочетания с фенолом и ароматическими аминами
- •Влияние заместителей на реакцию азосочетания
- •13. Азосоединения
- •14. Вопросы для подготовки к зачету
- •Тема 1. Электрофильное и радикальное присоединение и замещение у алкенов. Элиминирование.
- •Тема 2. Нуклеофильные и радикальные (галогенирование, нитрование) реакции у насыщенного атома углерода
- •Тема 3. Окислительно-восстановительный процесс и дегидрирование
- •Тема 4. Электрофильное замещение в ароматических соединениях. Правила ориентации
- •Тема. 5. Нуклеофильное замещение у ароматических соединений. Кислотно-основные свойства органических соединений
- •Тема 6. Полимеризация, конденсация, поликонденсация. Диазосоединения и синтезы на их основе
- •15. Список рекомендуемой литературы Основной
- •Дополнительный
7.1. Строение бензола
В бензоле все атомы углерода находятся в sp2 -гибридном состоянии.
Все σ-связи молекулы лежат в одной плоскости, а 6р — электронов, перекрываясь, образуют единое π-электронное облако с максимальной плотностью над и под кольцом. Все σ-С-С связи в бензоле имеют одинаковую длину.
Длина σ-С-С связи: бензол 0,140 нм
этан СН3- СН3 0,154 нм
этилен СН2= СН2 0,134 нм
Вывод:
длина связи С-С в бензоле короче
одинарной, но длиннее двойной. Равномерное
перекрывание соседних р - орбиталей
приводит:
1. К «выравниванию» одинарных и двойных связей. Связи С-С в бензоле не похожи ни на одинарные, ни на двойные связи, что и объясняет тот факт, что бензол при обычных условиях не вступает в реакции, характерные для непредельных углеводородов.
2. Существенно уменьшается энергия молекулы, выигрыш энергии за счет сопряжения составляет 36 ккал/моль и называется энергией сопряжения.
Все процессы и реакции, приводящие к образованию ароматической структуры, энергетически выгодны, так как образующиеся соединения термодинамически более устойчивы.
Например: реакция диспропорционирования циклогексена

С высокой энергией сопряжения связана и способность ароматических соединений вступать в реакции замещения, а не присоединения:
реакция
присоединения

реакция замещения

Термодинамически более выгодна 2-я реакция, так как идет с меньшей затратой энергии.
Вывод: главная причина особых свойств ароматических соединений заключается в исключительной устойчивости их молекулы, что обусловлено высокой энергией делокализации или сопряжения.
7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям

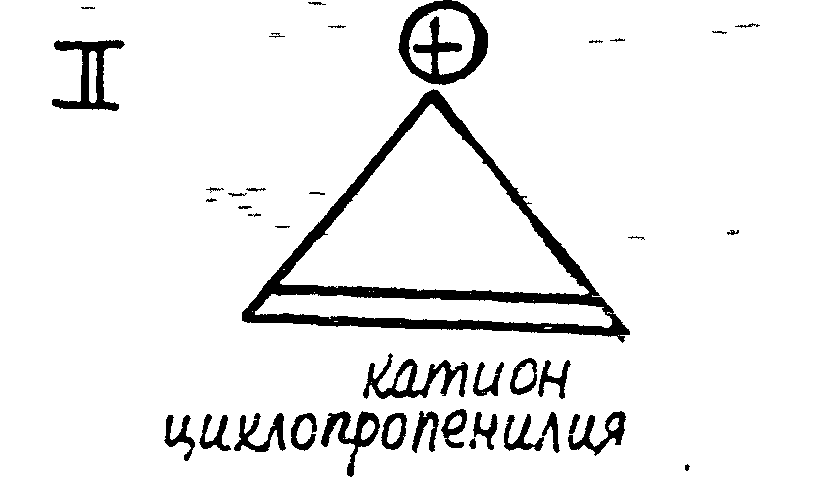

-
π-орбитали двойной связи перекрываются с р - орбиталью атома азота N, занятой неподеленной парой электронов. Соединения ароматичны.
-
Орбиталь двойной связи перекрывается со свободной орбиталью электронодефицитного атома углерода. В результате электронное облако π - связи «размазано» по всей молекуле. Соединение ароматично.
-
Ароматический характер не проявляется, так как нарушена непрерывная цепь сопряжения.
Вывод: для того, чтобы соединение проявляло ароматический характер оно должно обладать циклической системой с непрерывной цепью сопряжения. Это условие необходимо, но недостаточно.
Ароматическим характером обладают только циклические системы с непрерывной цепью сопряжения, содержащие (4n + 2) - электронов, где n = 0,1,2,3 и т.д. Другими словами число π -электронов должно быть равно 2, 6, 10 .... и т.д. (правило Хюккеля).
Математическими расчетами показано, что система с таким числом π - электронов обладает минимумом свободной энергии.
Например:



(1) (2) (3)
1) Имеется только 4π -электрона. Надо (4x1 + 2) = 6 электронов. Поэтому, хотя цепь сопряжения и непрерывна, соединение не является ароматическим.
2) Имеются необходимые 6π –электронов. Но непрерывная цепь сопряжения отсутствует. Следовательно: соединение неароматично.
3) Имеется 6 π - электронов(4 π – электрона двойной связи +2р- электрона атома кислорода). Цепь сопряжения непрерывна. Следовательно соединение ароматично.

циклопентадиен анион циклопентадиенилия
Эта реакция возможна, так как неароматическое соединение превращается в ароматическое соединение - анион циклопентадиенилия, в котором 6р - электронов имеет непрерывную цепь сопряжения.
