
- •Кафедра химической технологии переработки
- •Органическая химия
- •Москва, 2007
- •Введение
- •1. Основные теоретические положения органической химии
- •1.1. Классификация органических соединений
- •Органические соединения
- •Важнейшие классы органических соединений.
- •Названия наиболее часто встречающихся радикалов:
- •1.2. Номенклатура
- •1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
- •1.5 Типы органических реакций
- •1.6. Механизмы химических реакций
- •Рост стабильности радикалов
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •2. Алканы
- •Химические свойства
- •Алкены Общая характеристика
- •Химические свойства
- •Реакции присоединения (а)
- •4. Диеновые углеводороды (алкадиены или диолефины)
- •Химические свойства дивинила и его гомологов Реакции присоединения
- •Диеновые синтезы (синтезы Дильса-Альдера)
- •Реакции полимеризации
- •5. Алкины (непредельные углеводороды ряда ацетилена )
- •Реакции присоединения
- •Реакции окисления
- •Реакции замещения
- •6. Алициклические соединения
- •6.1 Химические свойства
- •6.2. «Теория напряжения» Байера
- •6.3. Пространственное расположение атомов углерода в циклопарафинах.
- •Оптическая изомерия
- •7. Ароматический ряд. Арены
- •7.1. Строение бензола
- •7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям
- •7.3. Химические свойства бензола
- •Реакции электрофильного замещения se
- •Механизм реакции электрофильного замещения
- •Влияние заместителей I-п рода на реакционную способность кольца и ориентацию при реакциях электрофильного замещения (sе)
- •Заместители I рода орто- и пара-ориентанты
- •Заместители п рода -мета ориентанты
- •8. Галогенопроизводные углеводородов
- •Галогенопроизводные предельных углеводородов (галогеналкилы)
- •Химические свойства
- •Галогенопроизводные непредельных углеводородов
- •Ароматические галогенопроизводные
- •Влияние заместителей в кольце на реакционную способность галогена
- •9. Кислородсодержащие соединения
- •9.1. Спирты Спирты алифатического ряда.
- •Реакции гидроксильного водорода.
- •Реакции гидроксила
- •Окисление
- •Одноатомные непредельные спирты
- •Химические свойства
- •Взаимодействие со щелочами
- •Реакции электрофильного замещения se
- •Влияние заместителей на кислотные свойства фенолов
- •Ароматические спирты
- •9.2 Альдегиды и кетоны
- •Альдегиды и кетоны алифатического ряда Общая характеристика
- •Влияние акцепторных групп
- •Окисление альдегидов и кетонов
- •Реакции конденсации (уплотнения)
- •Механизм реакции
- •Непредельные альдегиды и кетоны
- •Основные химические реакции
- •Ароматические альдегиды и кетоны
- •9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
- •Основные химические реакции
- •Непредельные карбоновые кислоты.
- •Свойства кислот
- •Двухосновные или дикарбоновые кислоты (предельные и непредельные).
- •Ароматические карбоновые кислоты
- •Кислотные свойства
- •Реакция этерификации
- •10. Нитросоединения Нитросоединения алифатического ряда r - nо2
- •Нитросоединения с нитрогруппой в боковой цепи
- •11. Аминосоединеиия
- •Ароматические амины Общая характеристика
- •Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
- •Реакции электрофильного замещения (sе)
- •12. Диазосоединения
- •Реакция диазотирования
- •Реакции солей диазония без выделения азота
- •Реакция сочетания с фенолом и ароматическими аминами
- •Влияние заместителей на реакцию азосочетания
- •13. Азосоединения
- •14. Вопросы для подготовки к зачету
- •Тема 1. Электрофильное и радикальное присоединение и замещение у алкенов. Элиминирование.
- •Тема 2. Нуклеофильные и радикальные (галогенирование, нитрование) реакции у насыщенного атома углерода
- •Тема 3. Окислительно-восстановительный процесс и дегидрирование
- •Тема 4. Электрофильное замещение в ароматических соединениях. Правила ориентации
- •Тема. 5. Нуклеофильное замещение у ароматических соединений. Кислотно-основные свойства органических соединений
- •Тема 6. Полимеризация, конденсация, поликонденсация. Диазосоединения и синтезы на их основе
- •15. Список рекомендуемой литературы Основной
- •Дополнительный
Нитросоединения с нитрогруппой в боковой цепи
При восстановлении образуют амины:

Со щелочами такие соединения, подобно алифатическим нитросоединениям, могут давать соли аци-нитро-формы. Эта реакция служит отличием нитросоединений с нитрогруппой в боковой цепи от нитросоединений с NO2 - группой в ядре.

11. Аминосоединеиия
Аминосоединения алифатического ряда - это производные от
аммиака в котором один, два или все три атома водорода замещены на радикалы (первичный, вторичный или третичный амины):

Аминосоединения, как и аммиак, проявляют основные свойства. Основность аминов обусловлена наличием пары свободных электронов на атоме азота, которая способна притянуть протон. Так, в водных растворах амины, присоединяя протон, образуют аммонийные соединения.
|
Рассмотрим основность замещенных аминов: |
|
||
|
NH3 |
CH3NH2 |
CH3NHCH3 |
(CH3 )3N |
|
Аммиак |
метиламин |
диметиламин |
Триметиламин |
|
1,7 x 10-5 |
43 x 10-5 |
60 x 10-5 |
6,3 x 10-5 |
1 2 3 4
Концентрация электронов на атоме азота увеличивается за счет +Iэф метильной группы (основность 2 > 1).
В примере 3 две СНз - группы и основность выше, чем в примере 1, но основность растет медленнее по сравнению с 2. Это связано с появлением эффекта стерического (пространственного) затруднения подхода протона Н+ к паре свободных электронов на N за счет объемного расположения заместителей в пространстве. В примере 4 этот эффект настолько велик что основность падает, хотя и остается несколько выше, чем у аммиака (пример 1).
1. Амины реагируют с кислотами, образуя соли:

2. Первичные и вторичные амины проявляют и очень слабые кислотные свойства. Образуют с щелочными металлами соли алкил- или диалкиламиды:
![]()
3. Амины способны к реакциям алкилирования:
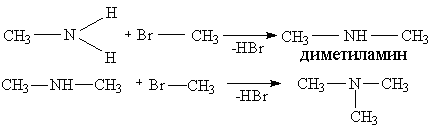
4. Реакции ацилирования (в частности ацетилирования) проводят действием уксусным ангидридом или хлористым ацетиленом:

Третичные амины не ацилируются.
5. Взаимодействие с азотистой кислотой.
Первичные:

Механизм реакции:

Вторичные:

Третичные амины в обычных условиях не взаимодействуют с азотистой кислотой.
Ароматические амины Общая характеристика
Первичные Вторичные Третичные

Основность ароматических аминов также обусловлена парой свободных электронов на атоме азота, способных притянуть протон. Основность ароматических аминов меньше, чем у алифатических.
Константа диссоциации
|
Аммиак |
NH3 |
1,7 x 10 -5 |
|
Метиламин |
CH3NH2 |
43 x 10 -5 |
|
Анилин |
C6H5NH2 |
3,8 х 10–10 |
Причина снижения основности - сопряжение свободной электронной пары азота с электронной системой ароматического кольца ( М эф).

Трифениламин (3) почти не обладает основными свойствами, т.к.
а). Свободные электроны азота, сопрягаются с тремя ароматическими кольцами.
б). Появляется эффект стерического затруднения. Он настолько велик, что подход протона к паре свободных электронов атома N невозможен.
