
- •Кафедра химической технологии переработки
- •Органическая химия
- •Москва, 2007
- •Введение
- •1. Основные теоретические положения органической химии
- •1.1. Классификация органических соединений
- •Органические соединения
- •Важнейшие классы органических соединений.
- •Названия наиболее часто встречающихся радикалов:
- •1.2. Номенклатура
- •1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
- •1.5 Типы органических реакций
- •1.6. Механизмы химических реакций
- •Рост стабильности радикалов
- •Стабильность третичного иона карбония выше, т.К. Частичный положительный заряд на атоме углерода нейтрализуется индукционным эффектом наибольшего числа радикалов.
- •2. Алканы
- •Химические свойства
- •Алкены Общая характеристика
- •Химические свойства
- •Реакции присоединения (а)
- •4. Диеновые углеводороды (алкадиены или диолефины)
- •Химические свойства дивинила и его гомологов Реакции присоединения
- •Диеновые синтезы (синтезы Дильса-Альдера)
- •Реакции полимеризации
- •5. Алкины (непредельные углеводороды ряда ацетилена )
- •Реакции присоединения
- •Реакции окисления
- •Реакции замещения
- •6. Алициклические соединения
- •6.1 Химические свойства
- •6.2. «Теория напряжения» Байера
- •6.3. Пространственное расположение атомов углерода в циклопарафинах.
- •Оптическая изомерия
- •7. Ароматический ряд. Арены
- •7.1. Строение бензола
- •7. 2. Критерии ароматичности. Определение принадлежности вещества к ароматическим соединениям
- •7.3. Химические свойства бензола
- •Реакции электрофильного замещения se
- •Механизм реакции электрофильного замещения
- •Влияние заместителей I-п рода на реакционную способность кольца и ориентацию при реакциях электрофильного замещения (sе)
- •Заместители I рода орто- и пара-ориентанты
- •Заместители п рода -мета ориентанты
- •8. Галогенопроизводные углеводородов
- •Галогенопроизводные предельных углеводородов (галогеналкилы)
- •Химические свойства
- •Галогенопроизводные непредельных углеводородов
- •Ароматические галогенопроизводные
- •Влияние заместителей в кольце на реакционную способность галогена
- •9. Кислородсодержащие соединения
- •9.1. Спирты Спирты алифатического ряда.
- •Реакции гидроксильного водорода.
- •Реакции гидроксила
- •Окисление
- •Одноатомные непредельные спирты
- •Химические свойства
- •Взаимодействие со щелочами
- •Реакции электрофильного замещения se
- •Влияние заместителей на кислотные свойства фенолов
- •Ароматические спирты
- •9.2 Альдегиды и кетоны
- •Альдегиды и кетоны алифатического ряда Общая характеристика
- •Влияние акцепторных групп
- •Окисление альдегидов и кетонов
- •Реакции конденсации (уплотнения)
- •Механизм реакции
- •Непредельные альдегиды и кетоны
- •Основные химические реакции
- •Ароматические альдегиды и кетоны
- •9.3 Карбоновые кислоты Карбоновые кислоты алифатического ряда Общая характеристика
- •Основные химические реакции
- •Непредельные карбоновые кислоты.
- •Свойства кислот
- •Двухосновные или дикарбоновые кислоты (предельные и непредельные).
- •Ароматические карбоновые кислоты
- •Кислотные свойства
- •Реакция этерификации
- •10. Нитросоединения Нитросоединения алифатического ряда r - nо2
- •Нитросоединения с нитрогруппой в боковой цепи
- •11. Аминосоединеиия
- •Ароматические амины Общая характеристика
- •Влиянение заместителей на основные свойства аминов Акцепторный заместитель уменьшает основность
- •Реакции электрофильного замещения (sе)
- •12. Диазосоединения
- •Реакция диазотирования
- •Реакции солей диазония без выделения азота
- •Реакция сочетания с фенолом и ароматическими аминами
- •Влияние заместителей на реакцию азосочетания
- •13. Азосоединения
- •14. Вопросы для подготовки к зачету
- •Тема 1. Электрофильное и радикальное присоединение и замещение у алкенов. Элиминирование.
- •Тема 2. Нуклеофильные и радикальные (галогенирование, нитрование) реакции у насыщенного атома углерода
- •Тема 3. Окислительно-восстановительный процесс и дегидрирование
- •Тема 4. Электрофильное замещение в ароматических соединениях. Правила ориентации
- •Тема. 5. Нуклеофильное замещение у ароматических соединений. Кислотно-основные свойства органических соединений
- •Тема 6. Полимеризация, конденсация, поликонденсация. Диазосоединения и синтезы на их основе
- •15. Список рекомендуемой литературы Основной
- •Дополнительный
1.3. Электронное строение σ- и π- связей Три типа гибридизации атомов углерода
Развитие современных теоретических воззрений в области органической химии связано с квантово-механическим подходом к изучению строения соединений и реакций. Квантово-механический подход к электронному строению и поведению атомов и молекул выражается уравнением Э. Шрёдингера (1926), связывающим энергию электрона с волновым движением. Из квантовой механики известно, что электроны в атоме располагаются на определенных орбиталях, которые отличаются разным запасом энергии. Положение электрона на орбитали не может быть определено точно, а характеризуется вероятностью (ψ2 ) пребывания электрона в определенной точке пространства. Функция ψ названа орбиталью. Различают атомные орбитали (АО) и молекулярные орбитали (МО), на которых находятся электроны в молекуле.
При изучении органической химии особый интерес представляет электронное строение атома углерода, так как с этим связаны его особые свойства, определяющие во многом различия между органическими и неорганическими соединениями.
Углерод - первый элемент IV группы периодической системы элементов. В основном (невозбужденном) состоянии электронная конфигурация атома углерода 1s2 2s2 2p2. В момент химической реакции атом углерода переходит из основного в возбужденное состояние, происходит распаривание 2s-электронов и переход одного их них на свободную 2p- орбиталь. Образуются 4 неспаренных электрона: один – 2s и три – 2p, различные по своему энергетическому состоянию.Электронная конфигурация возбужденного атома углерода – 1s22s 2p3.
Согласно квантово-механическим представлениям электроны s- уровня располагаются на орбиталях сферической формы, а электроны p-уровня на 3-х гантелеобразных орбиталях, направленных по трем взаимно перпендикулярным осям координат. Можно ожидать, что связи, образованные углеродом с другими атомами будут неравноценными. В действительности, в симметрично построенных органических соединениях (например СH4, CCl4 и др.) все 4 связи одинаковы. Для объяснения равноценности связей Полингом введено понятие гибридизации (смешения) орбиталей, согласно которому электроны в молекулах, как правило, располагаются не на «чистых» s- и p- орбиталях, а на смешанных – гибридных. Такие орбитали полнее перекрываются с орбиталями других атомов, образуя более прочные связи.
Для атома углерода возможны три валентных состояния с различными типами гибридизации.
1 валентное состояние –sp3 гибридизация
Смешение одной 2s- и трех 2p- –орбиталей приводит к образованию четырех одинаковых гибридных орбиталей и атом углерода можно представить следующей схемой:

Такая геометрия обеспечивает минимальное отталкивание между электронами. Ниже приведены простейшие схемы перекрывания орбиталей и образование σ – связей:

Первое валентное состояние характерно для предельных углеводородов.
2 валентное состояние –sp2 гибридизация
Образуется в результате смешения одной s и двух 2p орбиталей (рис.а), третья 2p орбиталь не принимает участие в гибридизации и располагается в плоскости перпендикулярной плоскости гибридных орбиталей ( рис. б, в).
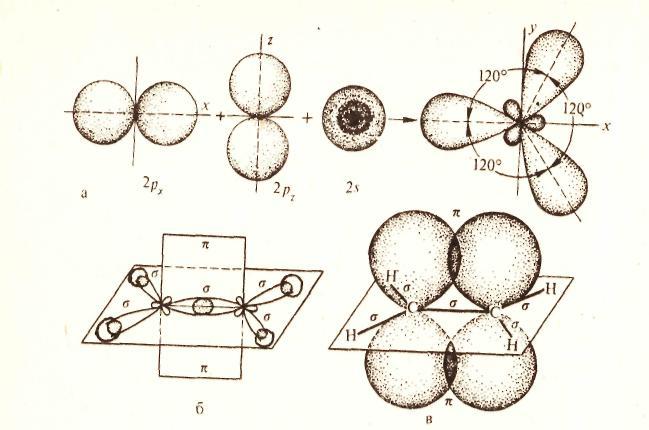
3 валентное состояние –sp гибридизация
При смешение одной 2s и одной 2p орбиталей образуется две гибридные орбитали расположенные на одной прямой (рис.а). Две другие 2р орбитали не участвуют в гибридизации и располагаются во взаимно перпендикулярных плоскостях (рис.б).

Этот тип гибридизации характерен для атомов углерода, связанных тройной связью – непредельные ряда ацетилена HC≡CH .
1.4. Типы химической связи
Ионная или электровалентная связь возникает между атомами, которые сильно отличаются по электроотрицательности (NaCl, KOH).
Электроотрицательность (по Полингу, 1932 г.) – способность атома в соединении притягивать к себе электроны.
Электрон от одного атома передается другому, образуются два противоположно заряженных иона, которые электростатически притягиваются:

Отличительными чертами ионных соединений являются мгновенность протекания реакций, диссоциация и сольватация ионов в водных растворах, высокие температуры плавления и кипения, растворимость в полярных растворителях, электрическая проводимость растворов и расплавов. Связь характеризуется значительной полярностью.
В органической химии в основном мы встречаемся с ковалентной связью.
Ковалентная связь образуется в результате обобщения неспаренных электронов с противоположными (антипараллельными) спинами.
Схематично это можно изобразить следующим образом:
![]()
При этом происходит перекрывание орбитали одного атома с орбиталью другого. Например, образование ковалентной связи в атоме водорода можно представить следующей схемой:

Связь между атомами, осуществляемая одной парой электронов называют простой, одинарной или сигма (σ) - связью. Если в образовании ковалентной связи принимают участие две или три электронные пары, то связь называют кратной, она может быть двойной (две пары электронов) или тройной (три пары электронов).
Основные характеристики ковалентной связи:
Длина связи - определяет расстояние между ядрами и зависит от характера связи, чем больше кратность связи, тем она короче. Измеряется в нанометрах (1нм= 10-9м).
Энергия связи - энергия, необходимая для разрыва данной связи; характеризует прочность связи, чем выше энергия, тем связь прочнее. Измеряется в кДж/моль.
Полярность (статическая характеристика) - определяется степенью смещения электронной плотности между атомами в молекуле, связана с электроотрицательностью атомов. Измеряется в кулонметрах (Кл • м).
Если атомы, образующие химическую связь, обладают одинаковой электроотрицательностью - связь неполярна и возникает симметричная молекулярная орбиталь. Например, у этана СН3 –СН3, водорода Н2, кислорода О2 и др. Если химической связью связаны атомы с различной электроотрицательностью, то в такой несимметричной молекуле электронная плотность смещена к более электроотрицательному атому. Так, например в молекуле хлорметана:

связь поляризована в силу различной электроотрицательности атомов С и Cl. Электронная плотность смещена к атому Cl и на нем возникает частичный отрицательный заряд –δ, а на атоме углерода – частичный положительный заряд +δ.
Смещение электронной плотности по s- связям в сторону более электроотрицательного атома называется индукционным эффектом или индукционной поляризацией (I).
Смещение электронной плотности происходит по всей углеродной цепочке и частичный положительный заряд возникает не только на соседнем атоме углерода. Так, например в хлорпропане:
H3C+δ3 →CH2+δ2→CH2+δ1→Cl-δ,
индукционный эффект затухает по цепочке атомов углерода и частичный положительный заряд + δ1 > + δ2 > + δ3.
Если смещение электронной плотности направлено по цепи в сторону заместителя (например, атома галогена), то такой эффект называют отрицательным (-I). В том случае, если атом смещает электронную плотность в сторону цепи (от себя), индукционный эффект считают положительным (+I). Например, в хлорпропане индукционный эффект атома хлора отрицательный -I, a C3H7- группы положительный +I. В количественном отношении индукционный эффект невелик.
Поляризуемость (динамическая характеристика) — характеризует способность изменять полярность под влиянием внешнего электрического поля.
π - связи поляризуются гораздо легче, чем σ - связи. Измеряется в см3моль.
![]()
Частным случаем ковалентной связи является связь координационная или донорно-акцепторная. Она возникает, когда один из атомов или ионов, вступающих в химическую связь, имеет неподеленную электронную пару (донор), а другой - свободную незаполненную орбиталь (акцептор).
Например, при
взаимодействии кислоты с аммиаком
возникает координационная связь:

NH3+H+=NH4+ или
Разновидностью координационной связи является семиполярная связь. Она осуществляется также за счет неподеленной пары электронов одного из атомов, но отдавая эту пару для образования связи атом - донор заряжается положительно, а акцептор - отрицательно. В результате новую связь можно рассматривать как одновременное проявление двух видов связи -ковалентной (обобществление электронной пары) и ионной(за счет взаимодействия противоположных зарядов). Например:

Водородная связь возникает между атомами, имеющими свободную электронную пару (кислород, азот, сера и др.) и водородом, который связан с другим атомом высокополярной ковалентной связью (например, О-δ —Н+δ).
Возникновение такой связи, например между молекулами воды, можно изобразить следующей схемой:

Водородная связь играет огромную роль в живой природе в биохимических процессах. Благодаря водородным связям фиксируются вторичные и третичные структуры белков, образуются связи в двойных спиралях ДНК.
