
- •ПРЕДИСЛОВИЕ
- •ОБЩИЕ ПРЕДСТАВЛЕНИЯ О НАУКЕ И ЕЁ МЕТОДОЛОГИИ
- •1.1. Наука как рациональная сфера человеческой деятельности
- •1.2. Классификация наук
- •1.3. Естествознание. Методы естественнонаучного познания мира
- •1.4. Естественнонаучная и гуманитарная культуры
- •Литература к главе 1
- •2.1. Современные представления об иерархических уровнях организации материи. Микро-, макро- и мегамиры
- •2.2. Этапы развития атомистической концепции
- •2.3. Фундаментальные взаимодействия в природе
- •Литература к главе 2
- •КОНЦЕПЦИИ ПРОСТРАНСТВА И ВРЕМЕНИ
- •3.1. Основные этапы развития представлений о пространстве и времени.
- •3.2. Основы классической механики и их связь со свойствами пространства и времени
- •3.3. Пространство и время в специальной и общей теории относительности
- •Литература к главе 3
- •СИММЕТРИЯ И ЗАКОНЫ СОХРАНЕНИЯ
- •4.2. Закон сохранения импульса
- •4.3. Закон сохранения энергии
- •4.3.1. Работа и кинетическая энергия
- •4.3.2. Потенциальная энергия
- •4.3.3. Полная механическая энергия
- •Литература к главе 4
- •5.1. Уравнение состояния. Нулевое начало термодинамики
- •5.2. Первое начало термодинамики
- •5.3. Второе начало термодинамики. Энтропия и её статистический смысл
- •Макросостояние
- •5.4. Третье начало термодинамики
- •5.5. Гипотеза «тепловой смерти» Вселенной
- •5.6. Термодинамика открытых систем
- •Литература к главе 5
- •КОНЦЕПЦИЯ ЭЛЕКТРОМАГНЕТИЗМА
- •6.2. Электрический ток. Закон Ома
- •6.3. Магнитное поле движущихся зарядов
- •6.4. Электромагнитная теория Максвелла
- •6.5. Электромагнитные волны
- •6.6. Волновая оптика
- •6.7. Интерференция света
- •6.8. Дифракция света
- •Литература к главе 6
- •КВАНТОВЫЕ СВОЙСТВА МАТЕРИИ
- •7.1. Корпускулярно-волновой дуализм света и микрочастиц
- •7.2. Принцип неопределённости Гейзенберга и принцип дополнительности Бора
- •7.3. Вероятностно-статистический характер поведения микрочастиц
- •7.4. Релятивистская квантовая физика. Физический вакуум
- •7.5. Атомы, молекулы и вещество с точки зрения квантовой теории
- •7.6. Типы химических связей
- •Литература к главе 7
- •АСТРОНОМИЧЕСКАЯ КАРТИНА МИРА
- •8.1. Общие представления о Вселенной и её происхождении
- •8.1.1. Модели нестационарной Вселенной
- •8.1.2. Модель горячей Вселенной
- •8.1.3. Модель раздувающейся Вселенной
- •8.2. Звёзды и галактики
- •8.3. Солнечная система. Происхождение и строение Земли
- •Литература к главе 8
- •БИОЛОГИЧЕСКАЯ КАРТИНА МИРА
- •9.1. Гипотезы происхождения жизни
- •9.2. Основные принципы эволюции жизни
- •9.3. Появление человека на Земле и его эволюция
- •9.4. Биологическая клетка как элементарная единица живого
- •9.4.1. Строение клетки
- •9.4.2. Жизненный цикл клетки
- •9.4.4. Использование генетической информации в процессах жизнедеятельности. Синтез белка
- •9.5. Виды живых систем. Свойства жизни
- •9.6. Основные уровни организации живого
- •Клеточный уровень.
- •Онтогенетический уровень.
- •Популяционно-видовой уровень.
- •Биогеоценотический уровень.
- •Литература к главе 9
- •КОНЦЕПЦИИ БИОСФЕРЫ И НООСФЕРЫ ЗЕМЛИ
- •10.1. Современные представления о биосфере Земли
- •10.2. Учение Вернадского о ноосфере
- •10.3. Общие представления о пневмасфере
- •10.4. Космические и биологические циклы
- •Литература к главе 10
- •КОНЦЕПЦИЯ САМООРГАНИЗАЦИИ
- •1.1. Самоорганизующиеся системы и их свойства
- •11.3. Самоорганизация в химических реакциях
- •11.4. Самоорганизация в живой природе и в человеческом обществе
- •Литература к главе 11
- •КОНЦЕПЦИЯ УСТОЙЧИВОГО РАЗВИТИЯ
- •12.1. Принципы устойчивого развития
- •12.2. Основные черты планетарного мышления
- •12.3. Универсальный эволюционизм
- •12.4. Путь к единой культуре
- •Литература к главе 12
- •СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ
- •Абиотические факторы
- •Автотрофы
- •Адаптация
- •Аденин
- •Адроны
- •Аминокислоты
- •Аннигиляция
- •Античастицы
- •Антропоцентризм
- •Бактерии
- •Бактериофаг
- •Барионы
- •Белок
- •Биогеоценоз
- •Биосфера
- •Биосфероцентризм
- •Биоценоз
- •Бифуркация
- •Близкодействие
- •Вакуум физический
- •Вероятность
- •Вещество
- •Взаимодействие
- •Взрыв
- •Виртуальные частицы
- •Вирусы
- •Витализм
- •Внутренняя энергия
- •Галактика
- •Генетика
- •Генетический код
- •Геном
- •Генотип
- •Генофонд
- •Гетеротрофы
- •Гипотеза
- •Глюоны
- •Гравитационный коллапс
- •Гуанин
- •Дальнодействие
- •Дезоксирибонуклеиновая кислота (ДНК)
- •Диалектика
- •Динамическая система
- •Диссипативная структура
- •Диссипация
- •Доминанта
- •Душа
- •Естественный отбор
- •Живое вещество
- •Закон
- •Знание
- •Идеализация
- •Иерархия
- •Инвариантность
- •Интерпретация
- •Интуиция
- •Иррационализм
- •Истина
- •Информация
- •Катастрофа
- •Квазар
- •Квант
- •Кварки
- •Кибернетика
- •Клетка
- •Кодон
- •Конфайнмент
- •Концепция
- •Коэволюция
- •Ламаркизм
- •Лептоны
- •Лизосомы
- •Липиды
- •Литосфера
- •Личность
- •Мезоны
- •Менталитет
- •Метод
- •Методология
- •Микробы
- •Митоз
- •Мутация
- •Наследственность
- •Наука
- •Негэнтропия
- •Нейтрино
- •Нейтрон
- •Нейтронная звезда
- •Ноосфера
- •Нуклеиновые кислоты
- •Нуклеотид
- •Нуклоны
- •Онтогенез
- •Органеллы
- •Открытые системы
- •Парадигма
- •Параллакс
- •Парсек
- •Пневмасфера
- •Популяция
- •Прокариоты
- •Пульсары
- •Разум
- •Рационализм
- •Редупликация (репликация)
- •Реликтовое излучение
- •Рибонуклеиновая кислота (РНК)
- •Рибосомы
- •Самоорганизация
- •Симбиоз
- •Синергетика
- •Социум
- •Техносфера
- •Тимин
- •Универсум
- •Устойчивое развитие
- •Устойчивость биосферы
- •Фауна
- •Фенотип
- •Ферменты
- •Флора
- •Флуктуация
- •Фотон
- •Хроматин
- •Хромосомы
- •Центромера
- •Цивилизация
- •Цитозин
- •Чёрная дыра
- •Эволюционизм
- •Эволюция
- •Экологическая система
- •Экология
- •Элементарные частицы
- •Энтропия
- •Эукариоты
- •ОГЛАВЛЕНИЕ
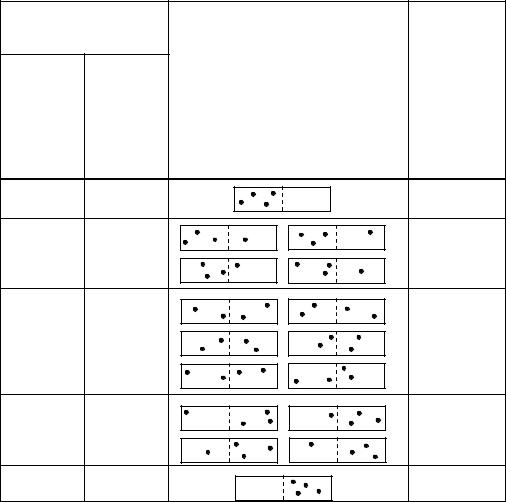
Таблица 5.1 Способы реализации макросостояния на микроуровне
Макросостояние
|
|
Микросостояния, |
|
|
|
|
|
|
|
Статисти- |
||||||
Число |
Число |
соответствующие |
|
|
|
|
|
|
|
ческий вес |
||||||
конкретному макросостоянию |
( Ω ) |
|||||||||||||||
молекул |
молекул |
|||||||||||||||
слева |
справа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
0 |
|
|
14 |
2 |
3 |
|
|
|
|
|
|
|
1 |
||
3 |
1 |
3 |
4 |
|
1 |
|
|
4 |
|
|
1 |
|
|
2 |
4 |
|
2 |
|
|
|
|
|
3 |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
1 |
2 |
3 |
|
|
2 |
|
3 |
|
|
|
4 |
|
||
|
|
4 |
|
|
|
|
|
1 |
|
|
|
|
||||
2 |
2 |
1 |
2 |
|
3 |
4 |
3 |
1 |
|
|
|
2 |
4 |
6 |
||
1 |
4 |
|
3 2 |
|
2 |
|
3 |
|
4 |
1 |
|
|||||
|
|
|
|
|
|
|
|
|||||||||
|
|
4 |
2 |
1 |
|
3 |
|
|
4 |
|
1 |
2 |
|
|
||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
||||
1 |
3 |
1 |
|
3 |
|
2 |
|
|
|
2 |
4 |
1 |
|
3 |
4 |
|
|
|
|
4 |
|
|
|
|
|
|
|||||||
|
|
3 |
|
1 |
2 |
4 |
4 |
|
|
2 |
|
3 |
1 |
|
||
0 |
4 |
|
|
|
|
|
2 |
4 |
3 |
|
|
|
|
1 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
||
Всего способов реализации макросостояний на |
24 = 16 |
микроуровне |
|
|
|
Система, предоставленная самой себе, стремится перейти в состояние с бóльшим статистическим весом. Это позволило Больцману дать статистическую трактовку энтропии, а именно, им было установлено, что энтропия
пропорциональна логарифму термодинамической вероятности состояния системы, т. е.
S ~ ln Ω . |
(5.4) |
Логарифмическая связь между энтропией системы и статистическим весом (термодинамической вероятностью) состояния обеспечивает условие аддитивности энтропии, что легко понять на примере системы, состоящей из двух частей. Энтропия системы в силу аддитивности должна
быть равна сумме энтропий её частей: |
S = S1 + S2 , где S1 и |
S2 – энтропия первой и второй |
частей системы |
соответственно. В то же время термодинамическая вероятность системы, состоящей из двух частей с термодинамическими вероятностями Ω1 и Ω2
соответственно, равна произведению термодинамических вероятностей частей системы: Ω = Ω1Ω2 . Тогда из сказанного выше непосредственно следует формула (5.4), а
именно, S = S1 + S2 ~ ln Ω1 + ln Ω2 = ln Ω .
В 1906 году М.Планк (1858–1947), основываясь на идеях Больцмана о связи энтропии с термодинамической вероятностью, получил для энтропии следующее выражение
S = k ln Ω , |
(5.5) |
где |
k = 1,38·10–23 Дж/К – коэффициент |
пропорциональности, который был рассчитан Планком и назван им постоянной Больцмана. Формула « S = k ln Ω » выгравирована на памятнике Больцману на его могиле в Вене.
Формула (5.5) является основанием статистического толкования второго начала термодинамики, она помогает предсказать направление эволюции изолированной системы. Согласно Больцману природа стремится перейти из менее вероятных состояний в состояния более вероятные, т. е. фактически из состояний с малыми значениями статистического веса в состояния с бóльшими его значениями, а следовательно, из состояний с малыми значениями энтропии в состояния с её бóльшими значениями.
5.4. Третье начало термодинамики
В 1906 году термодинамика обогатилась новым фундаментальным законом, открытым немецким физиком В.Нернстом (1864–1941) эмпирическим путём. Этот закон получил название тепловой теоремы Нернста, которая не может быть логически выведена из остальных начал термодинамики, а потому её часто называют третьим началом термодинамики. Теореме Нернста можно дать следующую формулировку: при приближении к абсолютному нулю приращение энтропии S стремится к вполне определённому конечному пределу, не зависящему от значений, которые принимают все параметры, характеризующие состояние системы (например, от объёма,
давления, агрегатного состояния и пр.). Теорема Нернста относится только к термодинамически равновесным состояниям систем.
Если условиться энтропию всякой равновесной системы при абсолютном нуле температур считать равной нулю, то всякая неоднозначность в определении энтропии исчезнет. Энтропия, определенная таким образом, называется абсолютной энтропией. Теорема Нернста может быть, следовательно, сформулирована следующим образом.
При приближении к абсолютному нулю абсолютная энтропия системы стремится также к нулю независимо от того, какие значения принимают при этом все параметры, характеризующие состояние системы.
Понять суть теоремы Нернста можно на следующем примере. При уменьшении температуры газа будет происходить его конденсация и энтропия системы будет убывать, так как молекулы размещаются более упорядоченно. При дальнейшем уменьшении температуры будет происходить кристаллизация жидкости, сопровождающаяся ещё большей упорядоченностью расположения молекул и, следовательно, ещё большим убыванием энтропии. При абсолютном нуле температур всякое тепловое движение прекращается, неупорядоченность исчезает, число возможных микросостояний уменьшается до одного и энтропия приближается к нулю.
