
- •ГЛАВА 1. Атриовентрикулярная блокада: основные концепции
- •Классификация атриовентрикулярной блокады
- •Атриовентрикулярная блокада первой степени
- •Атриовентрикулярная блокада второй степени с нормальными комплексами QRS
- •Атриовентрикулярная блокада второй степени с расширенными комплексами QRS
- •Продвинутая атриовентрикулярная блокада второй степени и блокада третьей степени типа А1
- •Продвинутая атриовентрикулярная блокада второй степени и блокада третьей степени типа Б
- •Другие механизмы, способствующие нарушению атриовентрикулярного проведения
- •ГЛАВА 2. Клинические концепции спонтанной и вызванной атриовентрикулярной блокады
- •Определение терминов
- •Нормальное предсердно-желудочковое проведение
- •Атриовентрикулярная блокада второй степени
- •Полная блокада сердца
- •Атриовентрикулярная блокада, вызванная аритмией
- •Задержки предсердно-желудочкового проведения при нормальной ЭКГ
- •Лечение
- •Вызванная атриовентрикулярная блокада
- •ГЛАВА 3. Атриовентрикулярная блокада: неинвазивный подход
- •Анатомические и электрофизиологические представления
- •Характеристики атриовентрикулярной блокады
- •Степень атриовентрикулярной блокады
- •Хронология атриовентрикулярной блокады
- •Постоянная АВ-блокада
- •Острая, или транзиторная, АВ-блокада
- •Интермиттирующая АВ-блокада
- •Вызванная и ятрогенная АВ-блокада
- •Неинвазивное определение локализации и природы нарушений проведения
- •Блокада в фазу 3 и фазу 4
- •ГЛАВА 5. Блокада ножек и другие формы аберрантного внутрижелудочкового проведения: клинические аспекты
- •Блокада ножек и ветвей пучка Гиса
- •Блокада левой ножки пучка Гиса
- •Блокада правой ножки пучка Гиса
- •Неполная блокада правой ножки пучка
- •Неполная блокада левой ножки пучка
- •Блокада передней ветви левой ножки
- •Блокада задней ветви левой ножки
- •Блокада септальной ветви левой ножки
- •Блокада правой ножки в сочетании с блокадой передней ветви левой ножки
- •Блокада правой ножки в сочетании с блокадой задней ветви левой ножки
- •Трансмуральная задержка проведения
- •Раннее возбуждение желудочков
- •Спонтанное эктопическое возбуждение желудочков
- •Ритм желудочков при использовании искусственных пейсмекеров
- •Условия возникновения дефектов внутрижелудочкового проведения
- •Выводы
- •ГЛАВА 6. Электрофизиологические механизмы ишемических нарушений ритма желудочков: корреляция экспериментальных и клинических данных
- •История вопроса
- •Первая фаза желудочковой аритмии
- •Окклюзионная аритмия
- •Реперфузионные нарушения ритма
- •Вторая фаза желудочковой аритмии
- •Третья фаза желудочковой аритмии
- •Связь с клиническими явлениями
- •Фармакологические подходы
- •Таблица 6.1. Нарушения ритма желудочков после окклюзии коронарной артерии: тип, продолжительность, механизмы, место возникновения и реакция на антиаритмические препараты
- •Заключение
- •ГЛАВА 7. Преждевременное возбуждение желудочков: современные представления о механизмах и клиническом значении
- •Электрофизиологические механизмы
- •Пейсмекерная активность
- •Нормальная автоматическая активность
- •Аномальная автоматическая активность
- •Осцилляторная деполяризация мембранного потенциала
- •Циркуляторное возбуждение
- •Циркуляция возбуждения по замкнутому пути
- •Отражение
- •Электрокардиографические проявления
- •Парасистолический ритм
- •Экстрасистолический ритм
- •Циркуляция возбуждения по механизму отражения
- •Циркуляция по замкнутому пути
- •Полиморфные ПВЖ
- •Клиническое значение
- •Электрофизиологические основы поздних потенциалов
- •Клиническое значение поздних потенциалов
- •Электрофизиологические ограничения ЭКГ с усредненным сигналом
- •Ограничения прогностических индикаторов уязвимости желудочков
- •ГЛАВА 8. Желудочковая аритмия вследствие физической нагрузки
- •Общие соображения
- •Желудочковая тахикардия при физической нагрузке
- •Сопутствующие состояния
- •Прогноз
- •Лечение
- •ГЛАВА 9. Желудочковая тахикардия и фибрилляция
- •Определения
- •Электрофизиология
- •Электрокардиографические признаки
- •Этиологические факторы
- •Ишемическая болезнь сердца
- •Острый инфаркт миокарда
- •Вариантная стенокардия
- •Хроническая ишемическая болезнь сердца
- •Неишемические повреждения
- •Пролапс митрального клапана
- •Кардиомиопатия и миокардит
- •Гипертрофическая кардиомиопатия
- •Дилатационная кардиомиопатия
- •Синдром удлинённого интервала Q—Т
- •Наследственные синдромы
- •Приобретенные синдромы
- •Желудочковая тахикардия, вызванная катехоламинами
- •Медикаментозная тахикардия
- •Нарушения формирования импульсов при проведении
- •Другие причины
- •Идиопатические случаи
- •Заключение
- •ГЛАВА 10. Электрофизиологические исследования при желудочковой тахикардии
- •Методология
- •Схема стимуляции
- •Способы стимуляции
- •Электрофизиологические исследования для оценки эффективности лекарственной терапии
- •Методология серийного фармакологического тестирования
- •Некоторые общие соображения и предостережения
- •Электрофизиологические исследования в специфических группах больных
- •Заключение
- •ГЛАВА 11. Поздние желудочковые потенциалы: механизмы, методы исследования, распространенность и клиническое значение
- •Электрофизиологические и анатомические основы поздних желудочковых потенциалов
- •Оборудование для неинвазивной регистрации поздних потенциалов
- •Поздние потенциалы, зарегистрированные различными методами
- •Определение поздних желудочковых потенциалов на усредненных поверхностных ЭКГ
- •Сравнительная оценка различных методов
- •Частота поздних потенциалов у больных с желудочковой тахикардией и без нее
- •Корреляция между поздними потенциалами и функцией левого желудочка
- •Корреляция между спонтанной желудочковой аритмией и поздними потенциалами
- •Корреляция между поздними потенциалами и уязвимостью миокарда
- •Влияние антиаритмического хирургического вмешательства на поздние потенциалы
- •Влияние антиаритмических препаратов на поздние потенциалы
- •Прогностическое значение поздних потенциалов
- •Клинические подходы при оценке состояния больных после инфаркта миокарда
- •Выводы
составляет 0,22 с, а форма комплекса QRS соответствует блокаде ПН с отклонением оси влево. Вследствие вагусного воздействия частота ритма падает ниже 50 уд/мин. Интервал Р—R нормализуется, а блокада ПН с отклонением оси влево сменяется блокадой ЛН с нормальным положением оси. Диаграмма блока трех ветвей пучка, показывающая функцию каждой ветви, демонстрирует частотнозависимый блок правой ножки во время фазы 3, который исчезает при вагусном замедлении ритма. В задненижней ветви (ЗНВ) левой ножки развивается блок в ходе фазы 4 после вагусного замедления ритма, тогда как передневерхняя ветвь (ПВВ) левой ножки постоянно остается заблокированной. ЭГ пучка Гиса (правая часть рисунка) показывает детали обоих типов проведения. При наличии блокады ПН с отклонением оси влево проведение по левой ЗНВ весьма продолжительно (125 мс). На фоне вагусной стимуляции проведение осуществляется только по ПН с интервалом Н—Q в 78 мс.
Неинвазивные процедуры оказались чрезвычайно полезными в расшифровке наиболее сложных форм АВ-блокады, связанной с изменением внутрижелудочкового проведения. Наиболее интересным вкладом является обнаружение блока в ходе фазы 4 в одной из ножек или ветвей пучка Гиса при вагусном замедлении сердечного ритма (см. рис. 3.22).
Блокада в фазу 3 и фазу 4
Если деполяризующий импульс приходит в ножку или ветвь пучка преждевременно (т. е. раньше полного исчезновения ее рефрактерности), он может проводиться медленно или полностью блокироваться. Термин «блокада в фазу 3», используемый для обозначения этого явления, просто отражает приход импульса во время фазы 3 потенциала действия. Импульсы, прибывающие по окончании фазы 3, проводятся нормально. Однако если проводящая структура обладает повышенной спонтанной деполяризацией в фазу 4 (обычно вследствие заболевания), она не может удерживать высокий потенциал покоя, позволяя ему смещаться все ближе и ближе к нулевому уровню, в результате чего проводимость этой структуры постепенно снижается. Чем длительнее период диастолы, тем более степень снижения потенциала покоя и выше вероятность нарушения проведения. Блокаду, развивающуюся по такому механизму в конце длительной диастолы, обычно называют «блокадой в фазе 4» [1]. По опыту автора, блок в фазе 4 характерен для внутрижелудочковой проводящей системы и очень редко встречается в АВузле. Его возникновение в 13 исследованных случаях обязательно сопровождалось другими признаками поражения системы ножек и ветвей пучка Гиса и не наблюдалось у здоровых лиц. В связи с этим наличие деполяризации в фазу 4 в системе разветвлений пучка Гиса может использоваться как четкое свидетельство патологического процесса в этих структурах. Существование блоков в фазу 3 или фазу 4 в различных частях системы разветвлений пучка Гиса может обусловить появление некоторых из наиболее сложных и необычных форм нарушения проведения. Возможность возникновения блока в фазу 4 при постэкстрасистолических вариантах блокады обсуждалась выше (см. рис. 3.14 и 3.15).
ГЛАВА 4
Аберрантность: электрофизиологические механизмы и электрокардиографические проявления
Д. .Y. Сингер и X. К. Коэн (D. H. Singer и Н. С. Cohen)
Форма комплекса QRS зависит от последовательности активации желудочков, причем изменения формы отражают отклонения от нормы при распространении возбуждения. Это может происходить по одной из двух основных причин: 1) смещение места возникновения импульса к желудочковому эктопическому фокусу или к АВ-узловым

двойным путям определенного типа; 2) изменение желудочкового распространения наджелудочковых импульсов. Последнее в свою очередь может быть результатом врожденного или приобретенного нарушения проводящей системы. С другой стороны, данное явление может быть функциональным, обусловленным проведением импульса во время рефрактерного периода.
Термины «аберрантность», «аберрация» и «аберрантное желудочковое проведение» с момента их внедрения сэром Томасом Льюисом в- начале нашего столетия [1, 2] применяются в основном при описании функциональных нарушений внутрижелудочкового проведения, особенно тех, которые наблюдаются в сочетании с изменениями длительности сердечного цикла [3—7]. Однако они в равной мере используются и для определения других типов нарушений внутрижелудочкового проведения. В этой главе и в главе 5 термин «аберрантность» будет рассматриваться в широком контексте. Будет также сделан обзор электрофизиологических механизмов, клинических аспектов и роли различных типов нарушений проведения.
Специализированная проводящая система сердца
При рассмотрении проводящей системы ткани сердца удобнее разделить на два основных типа (рис. 4.1, А): 1) рабочий миокард предсердий и желудочков, ответственный за сократимость сердца и появление зубцов Р и комплексов QRS на стандартной ЭКГ; 2) сеть специализированных тканей [8—10] (см. главу 2, том 1), включающую синоатриальный (СА) и атриовентрикулярный (АВ) узлы и разветвления в системе Гис—Пур- кинье [10—13]. Описаны также двойные пути в АВ-узле и специализированные предсердные межузловые тракты [9, 14, 15].
Специализированные ткани несут ответственность за нормальное генерирование импульсов и за их быстрое и упорядоченное проведение от места возникновения в другие отделы сердца. Изменения в процессе образования импульсов и (или) в их проведении предшествуют изменениям частоты сердечных сокращений в ответ на меняющиеся физиологические условия, а также многим нарушениям ритма и проводимости. Электрофизиологические характеристики специализированных тканей являются основными детерминантами аберрантности. Активность специализированных тканей не проявляется на стандартной поверхностной ЭКГ из-за их небольшой (относительно рабочего миокарда) массы, что затрудняет электрокардиографическую оценку предшествующих механизмов.
Рис. 4.1. Схематическое изображение специализированной проводящей системы сердца (А) и трансмембранных потенциалов в обычных и специализированных тканях сердца собаки (Б).
Отмечаются различия характеристик потенциалов действия на разных участках сердца. Взаиморасположение зарегистрированных потенциалов отражает последовательность активации. Внизу показана также стандартная поверхностная ЭКГ. Буквами а—и обозначены следующие структуры: а — синусовый узел; б — пучок Брахмана и другие специализированные предсердные межузловые тракты (отмечены пунктирными линиями, соединяющими синусовый и атриовентрикулярный узлы); в — рабочий миокард предсердий; г — атриовентрикулярный узел; д — пучок Гиса; е — ножки пучка; (eп) — правая ножка; (ел) — левая ножка; 1 и 2 — передняя и задняя ветви левой ножки пучка; ж — волокна Пуркинье; з — терминальные волокна Пуркинье в месте их контакта с рабочим миокардом; и — рабочий миокард желудочков. Фазы потенциала действия рабочего миокарда желудочков обозначены арабскими цифрами от 0 до 4, а зубцы на поверхностной ЭКГ — латинскими буквами Р, R, S и Т. Обсуждение в тексте.
Электрофизиологические аспекты
Как отмечалось ранее, аномалии формы комплекса QRS могут возникать по очень многим причинам. В этой главе основное внимание направлено на ряд нарушений, впервые описанных сэром Томасом Льюисом [1, 2], для которых был предложен термин «аберрантность», а именно: аномалии формы комплекса QRS при наджелудочковом возбуждении, наблюдаемые в сочетании с зависимыми от длительности цикла изменениями проводимости и рефрактерности. Аберрантность — это одно из проявлений большой группы зависимых от длительности сердечного цикла нарушений проведения, которая включает в себя такие разновидности, как скрытое проведение [16—18], сверхнормальное проведение [19,20] и связанный с частотой ритма АВ-блок [3—5]. Однонаправленный блок и циркуляция возбуждения [3—7] в некотором смысле также являются проявлениями этого феномена.
Мы рассмотрим аберрантность с точки зрения зависимости изменений комплекса QRS от длительности сердечного цикла, как это предложено Singer и Ten Eick [21]. При ее обсуждении мы будем основываться на корреляции электрокардиографических данных и результатах микроэлектродных исследований трансмембранного потенциала в сердечных тканях животных, а также у больных, подвергшихся операции на открытом сердце.
Электрическая активность сердечных клеток
Понимание механизмов аберрантности зависит от понимания электрофизиологических основ формирования и проведения возбуждения в сердце, а также от знания тех изменений, которые предшествуют развитию нарушений проводимости. Краткий обзор современных концепций будет дан ниже. Для более обстоятельного изучения этого вопроса читателю следует обратиться к главе 3 первого тома данной книги, а также к многочисленным учебникам по физиологии [22—24], обзорам и монографиям по электрофизиологии сердца [25—36].
Нормальный трансмембранный потенциал
Введение стеклянного микроэлектрода [37] в возбудимую клетку позволяет зарегистрировать разность потенциалов между внутренней средой клетки и индифферентным электродом, расположенным снаружи от нее. На рис. 4.1, Б показан идеализированный трансмембранный потенциал, зарегистрированный в разных отделах сердца, вместе с одновременно полученной поверхностной ЭКГ. Фазы потенциала обозначены арабскими цифрами от 0 до 4. Во время электрической диастолы (фаза 4) внутренняя среда клетки отрицательна по отношению к внеклеточной жидкости. В большинстве нормальных сердечных волокон, включая рабочие миокардиальные клетки предсердий и желудочков, разность потенциалов в фазу 4 остается постоянной до момента возникновения возбуждения («потенциал покоя») и в норме составляет в среднем от — 85 до — 95 мВ. При возбуждении в клетке происходит быстрая деполяризация (фаза 0) с кратковременным изменением полярности, после чего начинается процесс постепенной реполяризации (фазы 1, 2 и 3), во время которого мембранный потенциал возвращается к уровню покоя. Сопоставление со стандартной ЭКГ показывает, что фазы 0 и 1 желудочковых потенциалов действия совпадают с зубцами R и S, а фазы 2 и 3 — с сегментом ST и волной

Г соответственно (см. рис. 4.1, Б). Трансмембранные потенциалы, зарегистрированные в рабочих и специализированных волокнах различных частей сердца,- могут отличаться друг от друга в некоторых отношениях [25], включая уровень диастолического потенциала, амплитуду потенциала действия, максимальную скорость деполяризации в фазу 0 (Vmax), продолжительность периода реполяризации и длительность потенциала действия (см. рис. 4.1, Б). Отмечаются также различия в возбудимости, проводимости и пейсмекерной способности. Локальные различия электрофизиологических свойств в системе Гис—Пуркинье [25, 31—33] могут иметь важное значение для аберрантности, поскольку они обусловливают локальную вариабельность ответов на различные физиологические и фармакологические факторы [25, 38—47], включающие температуру, рН, частоту, pCO2, гипоксию, ишемию, неорганические катионы и ряд антиаритмических препаратов.
Мембранные механизмы
Электрическая активность сердца является следствием движения ионов через клеточную мембрану [22—36, 48]. Эффект физиологических воздействий и химических веществ, влияющих на образование и проведение импульсов в сердце, обусловлен в основном их способностью изменять ионные токи [24, 30, 37, 47]. На рис. 4.2 показаны основные ионные токи, способствующие развитию потенциала действия в волокнах Пуркинье. Далее мы упрощенно опишем некоторые специфические явления, имеющие отношение к аберрантности.
Мембранный потенциал покоя. Разность потенциала относительно мембраны сердечной клетки обусловлена различием в ионном составе внутриклеточной среды и внеклеточной жидкости [32, 33]. Во внутриклеточной жидкости важнейшим катионом является К+, а доминирующими анионами — фосфаты и радикалы органических кислот. Последние представляют собой в основном поливалентные ионы, часто связанные с белками, для которых клеточная мембрана непроницаема. Во внеклеточной жидкости преобладают Na+ и С1–. Перемещение этих ионов через мембрану по специальным порам или каналам [50] в ответ на изменение электрохимического градиента создает трансмембранные токи [27, 32—35], способствующие возникновению потенциала действия. В состоянии покоя клеточная мембрана в принципе проницаема для К+ и относительно непроницаема для других внутри- и внеклеточных ионов [32]. Следовательно, разность потенциалов по обе стороны мембраны в покое определяется главным образом градиентом концентрации K+ [29, 31, 32, 48, 49]. Поддержание различий ионного состава и электрического заряда относительно мембраны в покое становится возможным благодаря двум факторам [31, 32, 49]: 1) свойствам проницаемости, или проводимости (g), клеточной мембраны для этих ионов, которые в свою очередь отражают способность мембранных каналов к их использованию теми или иными ионами; 2) функционированию различных ионных насосов и обменных механизмов [51—53], включая энергозависимый Na+/K+-об- менный насос, перемещающий Na+ наружу, а К+ — внутрь клетки вопреки их градиентам концентрации [51, 53].
Рис. 4.2. Схематическое изображение потенциала действия в нормальном миокарде желудочков.
Показаны направление, величина и время протекания ионных токов, приводящих к развитию потенциала действия данной формы. Направление стрелки и ее размер указывают направленность и относительную величину тока (т. е. входящий или выходящий ток), а также соотношение амплитуд различных ионных токов. Горизонтальное положение стрелки соответствует моменту протекания токов по отношению к потенциалу действия. Обсуждение в тексте [36].
Потенциал действия: деполяризация. При стимуляции клетки и снижении мембранного потенциала до критического уровня (пороговый потенциал, при котором начинает генерироваться чисто входящий ток), происходит ряд последовательных изменений ионной проводимости мембраны и ионных токов, что обусловливает проявление потенциала действия [27, 31, 33, 36] (см. рис. 15.2). В норме деполяризация (фаза 0) полностью поляризованных сердечных волокон, за исключением клеток синусового и атриовентрикулярного узлов, обусловлена прежде всего резким увеличением мембранной проницаемости для Na+ (gNa) и быстрого входящего тока, переносимого ионами Na+ [24, 27, 29, 31, 33, 35, 48] (быстрый, направленный внутрь ток Na+, или быстрый входящий ток), в сочетании с открытием быстрых Nа+ каналов.
Способность мембраны к повышению gNa (т. е. к открытию закрытых Na+-каналов) зависит от уровня мембранного потенциала при возбуждении. Пропускная способность каналов для Nа+, как правило, максимальна, поэтому быстрый входящий ток Nа+ может иметь наибольшую величину, когда мембранный потенциал находится в пределах от — 85 до — 95 мВ. Если мембранный потенциал менее отрицателен, чем в норме, повышение проницаемости для Na+ и величина быстрого тока Na+ меньше максимально возможных из-за снижения пропускной способности каналов. При уменьшении мембранного потенциала ниже определенного уровня увеличения быстрого входящего тока Na+ может оказаться недостаточным для возникновения регенеративного или даже подпорогового ответа, что означает невозбудимость волокна.
Амплитуда и максимальная скорость деполяризации (Vmax) в нулевую фазу (нарастание) зависят от быстрого входящего тока Na+. Следовательно, они зависят и от уровня мембранного потенциала. Амплитуда сильно поляризованных волокон Пуркинье может достигать 130 мВ, a Vmax высока и, по некоторым данным, составляет от 500 до 1000 В/с. Обе величины уменьшаются при снижении уровня потенциала. На рис. 4.3, А показано постепенное уменьшение амплитуды и скорости нарастания потенциала действия волокна Пуркинье при снижении уровня мембранного потенциала. Кривые на рис. 4.3, Б показывают связь мембранного потенциала в момент возбуждения и Vmax ответа для двух клеток миокарда желудочков. Эту связь, впервые описанную для сердечных волокон Weidmann в 1951 г. [54] и позднее подтвержденную Hoffman и соавт. [55], часто называют «отношением реактивности», а кривую — «кривой реактивности». Такие кривые иногда используются для приблизительной оценки пропускной способности Na+-ка- налов.
Второй входящий ток в сердечной ткани [27, 29, 30, 33—35, 57, 58] активируется только при «низком» уровне мембранного потенциала — от — 35 до — 45 мВ. Этот ток переносится в основном ионами Са++ и имеет гораздо меньшую плотность (приблизительно 10%), чем быстрый ток Na+. Каналы, ответственные за его прохождение, активируются (открываются) и инактивируются (закрываются) медленнее, чем быстрые Na+-каналы, так что этот второй ток развивается медленнее и протекает дольше, чем быстрый ток Na+. Восстановление после инактивации также требует большего времени. Этот ток соответственно получил название «медленного входящего тока». Каналы, пропускающие быстрый и медленный входящий ток, являются фармакологически различными [58, 59]. Тетродотоксин избирательно блокирует быстрые каналы входящего Na+, тогда как медленные каналы блокируются такими агентами, как марганец (Mn++), D-600 и верапамил. В норме в сильно поляризованных клетках медленный ток оказывает лишь минимальное влияние на нарастание, внося основной вклад в фазу 2 (плато) реполяризации. С другой стороны, деполяризация узловых клеток с низким потенциалом [60—64], а также мышечных волокон створок атриовентрикулярных клапанов [66] и коронарного синуса [67], повидимому, в большой степени определяется медленным током. Однако его вклад в деполяризацию неузловых волокон возрастает при снижении в них мембранного потенциала [30, 33—35, 66—69]. Этот последний факт приобретает особое значение, если учесть, что

миокардиальные препараты, полученные у собаки после экспериментального инфаркта [70—74, 138, 184], а также у больных с органическим поражением сердца [21, 36, 76— 90], содержат большое число частично деполяризованных волокон.
Рис. 4.3. Влияние потенциала покоя на потенциал действия.
А — изменения характеристик потенциала действия по мере его распространения из нормально поляризованной области в зону, где мембранный потенциал (МП) постепенно снижается. Величина МП (в милливольтах) указана для отдельных участков волокна; потенциалы действия, возникающие в этих точках, показаны выше. Следует, в частности, отметить постепенное уменьшение амплитуды и I^max, которое должно сопровождаться постепенным замедлением проведения. Обратите также внимание на временные изменения в ходе реполяризации и изменения длительности потенциала действия. Б — кривые, отражающие связь между уровнем мембранного потенциала возбуждения (в милливольтах по оси абсцисс) и (?щв« (в В/с по оси ординат) потенциала действия хорошо поляризованных клеток «а» (Еm = —90 мВ) и клеток «б» (Еm = —79 мВ) в волокнах желудочкового миокарда человека; образцы миокарда получены у больного с ишемической болезнью сердца и аневризмой желудочков. Измерения осуществлялись для потенциалов действия, возникающих при различных уровнях мембранного потенциала вследствие стимуляции препарата с определенными интервалами, во время реполяризации и фазы 4. Кривые, отражающие Эти переменные, называют «кривыми реактивности». Обратите внимание, что при средних значениях потенциала кривая для клетки «б» смещена вниз и вправо, а при более низких значениях — вверх и влево. Обсуждение в тексте.
Электрофизиологические свойства волокон, зависящих от медленного входящего тока (волокна с медленным ответом), отличаются во многих отношениях от свойств волокон, активность которых зависит от быстрого тока (волокна с быстрым ответом) [30, 33, 34, 58, 59]. Как правило, волокна с медленным ответом характеризуются низким диастолическим потенциалом, невысокой амплитудой и медленным нарастанием потенциалов действия, а также пониженной возбудимостью, измененной реактивностью, более продолжительной рефрактерностью и замедленным проведением. Кроме того, даже волокна, в норме не обладающие автоматизмом, могут приобрести способность к спонтанному генерированию импульсов при снижении мембранного потенциала до уровня, при котором начинает функционировать медленный ток (рис. 4.4, А). Большинство специфических черт активности синусового и атриовентрикулярного узлов удается объяснить, исходя из особенностей поведения медленного входящего тока [25, 30, 61—65]. То же справедливо для аномальных электрофизиологических характеристик многих частично деполяризованных клеток в ишемизированных и пораженных тканях сердца [31, 34, 36, 75, 78, 85, 86, 91—93].
Потенциал действия: реполяризация. Увеличение быстрого входящего тока Na+, которое предшествует деполяризации, является самоограниченным и непродолжительным (приблизительно несколько миллисекунд). Инактивация Na+-каналов с после-
дующим уменьшением тока Nа+ дает начало реполяризации, процессу более длительному (до нескольких сотен миллисекунд) и сложному, в котором принимают участие ионы Na+, К+, Са++ и Cl– (см. рис. 4.2) [27, 29, 31, 33, 94]. Его специфические механизмы пока полностью не установлены. Ясно, однако, что для возникновения реполяризации необходимо уменьшение положительного заряда внутри клетки. В процессе реполяризации волокон Пуркинье можно выделить 3 четкие фазы. Начальная стадия (фаза 1) является быстрой; она обусловлена инактивацией тока Na+" и развитием выходящего тока, переносимого ионами К+ и, возможно, Сl– [27, 95]. После фазы 1 реполяризация существенно замедляется (плато, или фаза 2). В фазу плато происходит снижение суммарной проводимости мембраны и возникающие при этом токи небольшой величины более или менее уравновешивают друг друга [27, 33, 94, 95] (т. е. реполяризующие влияния инактивации тока Na+ и активации выходящего тока K+ уравновешиваются деполяризующим действием остаточного медленного входящего тока). Ток К+ со временем возрастает. Таким образом, вместе с уменьшением входящих токов это приводит к увеличению чистых потерь положительного заряда и, наконец, к быстрой реполяризации (фаза 3). По мере реполяризации калиевая проводимость (gK) все более повышается, способствуя дополнительному выходу К+ из клетки и дальнейшему ускорению реполяризации. Кроме того, процессу реполяризации способствует накопление вышедшего из клетки K+ в ограниченном внеклеточном пространстве [96]. Недавно была высказана гипотеза о том, что определенный вклад в реполяризацию может вносить электрогенный натриево-калиевый насос [97, 98]. Как только мембранный потенциал доходит до уровня примерно —40 или —45 мВ, начинается его быстрое снижение до значений потенциала покоя.
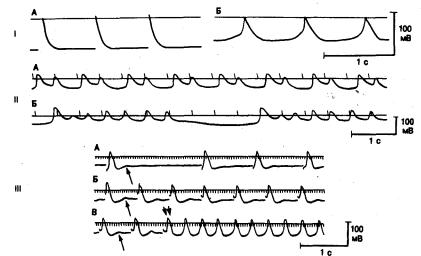
Рис. 4.4. Трансмембранные потенциалы в образцах миокарда предсердия (фрагменты I и III) и желудочка (фрагмент II) человека, позволяющие продемонстрировать различные типы аномального автоматизма в сердечной ткани при заболевании сердца.
Фрагмент I: трансмембранные потенциалы в хорошо поляризованном волокне с быстрым ответом (А) и низкоамплитудные медленные ответы частично деполяризованного волокна (Б) в придатке правого предсердия человека. Максимальный диастолический потенциал (и амплитуда), зарегистрированный в клетках А и Б, составили —72 мВ (—80 мВ) и —55 мВ (—55 мВ) соответственно. Высокоамплитудные, быстро нарастающие потенциалы, развивающиеся в сильно поляризованном волокне, существенно отличаются от низкоамплитудных, медленно нарастающих потенциалов в частично деполяризованном волокне. Следует также отметить, что клетка с медленным ответом начинает спонтанно деполяризоваться сразу после окончания реполяризации, т. е. она становится автоматически активной (автоматизм, вызванный деполяризацией).
Фрагмент II: трансмембранные потенциалы в частично деполяризованной, спонтанно активной клетке папиллярной мышцы больного с ревматическим заболеванием сердца, осложненным мерцанием предсердий, желудочковой эктопией высокой степени и вариабельными нарушениями желудочкового проведения, зависящими от частоты сердечного ритма. А — реполяризация после основного автоматического возбуждения прерывается однократной ранней постдеполяризацией, приводящей к развитию бигеминии. Б — каждое основное возбуждение прерывается низкоамплитудной осцилляцией, за которой следуют 5 повторяющихся высокоамплитудных ответов с результирующим выраженным увеличением длительности реполяризации. Каждая серия заканчивается колебанием мембранного потенциала очень низкой амплитуды, что еще больше затягивает окончание реполяризации при основном возбуждении. Фрагмент III: индукция колебаний мембранного потенциала по типу задержанной постдеполяризации и развитие триггерной активности в препарате предсердия человека, исходно не обладавшем спонтанной активностью. Первая осцилляция на каждой записи указана стрелкой. Записи А и Б, а так-
же начало записи В демонстрируют развитие постдеполяризации при стимуляции с возрастающей частотой. Отмечается постепенное увеличение амплитуды осцилляций при повышении частоты стимуляции. В конце концов, колебания мембранного потенциала достигают порогового уровня и возникает ритмическая триггерная активность (в середине записи В двойная стрелка), которая сохраняется даже после прекращения стимуляции. Хотя каждый из приведенных примеров получен на частично деполяризованном препарате, аналогичные явления наблюдаются и в сильно поляризованных тканях. Обсуждение в тексте [87}.
Генерирование импульсов
Возбуждение и проявление потенциала действия обусловлены протеканием через клеточную мембрану достаточно деполяризующего тока, который быстро снижает (т. е. делает менее отрицательным) трансмембранный потенциал до порогового уровня. Для разных типов клеток пороговый потенциал различен и связан с максимальным диастолическим потенциалом [33, 56, 87, 99]. Возбуждающие (деполяризующие) токи могут поступать из внешнего источника или же развиваются спонтанно. В норме они являются следствием локальной разности потенциалов, возникающей при распространении потенциала действия. Определенные клетки, называемые автоматическими, способны генерировать такие токи спонтанно; следовательно, они могут испытывать самовозбуждение и спонтанно (автоматически) инициировать импульсы [25].
В норме автоматизм обусловлен периодическим возникновением в специализированных тканях сердца спонтанный деполяризации в фазу 4 [25] (см. рис. 4.1, Б). Клетки с наибольшей частотой спонтанной диастолической (фаза 4) деполяризации (в норме эти клетки синусового узла) служат первичными пейсмекерами, остальные же — представляют собой латентные пейсмекеры. В действительности деполяризация в фазу 4 развивается, скорее всего, только в клетках синусового узла (см. рис. 4.1, Б), в латентных же («ускользающих») водителях ритма необходимые изменения возникают лишь в ответ на такие факторы, как замедление синусового ритма или АВ-блокада.
Спонтанное генерирование импульсов может быть обусловлено не только медленной диастолической деполяризацией специализированных автоматических клеток, но и другими механизмами. Поскольку такие альтернативные механизмы являются недостаточными для работы в нормальных физиологических условиях, их рассматривают как аномальные факторы автоматизма, а возникающую в результате спонтанную активность — как аномальный автоматизм [100]. Этот термин объединяет целую группу различных явлений. Спонтанные циклические пейсмекероподобные осцилляции диастолического потенциала, не связанные с основным инициирующим событием, представляют один из важнейших типов активности. Такого рода активность проявляется преимущественно в угнетенных, частично деполяризованных волокнах, где мембранный потенциал снижен до уровня, при котором начинает функционировать медленный входящий ток; отсюда название «автоматизм», вызванный деполяризацией». По-видимому, подобная активность может возникать при снижении диастолического потенциала в большинстве клеток (если не во всех), включая рабочий миокард предсердий и желудочков [101— 103]. Такое явление часто наблюдается в ишемизированных и пораженных тканях сердца [36, 74, 75, 87, 91—93]. Вполне репрезентативна в этом отношении запись на рис. 4.4 (фрагмент 1), полученная в частично деполяризованных автоматических клетках миокарда предсердий человека.
Существуют и другие типы осцилляций, которые зависят от предшествующего инициирующего потенциала действия (т. е. триггерная активность). Такие осцилляции могут возникать во время (или после завершения) реполяризации инициирующего потенциала действия (см. рис. 4.4, фрагменты II и III). Для их обозначения был предложен целый ряд определений, из которых наиболее широко используются термины, предложенные Cranefield: соответственно «ранняя» и «задержанная» постдеполяризация [30]. Ранняя постдеполяризация чаще всего прерывает реполяризацию в фазу 2 на плато при уровне потенциала от —20 до —25 мВ, но она может возникнуть и во время фазы 3. Она увеличивает длительность реполяризации и рефрактерности иногда на многие секунды (см. рис. 4.4,11). Задержанная же деполяризация (см. рис. 4.4, III) наблюдается во время фазы 4 при более или менее нормальном уровне диастолического потенциала (от —70 до —185 мВ), а также при его сниженном уровне. Постдеполяризация, достигающая порогового уровня, приводит к возникновению триггерных ритмов (см. рис. 4.4,III) [104], из
которых лучше всего известен ритм, обусловленный интоксикацией сердечными гликозидами.
Мембранные механизмы, лежащие в основе возникновения пейсмекерных потенциалов, до конца не выяснены [29, 30, 33]. Согласно последним, работам, пейсмекерная активность волокон Пуркинье является следствием активации входящего тока, переносимого как Na+ так и K+ [105, 106]. По некоторым данным, в синусовом узле определенный вклад в пейсмекерную активность вносит и медленный входящий ток [107—НО]. Ионные механизмы, определяющие автоматическую активность частично деполяризованных миокардиальных клеток и осцилляции постдеполяризационного типа, еще менее изучены [29, 30, 33, 34, 36, 102, 103].
Проведение
Проведение импульса (потенциала действия) в сердце является в высшей степени сложным и не до конца изученным явлением. Последние монографии и обзоры Jack и соавт. [Ill], Fozzard [112], Spach и Kootsey [И3], а также Cranefield [30], [114] показали еще большую сложность этого феномена. Проведение считается результатом последовательной деполяризации смежных участков клеточной мембраны за счет локальных токов, которые возникают вследствие разности потенциалов между соседними сегментами покоящейся (поляризованной) и активной (деполяризованной) мембраны и текут от клетки к клетке через контакты, обладающие низким электрическим сопротивлением. Частота, с которой осуществляется этот процесс (т. е. скорость проведения), зависит от ряда взаимосвязанных переменных, включая входящий ток и его детерминанты, возбудимость, пассивные кабельные свойства сердечных волокон, их диаметр и геометрию.
В х о д я щ и й т о к. В нормальных сердечных клетках, расположенных вне синусового узла и АВ-узла, способность распространяющегося потенциала действия к возбуждению прилегающих участков покоящейся мембраны и, следовательно, к проведению, а также скорость проведения, зависят от величины быстрого входящего тока Nа+, а затем — и от Vmax, которая является косвенной мерой входящего тока. Входящий ток и Ушах в свою очередь связаны с мембранным потенциалом клеток при возбуждении. Следовательно, скорость проведения также зависит от мембранного потенциала клеток, лежащих на пути распространения импульсов (54—56, 112, 115]. Быстрый натриевый ток, Ушах и скорость проведения, а также другие равнозначные факторы оптимальны в достаточно поляризованных волокнах, где мембранный потенциал составляет от — 85 до — 95 мВ. Снижение мембранного потенциала сопровождается уменьшением быстрого входящего тока Na+, Vmax и скорости проведения [30]. Ухудшение проведения связано с величиной потенциала [55, 56, 115], причем первое существенное замедление обычно отмечается при значениях выше — 70 мВ, а нарушение проведения — при —50 мВ или ниже. При столь низких уровнях потенциала быстрый натриевый ток в основном инактивируется и деполяризация становится все более зависимой от медленного тока. На рис. 4.3, А схематически показано изменение потенциала действия при его распространении от нормально поляризованных участков к областям с постепенно уменьшающейся поляризацией. Продвижение к частично деполяризованной зоне характеризуется прогрессивным снижением амплитуды и повышением скорости деполяризации, т. е. теми изменениями, которые должны сопровождаться все более возрастающим выраженным замедленным проведением.
Проведение зависит также от соотношения мембранного потенциала в момент возбуждения и Vmax ответа (реактивность). Изменения этого соотношения обусловливают смещение нормальной кривой (клетка а) на рис. 4.3, Б вниз и вправо (кривая для клетки б), что отражает подавление реактивности и замедление проведения, поскольку Vmax ответов при любом данном потенциале уменьшается относительно нормы. Поскольку при таком смещении проведение замедляется при всех уровнях потенциала, это должно, во-первых, усилить нарушения проводимости, связанные с уменьшением мембранного потенциала, и, во-вторых, облегчить развитие нарушений проводимости при более нормальных (т. е. более отрицательных) уровнях потенциала. Изменения соотношения реактивности, при которых кривая смещается вверх и влево в диапазоне высоких (отрицательных) и средних уровней потенциала, приводят к противоположным эффектам. Парадоксально, но при смещении кривой влево в диапазоне низких потенциалов (рис. 4.3, Б, кривая для клетки б) может возникнуть предрасположенность к развитию нарушений проводимости, так как при этом облегчается генерирование медленно нарас-
тающих и медленно распространяющихся ответов при тех уровнях потенциалов, которые в других условиях оказались бы слишком положительными для поддержания какой бы то ни было активности.
Многочисленные кардиоактивные препараты, в том числе многие стандартные антиаритмические средства, влияют на проводимость посредством изменения реактивности миокарда [25, 30, 38—44]. Угнетающее влияние хинидина и новокаинамида отражается главным образом в смещении кривой реактивности вниз и вправо [116, 117]. Ишемия и повреждение миокарда, по-видимому, оказывают аналогичное действие. Исследования инфарцированного желудочка собаки [70, 71, 74, 75] и пораженного миокарда у человека [36, 87] показывают, что кривая реактивности (по крайней мере для некоторых клеток) смещается вниз и вправо в диапазоне высоких и средних уровней потенциала, но вверх и влево—при низких уровнях (рис. 4.3, Б, клетка б). Последнее, вероятнее всего, отражает активацию медленного входящего тока при низких потенциалах. В любом случае оба типа смещения предрасполагают к усилению нарушений проведения и аберрантности.
Возбудимость и проведение. Проведение зависит также от возбудимости мембраны [118—120]. Понятие «возбудимость» связано с величиной тока, необходимого для снижения мембранного потенциала от уровня, существовавшего при стимуляции, до порога с последующей инициацией потенциала действия. Этот показатель является сложной функцией, зависящей от ряда факторов, включая уровень мембранного потенциала и пороговый потенциал. Снижение возбудимости синонимично увеличению амплитуды тока, необходимого для возбуждения; при неизменности других факторов оно сопровождается замедлением проведения. Повышение возбудимости имеет противоположный эффект. На этом основании объясняется ускорение проведения в ответ на умеренную деполяризацию [118—120]. Действительно, зависимые от длительности сердечного цикла изменения возбудимости угнетенных клеток системы Гис—Пуркинье предположительно служат причиной интермиттирующей блокады ножки пучка [150]. Некоторые физиологические и фармакологические факторы, влияющие на проводимость, способны оказывать равноценное (или по крайней мере частичное) влияние и на возбудимость. То же представляется справедливым для калия: увеличение его внеклеточной концентрации с 2,7 до 4 мМ сопровождается повышением возбудимости и скорости проведения. Дальнейшее повышение концентрации более 7 мМ подавляет возбудимость и проведение [119]. Депрессивное влияние лидокаина и новокаинамида на проведение может быть связано с их действием, снижающим возбудимость [121, 122]. Ишемия и заболевание миокарда также могут угнетать возбудимость и тем самым влиять на проведение.
К а б е л ь н ы е с в о й с т в а и п р о в е д е н и е . Считается, что сердечные волокна по своим электрическим свойствам во многом напоминают одномерный коаксиальный кабель [23, 31, 111, 112]. Отдельные клетки миокарда электрически связаны между собой посредством специализированных низкоомных [123] мембранных структур [124, 125] — нексусов, или вставочных дисков [126], которые облегчают протекание тока между клетками, так что цепочки клеток можно в функциональном смысле рассматривать как длинные кабели. Электрические свойства таких структур, получившие название «пассивных» или «кабельных» свойств, включают в себя сопротивление (величину, обратную проводимости) и емкость мембраны, а также внутреннее продольное сопротивление (суммарное сопротивление цитоплазмы и нексусов). Эти факторы определяют протекание тока от клетки к клетке и, следовательно, являются основными детерминантами проводимости [23, 30, 36, 111, 112, 114]. Изменение этих параметров оказывает глубокое влияние на проведение [127].
Есть основания полагать, что изменения кабельных свойств под действием препаратов или при патологических состояниях могут способствовать развитию нарушений проведения в клинических условиях. Например, имеются данные о том, что токсические дозы оуабаина [128], ацидоз [129], гипоксия и ишемия [130], сопровождающиеся аномалиями проведения in vivo, видимо, повышают сопротивление нексусов. Результаты математического моделирования показывают, что определенное повышение внутреннего сопротивления приводит к полной блокаде проведения вследствие электрического разобщения клеток [131]. Есть также основания полагать, что электрическое разобщение происходит в пораженном миокарде желудочков человека [87]. Таким образом, выдвинуто предположение о возможной роли изменений кабельных свойств в развитии медленного проведения и нарушений ритма у больных с заболеванием сердца. Точный механизм, лежащий в основе электрического разобщения, неясен, но определенное участие здесь, по-видимому, принимают ионы Са++, на что указывают результаты исследований, в кото-
рых внутриклеточная инъекция кальция вызывала повышение внутреннего сопротивления [132].
Ряд воздействий, усиливающих вызванное ишемией или гипоксией повышение внутриклеточного сопротивления, включая повышение частоты стимуляции, также увеличивают внутриклеточную концентрацию Са++ [133].
Нарушения проводимости
Нарушения проведения возбуждения в сердце могут быть обусловлены множеством различных факторов. Хорошо известны врожденные и приобретенные аномалии специализированных тканей, а также их разрушение вследствие заболевания [8]. В нормальном сердце, вероятно, наиболее частой причиной аномалий является распространение импульсов в волокнах с низким мембранным потенциалом. Повышение степени аберрации проведения, по-видимому, связано здесь с электрофизиологическими свойствами частично деполяризованных волокон с медленным ответом [30, 34], а также изменениями, возникающими при ишемии [74, 75] и повреждении сердца [36, 87]. Важную роль играют также изменения возбудимости и кабельных свойств сердечных волокон, которые обусловлены действием препаратов и патологическими процессами [31, 111, 112], особенностями строения волокон, а также временной и пространственной конвергенцией импульсов [134, 135]. При обсуждении этих вопросов основное внимание будет уделено зависимости нарушений проведения от мембранного потенциала.
Нарушения проведения вследствие уменьшения потенциала могут возникать в любом отделе сердца. При этом возможны разнообразные электрокардиографические проявления, особенно ЭКГ-элементы, отражающие в каждом конкретном случае локализацию деполяризованных волокон и степень деполяризации их мембраны. Если, например, в процесс вовлечен пучок Гиса, аномалии проведения проявляются в виде АВ-блока- ды. Если же деполяризованные клетки располагаются ниже бифуркации, то наблюдаются различные типы дефектов внутрижелудочкового проведения.
Природа нарушений проведения и их электрокардиографические проявления критически связаны с временными характеристиками снижения мембранного потенциала. Здесь могут определяться две основные категории нарушения. Первая и наиболее часто встречающаяся — группа нарушений связана с уменьшением мембранного потенциала вследствие неполной реполяризации. На рис. 4.5, А показан потенциал действия волокна правой ножки пучка Гиса, а также пять преждевременных ответов, инициированных в различные моменты при реполяризации. Изменения характеристик потенциала действия и проведения во время реполяризации вместе с соответствующими необходимыми изменениями величины порогового тока (возбудимость) (см. рис. 4.5, Б) и порогового потенциала обычно определяются термином «рефрактерность». На рис. 4.5, А видно, что стимуляция не способна вызывать активный ответ до тех пор, пока мембранный потенциал не вернется к уровню —50 мВ. Наиболее ранний ответ (а) указывает, следовательно, на окончание абсолютного рефрактерного периода и начало относительного рефрактерного периода. Однако самые ранние ответы (а и б) столь малы по амплитуде и нарастают так медленно, что не могут распространяться (локальные ответы). Первый распространяющийся импульс (в) определяет конец эффективного рефрактерного периода (период, в течение которого не происходит распространения ответа). Амплитуда, Vmax и длительность ответов, последовательно возникающих при более отрицательных значениях мембранного потенциала, прогрессивно увеличиваются, что сопровождается улучшением проведения. Оптимальный ответ (г) наблюдается лишь после возвращения мембранного потенциала к уровню —85 или —90 мВ. На рис. 4.5, В показаны электрокардиографические проявления этих событий.

Рис. 4.5. Влияние рефрактерности на электрический ответ сердца.
А — схематическое изображение трансмембранного потенциала действия нормального волокна Пуркинье и ответов, вызванных преждевременной стимуляцией в определенные моменты реполяризации. Показан также уровень порогового потенциала. Обратите внимание, что амплитуда и Vmах ответов зависят от уровня мембранного потенциала при стимуляции. Наиболее ранние ответы (а и б) возникают при столь низких величинах мембранного потенциала и так малы по амплитуде и скорости нарастания, что не могут распространяться (градуальные или местные ответы). Последующие ответы (в—д) характеризуются постепенным увеличением амплитуды, скорости нарастания и длительности вплоть до момента завершения реполяризации. Самый ранний распространившийся ответ (в) определяет окончание эффективного рефрактерного периода. Первый нормальный ответ
(д) определяет окончание времени полного восстановления. Хотя ответ г возникает во время окончания периода сверхнормальной возбудимости, он становится меньше и нарастает медленнее, чем ответ д. Б — обычная связь между мембранным потенциалом и возбудимостью катодным током. Величины порогового тока указаны в микроамперах (мкА). .Волокно становится невозбудимым с момента начала нулевой фазы потенциала действия. Восстановление возбудимости, на которое указывают изменения порога, происходит медленно во время фазы 3. На схеме также показана приблизительная длительность абсолютного рефрактерного периода (АРП), эффективного рефрактерного периода (ЭРП), относительного рефрактерного периода (ОРП). Полного рефрактерного периода (ПРП), времени полного восстановления (ВПВ) и периода сверхнормальной возбудимости (ПСНВ). Вертикальные линии, соединяющие фрагменты А и Б рисунка, показывают связь между временными отрезками реполяризации
иизменениями рефрактерности и возбудимости. Пороговый потенциал, величина которого становится бесконечной в фазу быстрой деполяризации, также нормализуется при реполяризации (не показано). В — четыре ритмограммы в отведении V\ с отдельными преждевременными возбуждениями предсердий, вызванными в различные моменты реполяризации. Эта запись представляет собой «аналог» кривой на фрагменте А: преждевременные возбуждения предсердий а—д соответствуют ответам с теми же обозначениями на А. Самые ранние преждевременные возбуждения предсердий (а и б) достигают АВ-проводящей системы столь рано во время реполяризации, что они либо не могут распространяться по ней совсем, либо дают лишь локально распространяющиеся ответы, которые рассматриваются как непроводящиеся предсердные преждевременные возбуждения. Следующие два преждевременных возбуждения предсердий (в и г) достигают проводящей системы несколько позже и проводятся в желудочки. Однако проведение становится угнетенным, о чем свидетельствует удлиненный интервал P—R и измененная (аберрантная) форма комплекса QRS. Возбуждение д наблюдается после завершения реполяризации
ипроводится нормально. Обсуждение в тексте.
Из сказанного следует, что восстановление возбудимости и проводимости (т. е. функциональное восстановление) находится в четкой зависимости от величины потенциала и происходит параллельно процессу реполяризации. Это, по-видимому, более или менее справедливо для большинства нормальных сердечных волокон, за исключением узловых клеток, где функциональное восстановление происходит по окончании реполяризации; таким образом, процесс восстановления возбудимости зависит от времени и величины потенциала [25, 30, 34, 61, 63, 64]. Как показывают более поздние данные [136, 137], это в той же мере относится даже к неузловым клеткам. Однако такое несовпадение обычно невелико и становится заметным лишь в клетках с пониженным диастолическим потенциалом. Различие между вольтажным и функциональным восстановлением обозначается термином «постреполяризационная рефрактерность» [138].
Различия в восстановлении возбудимости в нормальных волокнах и в клетках с низким потенциалом могут быть связаны с различием ионных механизмов, определяющих деполяризацию. Деполяризация в большинстве нормальных волокон зависит от активации каналов для быстрого входящего тока Na+. Деполяризация, в свою очередь, приводит к инактивации этих каналов, делая их невозбудимыми. Устранение инактивации должно происходить раньше, чем натриевые каналы обретут утраченную реактивность.
К тому времени, когда реполяризация продвинется до уровня —40 или —50 мВ, достаточное количество каналов будет восстановлено, что обеспечит ответ клетки (конец абсолютного рефрактерного периода). В норме к моменту реполяризации клетки до уровня от —85 до —95 мВ отмечается практически полное восстановление быстрых Na+-каналов и, следовательно, возбудимости и проводимости. С другой стороны, как указывалось ранее, деполяризация обычно низкопотенциальных волокон синусового и атриовентрикулярного узлов [30, 33, 60—65], а также клеток в створках АВ-клапанов и коронарного синуса [66, 67] зависит главным образом от медленного входящего тока. Это в определенной мере справедливо и для частично деполяризованных волокон в зоне экспериментального инфаркта миокарда [30, 74, 75, 93] и в пораженной (хронически) сердечной мышце [36, 78, 85—87, 91, 92]. Устранение инактивации в медленных каналах происходит значительно дольше, чем в быстрых, так что рефрактерность может запаздывать относительно полной реполяризации на сотни миллисекунд. На рис. 4.6 (фрагменты I и II) для сравнения показано восстановление нормально поляризованных и частично деполяризованных волокон Пуркинье. В нормально поляризованном волокне возврат к диастолическому потенциалу и функциональное восстановление протекают практически параллельно. В частично же деполяризованном волокне восстановление обнаруживает свою существенную зависимость от времени. Полного функционального восстановления не наблюдается вплоть до середины диастолы. Замедление процесса восстановления быстрых Nа+-каналов возможно и в некоторых других условиях, включая воздействие определенных препаратов [45, 46, 146—149], так что значительная постреполяризационная рефрактерность может отмечаться даже в нормально поляризованных клетках. Показанные на рис. 4.6 (фрагмент III) примеры такого явления в нормально поляризованной клетке желудочкового миокарда человека свидетельствуют о том, что заболевание миокарда способно оказывать аналогичное влияние. Подобные изменения предрасполагают к аберрации проведения преждевременных ответов, возникающих в поздние фазы или в фазу реполяризации, а также во время диастолы.
Снижение мембранного потенциала во время электрической диастолы (фаза 4) возможно также вследствие уменьшения потенциала покоя и (или) в результате спонтанной диастолической деполяризации автоматических клеток. На основании кривых реактивности (см. рис. 4.3, Б) можно предположить, что снижение диастолического потенциала вызовет изменения характеристик потенциала действия и проведения, аналогичные наблюдаемым при реполяризации [54, 56, 115]. Следовательно, распространение импульсов в волокнах с низким диастолическим потенциалом должно сопровождаться медленным проведением и аберрацией.
В норме низкий потенциал покоя встречается только в клетках АВ-узла, где он, по-видимому, способствует медленному проведению [25, 30]. В противоположность этому, при экспериментальном инфаркте миокарда [74, 75, 93] и в пораженном сердце человека [76, 77, 87, 91, 92] низкий потенциал покоя наблюдается довольно часто. На рис. 4.7 показаны снижение величины диастолического потенциала и медленное проведение в желудочковом миокарде человека. Кроме того, многие физиологические и химические воздействия на миокард, включая перерастяжение, ишемию, гипоксию, изменения рН, изменение ионного состава и высокие концентрации антиаритмических препаратов, снижают потенциал покоя [24, 25, 28—30, 32, 35, 38—43], вызывая тем самым нарушения проводимости. Хорошо изученным примером подобной аномалии служат вызванные гиперкалиемией нарушения внутрипредсердного и внутрижелудочкового проведения.

Рис. 4.6. Регистрация трансмембранных потенциалов и одновременно полученные биполярные электрограммы нормального (фрагмент I) и частично деполяризованного (фрагмент II) волокон правой ножки пучка Гиса у собаки показывают зависимое от времени увеличение рефрактерного периода при деполяризации.
Ответы 1, 2 и 3 возникают при преждевременной стимуляции в определенные моменты сердечного цикла. Ответ I является самым ранним из наблюдаемых ответов, который определяет окончание абсолютного рефрактерного периода; 2 — самый поздний ответ, характеризующийся достаточным снижением амплитуды и Vmax, в результате чего форма комплекса на электрограмме изменяется (аберрантный QRS); 3 — наиболее ранний ответ нормальной формы, который определяет время полного восстановления возбудимости. В нормальном волокне восстановление возбудимости и проведения, т. е. исчезновение рефрактерности, практически совпадает по времени с окончанием реполяризации. С другой стороны, в частично деполяризованном волокне рефрактерность по своей длительности явно превосходит реполяризацию (в данном случае весьма существенно). Такое зависящее от времени увеличение рефрактерного периода повышает предрасположенность к аберрации даже поздних экстрасистол. Фрагмент III: постреполяризационная рефрактерность в образце папиллярной мышцы больного с ревматическим заболеванием сердца, осложненным застойной сердечной недостаточностью, а также предсердной и желудочковой эктопией высокой степени на фоне аберрантного проведения вследствие блокады правой и левой ножек пучка Гиса. Обсуждение в тексте [87}.

Рис. 4.7. Трансмембранные потенциалы в 5 клетках изолированной папиллярной мышцы больного с ревматической болезнью сердца.
Отмечается вариабельность диастолического потенциала и характеристик потенциала действия при возникновении медленного проведения и локального блока. Препарат стимулировался с интервалом в 800 мс. Регистрация осуществлялась по границе небольшой зоны рубца (возможно, давнего микроинфаркта или фиброзного тела Ашофа). На каждом фрагменте представлена одновременная запись, полученная в нормально поляризованном волокне (клетка 1) и в одном из четырех частично деполяризованных волокон (клетки 2—5), что позволяет сравнить характеристики потенциала действия и время межэлектродного проведения. Vmax во второй клетке каждой пары определяется различием в высоте пика на нижней кривой каждого фрагмента. Vmax в клетках 4 и 5 слишком мала, чтобы дать ощутимую дефлексию. Ниже приведены значения максимального диастолического потенциала (МДП), длительности потенциала действия (ДПД; определено как время реполяризации на уровне — 40 мВ) и Vmax в нулевую фазу. Отмечается возрастание времени межэлектродного проведения между клеткой 1 и клетками 4 и 5 по сравнению с таковым между клеткой I и клетками 2 и 3, о чем свидетельствует заметно увеличивающееся различие в нарастании ответов, зарегистрированных в этих клетках. В правом нижнем углу дана калибровка времени и вольтажа. Обсуждение в тексте [87].
С другой стороны, даже в нормальном сердце наблюдается деполяризация автоматических клеток в фазу 4. Наиболее хорошо известен автоматизм клеток синоатриального узла, который может способствовать медленному проведению в этой ткани. Эксперименты на волокнах Пуркинье показали, что повышенный автоматизм латентных пейсмекерных клеток может вызывать широкий спектр нарушений проведения — от простого замедления до полного блока [56]. Кроме того, развитие деполяризации в фазу 4 проксимальнее участка уже существующего блока может вызвать еще большее угнетение проведения в данной области [150]. Ввиду широкого распространения в сердце латентных пейсмекерных клеток, а также влияния многочисленных факторов окружающей среды и воздействия препаратов, усиливающих деполяризацию в фазу 4 [24, 25, 27—29, 30, 33, 34, 38—47], этот механизм может стать причиной нарушений проведения у человека. Следует учитывать, что клетки рабочего миокарда также могут проявить автоматическую активность (см. рис. 4.4) под влиянием медикаментов, ишемии и других патологических процессов, что усилит предрасположенность к развитию нарушений проведения.
Механизмы аберрантности
Аберрантность будет здесь рассматриваться прежде всего с точки зрения распространения импульсов в волокнах, мембранный потенциал которых ниже нормального, а характер нарушений связан со следующими факторами: 1) локализацией вовлеченных клеток; 2) уровнем мембранного потенциала на пути распространения импульса; механизмами снижения мембранного потенциала (неполная реполяризация, низкий потенциал покоя, деполяризация в фазу 4 или их комбинация). Будет также рассмотрена связь этих механизмов с изменениями электрофизиологических свойств вследствие заболевания или под влиянием кардиотропных препаратов. Другие возможные причины изменения формы комплексов QRS наджелудочкового происхождения, включая распространение возбуждения по аномальным предсердно-желудочковым трактам [3—7, 139—142], разрушение проводящей системы вследствие заболевания [143, 144], продольную диссоциацию проведения в пределах АВ-проводящей системы (151—154], асинхронную активацию ткани АВ-соединения [155], .нарушения «воротного» механизма системы Гис— Пуркинье [156, 157], рассогласованность входного сопротивления между волокнами раз-
личных участков системы Гис—Пуркинье в области соединения пучка с папиллярной мышцей [158], а также изменения возбудимости и кабельных свойств [30, 111—114] в этом разделе не обсуждаются.
Аберрантность классифицируется здесь на основании зависимости изменений комплекса QRS от длительности сердечного цикла [21]. При таком подходе могут быть выделены четыре основные группы: 1) аберрация короткого цикла, т. е. аберрация, наблюдаемая в сочетании с уменьшением длительности сердечного цикла и учащением сердечного ритма; 2) аберрация длительного цикла, т. е. аберрация, связанная с увеличением длительности сердечного цикла и замедлением ритма сердца; 3) аберрация без существенных изменений длительности сердечного цикла; 4) смешанная аберрация.
Аберрация короткого цикла
Аберрация короткого цикла, примером которой служит аномалия формы комплекса QRS при ранних наджелудочковых экстрасистолах и при частой наджелудочковой тахиаритмии, представляет собой именно то явление, для описания которого был впервые использован термин «аберрантность» [1, 2]. Наиболее известная и часто встречающаяся форма — это аберрация преждевременных наджелудочковых комплексов, возникающая как у клинически здоровых лиц, так и у больных с заболеванием сердца [3—7]. Распространенность спонтанной аберрации короткого цикла неизвестна. Однако исследования с использованием стимуляции предсердий позволяют предположить, что ее можно вызвать практически у каждого человека [159—161]. Аберрантные комплексы соответствуют ЭКГ-картине блока правой ножки пучка Гиса в 70—85 % случаев, наблюдавшихся в клинике [11, 162—168, 179], а также в эксперименте на нормальном сердце собаки [145, 170]. В остальных случаях отмечается аберрация типа блока левой ножки и типа неспецифического дефекта внутрижелудочкового проведения, которая, как и сочетание нескольких типов нарушений проведения, чаще встречается при заболевании сердца.
Клиническое значение аберрации короткого цикла состоит в том, что аберрантные преждевременные наджелудочковые комплексы, как одиночные экстрасистолы, так и пробежки тахикардии, могут быть очень похожи на изолированные желудочковые экстрасистолы и залпы ритмической желудочковой активности, включая пробежки желудочковой тахикардии [11, 162—169, 179]. Поэтому аберрации следует всегда учитывать при любой дифференциальной диагностике возбуждений неопределенного типа с широкими комплексами QRS.
На рис. 4.8 показана запись, полученная при холтеровском мониторинге (модифицированное поверхностное отведение V2 и внутрипредсердное отведение) у мужчин 27 лет с кардиомиопатией, осложненной тахикардией с расширенными комплексами QRS, где первоначально предполагалось их желудочковое происхождение ввиду наличия формы, характерной для блока левой ножки, присутствия промежуточных (сливных) комплексов и четких признаков преждевременных желудочковых возбуждений аналогичной конфигурации. Тот факт, что «пробежке» предшествует наджелудочковая экстрасистола, имеющая нормальную форму, несмотря на длительный предшествующий цикл, а также то, что интервал сцепления этой экстрасистолы с предшествующим синусовым комплексом существенно отличается от интервала между ней и первым широким комплексом QRS, свидетельствует в пользу желудочкового происхождения тахикардии, не говоря уже о том, что многие явно наджелудочковые экстрасистолы имеют аберрацию типа блока правой ножки. Анализ внутрипредсердного отведения отчетливо показывает наджелудочковое происхождение тахикардии с широкими QRS, а также аберрантного комплекса с признаками блока правой ножки, поскольку каждому комплексу QRS на поверхностной ЭКГ предшествует возбуждение предсердий. Это контрастирует с аналогично конфигурированным преждевременным возбуждением желудочков на рис. 4.8 (фрагмент II), где возникновение комплекса QRS предшествует предсердному зубцу.
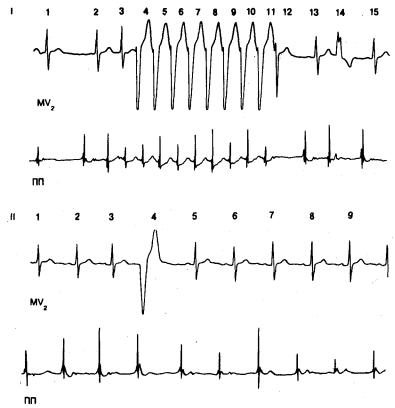
Рис. 4.8. Запись, полученная при холтеровском мониторинге у больного 27 лет с подозрением на желудочковую тахикардию на фоне кардиомиопатии. На каждом из представленных фрагментов одновременная запись в модифицированном поверхностном отведении V2 (MV2) и внутрипредсердном отведении (ПП—правое предсердие).
Фрагмент I: в отведении MV2 отмечается серия из 9 возбуждений с шириной QRS, характерной для блокады левой ножки пучка при тахикардии неизвестного происхождения (возбуждения 4—11), которой предшествует преждевременное наджелудочковое возбуждение с нормальной конфигурацией (возбуждение 3) и которая заканчивается возбуждением (12), имеющим промежуточную форму (сливной комплекс?). Обратите внимание: комплекс 3 не является аберрантным, хотя он завершает короткий цикл, следующий за продолжительным циклом; кроме того, интервал сцепления в первом возбуждении с широким QRS (возбуждение 4) короче (9,26 с) интервала между последним возбуждением с широким QRS и сливным комплексом, заканчивающим приступ (0,35 с). Помимо тахикардии, здесь наблюдаются изолированные экстрасистолы, по своей форме соответствующие блокаде правой ножки пучка (фрагмент I, возбуждение 14) и блокаде левой ножки (фрагмент II, возбуждение 4). Во внутрисердечном отведении расширенным комплексам QRS при тахикардии, а также возбуждению 14 (фрагмент I) предшествует зубец предсердного возбуждения, что позволяет идентифицировать их как наджелудочковую аберрацию вследствие блокады левой и правой ножек пучка соответственно. И наоборот, начало возбуждения 4 с QRS, характерным для блокады левой ножки (фрагмент II), предшествует появлению предсердного зубца, что указывает на его желудочковое происхождение. Обсуждение в тексте.
Попытки определения критериев отличия аберрантных наджелудочковых возбуждений от эктопических желудочковых возбуждений [11, 162—169, 179] предпринимались неоднократно. Однако безусловные различия пока не найдены, особенно в случаях наджелудочковой аритмии без отчетливых зубцов Р, например при очень ранних предсердных экстрасистолах, когда зубец Р накладывается на волну T предшествующего синусового возбуждения, а также при некоторых типах ритма АВ-соединения и при мерцании предсердий. Последнее представляет особую проблему. В случае сомнений диагностически ценной может оказаться чреспищеводная или внутрисердечная регистрация (см. рис. 4.8).
Некоторые исследователи рассматривают данный тип аберрации как нормальное явление [174, 175], однако другие полагают, что в определенных условиях его наличие может указывать на скрытое поражение проводящей системы [11, 159—161, 171—173]. Вопрос осложняется тем, что отсутствие клинических признаков заболевания сердца не обязательно отрицает локальное поражение какого-либо участка проводящей системы. Наши наблюдения совпадают с данными Chung [7], согласно которым отдельные аберра-
ции очень ранних наджелудочковых экстрасистол или очень частой наджелудочковой тахикардии .представляются вполне физиологичными. С другой стороны, необычно высокая частота аберрантных возбуждений или аберрация при длинных интервалах сцепления, особенно когда возбуждение возникает во время диастолы или при физиологических частотах ритма, вызывает серьезное подозрение на предшествующее поражение проводящей системы. Его вероятность еще больше повышается при обнаружении аберрантных признаков блока левой ножки или смешанного блока левой и правой ножек. Кроме того, имеющиеся данные позволяют усмотреть существование связи между аберрантностью короткого цикла и повышением предрасположенности к желудочковой эктопической активности [176]. Такая связь не вызывает удивления, так как распространение импульса на участках медленного проведения может теоретически привести к циркуляции возбуждения и аберрации. Таким образом, высокая степень аберрантности короткого цикла может служить предвестником желудочковой аритмии.
Электрофизиологические механизмы. В нормальном сердце аберрантность короткого цикла наиболее естественно объясняется с точки зрения нарушения проведения в не полностью реполяризованных волокнах системы Гис—Пуркинье, причем, характер аберрации связывается с локализацией поврежденных волокон и уровнем потенциала, до которого они реполяризуются к моменту прихода возбуждения. Вообще говоря, группа вовлеченных волокон предположительно имеет подпучковую локализацию, однако если учесть, что отдельные продольные тракты нормальной АВ-проводящей системы могут функционировать независимо [151— 154], то нельзя исключать и развития аберрации вследствие повреждения в пучке Гиса и, возможно, даже в АВ-узле.
Допустим, например, что затронутая группа клеток локализуется в основной ветви правой ножки пучка Гиса. Если распространяющийся потенциал действия достигнет ее раньше, чем ее мембранный потенциал успеет восстановиться до уровня примерно — 50 мВ, то он (предположительно) либо вовсе не сможет возбудить клетки правой ножки, либо вызовет только местный ответ с последующей блокадой высокой степени в этой зоне. Правый желудочек будет деполяризоваться обходным путем через левую ножку, левожелудочковую часть системы Пуркинье и миокарда и, наконец, правожелудочковую часть системы Пуркинье и миокарда. В результате задержка активации правого желудочка проявится как аберрация типа «полного» блока правой ножки пучка Гиса. Если к моменту прихода импульса реполяризация приблизится к своему завершению, то проведение на этом участке замедлится раньше, чем разовьется полный блок и возникнет аберрация, характерная для неполной блокады правой ножки. Аналогичным образом повреждение в системе левой ножки пучка приведет к нарушениям проведения типа блокады левой ножки и т. п. Поскольку фаза быстрой реполяризации потенциала действия обозначается как «фаза З», аберрантность короткого цикла также получила название «аберрантности в фазу З» или «блокады в фазу 3» [11].
Аберрации наджелудочковых экстрасистол
Наиболее частой формой аберрации короткого цикла является изменение конфигурации QRS ранних наджелудочковых экстрасистол. На рис. 4.9 показаны нормальные и аберрантные проведенные возбуждения, зарегистрированные у женщин 43 лет с системным саркоидозом и у мужчины 53 лет с ишемической болезнью сердца. Аберрантные комплексы, за исключением одного (см. рис. 4.9, IA), имеют конфигурацию, характерную для блокады правой ножки пучка Гиса. При сравнении нормальных и аберрантных комплексов отмечается зависимость аберрации от степени преждевременности появления комплекса и длительности предшествующего цикла [159, 162—164, 177, 178]. В общем, чем раньше возникает преждевременный комплекс и чем длительнее предшествующий цикл, тем вероятнее развитие аберрации и заметнее отклонение от нормы. Эта связь, описанная много лет назад Lewis и Master [177] и Scherf [178], наилучшим образом иллюстрируется различием форм QRS в комплексах с сопоставимой преждевременностью на рис. 4.9,1. Тот факт, что комплексы 1 и 2 на рис. 4.9, IA являются аберрантными, тогда как комплекс 3 представляет нормальный QRS, несмотря на несколько большую степень преждевременности, также можно объяснить с точки зрения различий в длительности предшествующих циклов. Сокращения 8—11 на рис. 4.9,11В и Г, наиболее аберрантные на полученной записи, заслуживают особых комментариев, поскольку, на первый взгляд, они представляются гораздо более поздними по сравнению со многими неаберрантными комплексами. Более тщательный анализ показывает, что эти комплексы в действитель-

ности являются самыми ранними на данной записи, а преждевременные волны Р сливаются с волнами Т предшествующих синусовых комплексов и проводятся с увеличением интервала Р—R. В определенном смысле увеличение Р—R таких ранних комплексов можно считать аберрацией проведения по системе АВ-узел — пучок Гиса.
Рис. 4.9. ЭКГ, демонстрирующие вариабельность аберраций предсердных экстрасистол и зависимость этого явления от длительности цикла.
Фрагмент I: отведения I (А) и II (Б и В) у больной 43 лет с саркоидозом; цифрами 1—12 обозначены преждевременные наджелудочковые возбуждения. Возбуждение I соответствует аберрации при блокаде левой ножки пучка; возбуждения 2, 5,7, II и 12 представляют варианты аберрации вследствие блокады правой ножки. Остальные экстрасистолы имеют нормальную конфигурацию. Отмечается зависимость аберрации от интервала сцепления и длительности предшествующего цикла. Фрагмент II: ритмограмма в модифицированном (холтеровском) отведении V1 у больного 54 лет с ишемической болезнью сердца и предсердной эктопией высокой степени показывает широкий спектр изменений комплекса QRS вследствие зависимых от длительности цикла вариаций аберрантности короткого цикла. Запись содержит 11 изолированных предсердных экстрасистол, обозначенных цифрами I—11, и один триплет (2 экстрасистолы 6а и 66). Экстрасистолы 2, 6а и 66 имеют нормальную форму комплекса QRS, остальные же — характеризуются различными аберрациями, обусловленными блокадой правой ножки пучка Гиса. Как и на фрагменте I, аберрации и здесь, вообще говоря, являются функцией преждевременности возбуждения и длительности предшествующего цикла. При исследовании возбуждений 8—II трудности в дифференциации аберрантных наджелудочковых и желудочковых экстрасистол возникают в том случае, когда четко очерченный эктопический зубец Р не определяется из-за наложения предшествующего ему зубца Т (как в данном примере) или вследствие других причин. Особенно поразителен эпизод бигеминии (запись Г). Обсуждение в тексте.
На рис. 4.9,1 даже самые причудливые комплексы идентифицируются скорее как наджелудочковые, нежели желудочковые, из-за явно аномальных предшествующих зубцов Р. С другой стороны, на фрагменте II того же рисунка наиболее аберрантные комплексы трудно отличить от желудочковых эктопических Комплексов, особенно в период бигеминии (см. рис. 4.9, Г, сокращения
9—11); диагноз основывается на выявлении в той же записи более явных предсердных экстрасистол с промежуточной степенью аберрации. Неполные компенсаторные паузы после аберрантных комплексов также предполагают наджелудочковое проис-
хождение [3—7]. Однако этот отличительный признак не является абсолютным, поскольку предсердные экстрасистолы могут вызывать полные компенсаторные или даже более продолжительные паузы [181—183].
Электрофизиологические детерминанты аберрации
Из описанной выше взаимосвязи мембранного потенциала и проведения следует, что на возникновение аберрации должны оказывать влияние факторы, определяющие уровень потенциала в момент прихода распространяющегося преждевременного импульса, а также отношение между мембранным потенциалом и Vmax.
Интервал сцепления. Связь между степенью преждевременности, интервалом сцепления и проведением уже обсуждалась ранее (см. рис. 4.5, А и В). При прочих равных условиях, чем раньше возникает желудочковый комплекс и чем короче интервал сцепления, тем выше вероятность того, что данный преждевременный импульс (комплекс) столкнется на пути своего распространения с неполной реполяризацией тканей. Таким образом, короткие интервалы сцепления предрасполагают к аберрации. Однако слишком ранние преждевременные импульсы (комплексы) могут блокироваться, если мембранный потенциал не успевает достигнуть достаточно отрицательного уровня, что обеспечило бы развитие регенеративного ответа (см. рис. 4.5, В, ответы а и б). Вариации аберрантности преждевременных предсердных комплексов на рис. 4.5, В и 4.7 во многом объясняются с точки зрения степени преждевременности.
Длительность предшествующего цикла. Связь длительности предшествующего цикла с аберрантностью обычно не менее очевидна, по крайней мере в нормальном сердце. Временная последовательность и продолжительность реполяризации и рефрактерности является функцией частоты стимуляции практически во всех тканях сердца, за исключением синусового и атриовентрикулярного узлов [25, 145, 170, 184]. Уменьшение длительности цикла сокращает время реполяризации. Увеличение длительности цикла приводит к противоположному эффекту. Следовательно, чем продолжительнее предшествующий цикл, тем больше длительность потенциала действия основного возбуждения и выше вероятность того, что импульс (комплекс) с данной преждевременностью встретит на своем пути не полностью реполяризованные волокна и его проведение окажется аномальным.
На рис. 4.10, А показано влияние продолжительности цикла на длительность потенциала действия нормальных переходных волокон Пуркинье, а также связь между продолжительностью предшествующего цикла, длительностью потенциала действия и мембранным потенциалом, с которым встречается гипотетический импульс (комплекс), распространяющийся с постоянной преждевременностью (см. рис. 4.10, Б). С одной стороны, при наиболее продолжительном цикле (2000 мс) длительность потенциала действия настолько велика, что преждевременный стимул приходится на тот момент времени, когда уровень мембранного потенциала еще слишком низок, чтобы обусловить распространение ответа, поэтому проведение не осуществляется. С другой стороны, длительность потенциала действия при наиболее коротком цикле (200 мс) настолько мала, что преждевременный ответ возникает непосредственно перед полной реполяризацией или сразу же после нее и поэтому проводится нормально. При промежуточной длительности цикла (400—630 мс) длительность потенциала действия такова, что преждевременный ответ характеризуется уменьшением амплитуды и Vmax, а значит, и нарушением проведения. Таким образом, длительные предшествующие циклы предрасполагают к аберрации преждевременных комплексов. И наоборот, короткие предшествующие циклы способствуют уменьшению аберрации.

Рис. 4.10. Регистрация трансмембранных потенциалов в нормальном волокне Пуркинье сердца собаки показывает связь между длительностью цикла (ДЦ), длительностью потенциала действия (ДПД) и уровнем мембранного потенциала, при котором гипотетическая экстрасистола возникает с фиксированной преждевременностью.
А — влияние резкого повышения частоты возбуждения (уменьшения ДЦ с 2000 до 200 мс) на характеристики потенциала действия, включая ДПД. ДЦ, с которой стимулируется препарат, и ДПД, определяемая как время, необходимое для реполяризации на уровне — 60 мВ, указаны в миллисекундах. Отмечается постепенное уменьшение ДПД при повышении частоты стимуляции. Б — нормальная связь между предшествующей ДЦ и мембранным потенциалом в момент преждевременного возбуждения. Репрезентативный потенциал действия показан для каждой частоты, Для удобства сравнения ДПД моменты начала нарастания потенциалов сделаны равными. Вертикальная линия помогает определить уровень мембранного потенциала в момент возникновения экстравозбуждения с постоянным интервалом сцепления в 190 мс. Метки времени отложены с интервалом в 50 мс. Калибровка потенциала и времени указана в нижнем правом углу. Обсуждение в тексте [21].
Рис. 4.11. ЭКГ-проявления внутриклеточной активности при преждевременном возбуждении.
Фрагмент 1: трансмембранные потенциалы, зарегистрированные одновременно в двух точках волокна Пуркинье (запись А), и ритмограмма сердца мужчины 42 лет с предсердной эктопией высокой степени и аберрантностью, характерной для короткого цикла при блокаде правой ножки пучка Гиса (запись Б), наглядно показывают нормальную связь между величиной интервала сцепления, длительностью предшествующего цикла и проведением преждевременных возбуждений. Интервалы между возбуждениями указаны в миллисекундах. Ка-
либровка потенциала и времени дана внизу справа на каждом фрагменте. А — влияние преждевременной стимуляции на характеристики потенциала действия волокна Пуркинье аналогично влиянию длительности цикла на форму QRS наджелудочковых преждевременных возбуждений на записи Б. Фрагмент II: на схематически представленной поверхностной ЭКГ предсердные экстрасистолы (четвертое возбуждение на нижних кривых А и Б), по-видимому, обнаруживают альтерацию обычной связи между формой QRS, интервалом сцепления и длительностью предшествующего цикла. Несмотря на идентичность сцепления и предшествующих интервалов R—R, экстрасистола на записи А начинается до завершения реполяризации и ее проведение аберрантно, тогда как экстрасистола на записи Б возникает по окончании реполяризации и проводится нормально. На верхней кривой трансмембранные потенциалы зарегистрированы в образце пораженной папиллярной мышцы человека, где аналогичный феномен наблюдается вследствие спонтанной альтерации длительности потенциала действия в основных возбуждениях. В таких случаях только определение альтерации длительности интервала Q—T (если таковая имеется) на ЭКГ позволяет понять природу электрофизиологических механизмов этой аберрантности, Обсуждение в тексте.
На рис. 4.11,1 регистрация трансмембранного потенциала (фрагмент А) показывает взаимоотношение длительности цикла и формы преждевременных комплексов QRS (фрагмент Б). Угнетение потенциала действия и проведения преждевременного ответа, инициированного при длительности цикла 260 мс по сравнению с аналогичными параметрами при цикле в 190 мс (фрагмент А), обусловлено большей продолжительностью предшествующего цикла, точно так же, как и большая аберрантность формы комплексов QRS, инициированных при длительности цикла 500 мс, по сравнению с аберрантностью QRS при цикле в 420—460 мс (фрагмент Б). На рис. 4.11, IA показано также, насколько преждевременные ответы, идентичные по интервалу сцепления, могут отличаться по амплитуде, Vmax и проведению ввиду различий в продолжительности предшествующего цикла. Сравните, например, первый и третий преждевременные ответы, имеющие одинаковый интервал сцепления 260 мс. Уменьшение амплитуды и Vmax, а также аномалии проведения первого ответа связаны с большей продолжительностью предшествующего цикла. Аналогичным образом объясняются различия формы QRS двух комплексов, следующих с интервалом сцепления в 500 мс (Б). Представленная запись позволяет также понять, как различия в длительности предшествующего цикла приводят к тому, что даже очень ранние преждевременные возбуждения проводятся более нормально, чем возбуждения с более длинными интервалами сцепления.
Однако наблюдаются и исключения из описанного выше правила [179, 180], особенно в случаях заболевания сердца и при воздействии некоторыми лекарственными препаратами, включая стандартные антиаритмики. Отчасти это может быть обусловлено ослаблением зависимости длительности потенциала действия и рефрактерности от продолжительности цикла, что наблюдалось in vitro в ишемизированных тканях животных [74, 75] ив миокарде человека [21, 87], а также в клинических условиях [161, 180]. Дополнительное влияние может оказывать спонтанная вариабельность длительности потенциала действия при постоянной продолжительности цикла, которая также наблюдается в миокарде человека. На рис. 4.11,11 схематически представлены две предсердные экстрасистолы. Несмотря на идентичное сцепление и одинаковые предшествующие интервалы R—R, эти два комплекса заметно отличаются: один из них (фрагмент А) является аберрантным, другой (фрагмент Б) — нормальным QRS. Трансмембранные потенциалы волокон желудочкового миокарда человека, указанные над каждым фрагментом ЭКГ для объяснения изменений с точки зрения различий в длительности предшествующих циклов, обусловлены спонтанным изменением длительности потенциала действия.
Мембранный потенциал, длительность потенциала действия и рефрактерность. Ряд физиологических факторов и медикаментозных препаратов, воздействующих на сердце, влияет (обычно снижает) на диастолический потенциал либо прямо, либо опосредованно, через автоматические клетки, изменяя спонтанную диастолическую деполяризацию [25, 29, 30, 32, 33, 38—47]. Ишемия [74, 75, 93] и заболевания сердца [76, 87, 91, 92] также могут уменьшать диастолический потенциал.
Как показывают полученные данные, уровень мембранного потенциала способен влиять на продолжительность реполяризации и рефрактерности. Это видно на рис. 4.7 и 4.14, где потенциалы действия, возникающие при низких уровнях мембранного потенциала, характеризуются сокращением ранних стадий реполяризации (фаза 2 и начало фазы 3). Конечный период фазы 3, с другой стороны, относительно пролонгирован. Это скажется на проведении преждевременных импульсов по крайней мере двояко. Следует ожидать, что сокращение фазы 2 и начала фазы 3 уменьшит число полностью блокирующихся преждевременных импульсов. Увеличение терминального периода фазы 3 повы-
сит вероятность того, что какой-либо из преждевременных ответов встретит на пути своего распространения не полностью реполяризованные волокна. И то и другое в целом предрасполагает к повышенной аберрантности короткого цикла. Увеличение фазы 3 будет отчасти способствовать развитию аберрантности при более длительных, чем в норме, интервалах сцепления.
Как отмечалось ранее, возможны и другие способы влияния уровня мембранного потенциала на рефрактерность и проведение, кроме рассмотренной связи между степенью преждевременности возбуждения и предрасположенностью к нарушениям проведения и аберрации. Одним из таких механизмов является развитие автоматизма и медленного проведения в клетках с низким потенциалом. Кроме того, возможно увеличение рефрактерного периода до значений, превышающих длительность потенциала действия, а также изменения нормальной зависимости длительности потенциала действия от продолжительности цикла. Эти механизмы следует учитывать при заболевании сердца, так как в норме низкий диастолический потенциал наблюдается только в узловых клетках и, возможно также, в клетках створок АВ-клапанов и устья коронарного синуса.
Изменения в пораженных тканях сердца. Ишемия [30, 74, 75, 93, 187] и другие патологические состояния [73—92], вызванные экспериментально [186] или возникшие спонтанно [36], по-видимому, существенно влияют на временные характеристики реполяризации и рефрактерности как прямо, так и посредством снижения диастолического потенциала. За исключением ранних стадий ишемии, когда время реполяризации сокращается, эти состояния, как правило, сопровождаются увеличением длительности реполяризации и рефрактерности.
Наблюдаемые изменения отчасти соответствуют приведенным выше данным о том, что в миокардиальных препаратах, полученных у животных после экспериментального инфаркта, а также у человека с заболеванием сердца, содержится большое количество частично деполяризованных клеток, многие из которых обнаруживают признаки медленного ответа. Более того, такого рода изменения реполяризации и рефрактерности отмечаются и в некоторых нормально поляризованных волокнах подобных препаратов [74, 83, 84, 87]. Степень таких изменений в нормально поляризованных клетках неясна. Но учитывая абсолютное преобладание нормально поляризованных клеток даже в пораженном сердце, потенциальное повышение частоты и видоизменения аберрации у больных с заболеванием сердца могут быть значительными.
Длительность реполяризации. На рис. 4.7 показана регистрация активности в 5 глубоких интрамуральных клетках папиллярной мышцы больного с аберрациями коротким циклом блокады правой ножки пучка Гиса и аберрацией типа блока левой ножки при ревматическом поражении сердца, осложненном предсердной и желудочковой эктопией. В отличие от нормального сердца здесь наблюдается значительная локальная вариабельность характеристик как диастолического потенциала, так и потенциала действия, включая Vшах и длительность периодов реполяризации, а также местная блокада высокой степени. В частности, отмечается выраженное увеличение терминальной части фазы 3 в частично деполяризованных волокнах. Аналогичные признаки показаны на рис. 4.14. Увеличение длительности реполяризации может быть еще более выраженным при ранней постдеполяризации типа осцилляторной активности [12—15, 70—72]; иногда отмечается ее возрастание до нескольких секунд [74, 83, 84, 87]. На рис. 4.4, II представлена регистрация в клетке желудочкового миокарда человека.
Постреполяризационная рефрактерность и изменение реактивности. В частично деполяризованных и нормально поляризованных волокнах инфарктного желудочка сердца собаки [74, 75, 138, 185, 187] и пораженных желудочков человека [21, 36, 80, 82—84, 87] также могут наблюдаться постреполяризационная рефрактерность и изменения реактивности миокарда, аналогичные показанным на рис. 4.3, Б (кривая для клетки б).
На рис. 4.6,111 показана постреполяризационная рефрактерность в незначительно деполяризованном волокне желудочкового миокарда человека (потенциал покоя —70 мВ). Обратите внимание, что стимуляция непосредственно перед окончанием реполяризации приводит к угнетению ответа даже при практически полном возврате мембранного потенциала к уровню потенциала покоя (рис. 4.6, IIIA). На рис. 4.6,1НБ второй и гораздо более поздний ответ, инициированный после завершения реполяризации, обнаруживает значительное снижение амплитуды и Vmax в тот момент, когда достигнуто полное восстановление. Еще более поразительны подобные изменения в постэкстрасистолических возбуждениях на рис. 4.12, где интервал между преждевременным и постэкстраси-

столическим возбуждениями достаточно велик (около 570— 580 мс). Тот факт, что исследуемая клетка деполяризуется лишь очень незначительно (—78 мВ), означает, что постреполяризационная рефрактерность не ограничивается клетками с низким потенциалом и медленным ответом. Мембранные механизмы, предшествующие этому явлению в нормально поляризованных клетках, еще не известны; однако, как полагают, данный феномен отражает (по крайней мере частично) задержку восстановления каналов для входящего Na+ после их инактивации, вызванной деполяризацией.
Влияние изменений реактивности еще сложнее, поскольку оно связано со смещением кривой вниз и вправо при средних уровнях потенциала и вверх и влево — при низких его уровнях (см. рис. 4.3, Б). Смещение кривой вправо приводит к возникновению медленно проводящихся (аберрантных) ответов при более отрицательных уровнях потенциала и, следовательно, в более позднюю фазу цикла, чем в норме. С другой стороны, смещение влево при меньших величинах потенциала должно повысить число аберраций в самом начале периода восстановления, поскольку облегчается генерирование медленно проводящихся ответов при уровнях потенциала, в норме являющихся слишком низкими для поддержания какой бы то ни было активности.
Рис. 4.12. Трансмембранные потенциалы в папиллярной мышце или в переходных волокнах Пуркинье, зарегистрированные в образце миокарда больного с хронической ревматической болезнью сердца, а также схематическая поверхностная ЭКГ.
Нераспространяющиеся преждевременные ответы обусловливают аберрации проведения постэктопического возбуждения даже при отсутствии изменений длительности основного сердечного цикла. Препарат регулярно стимулировался с интервалом в 100 мс (60 уд/мин). Фрагменты А—В: основное возбуждение прерывается во всех трех случаях ранним преждевременным ответом (а, бив). Преждевременный ответ «а» возникает достаточно поздно и не вызывает распространения экстравозбуждения, что электрокардиографически проявляется типичной аберрантностью короткого цикла. С другой стороны, преждевременный импульс «в» возникает Столь рано, что в результате наблюдается лишь небольшой, нераспространяющийся, локальный (скрытый) ответ. То же, вероятно, справедливо для ответа «б». Обратите внимание: постэкстрасистолические возбуждения 1, 2 и 3 дают выраженное снижение амплитуды и Утаи по сравнению с другими основными возбуждениями, что обусловливает аберрантность. В случае постэкстрасистолического возбуждения 3 аберрация будет наблюдаться как возникающая в отсутствие ощутимых изменений длительности цикла, поскольку предшествующий нераспространяющийся локальный ответ «в» электрокардиографически не проявится. Возбуждения 1, 2 и 3 также характеризуются вариабельной альтерацией во время реполяризации, что определяется по изменениям постэктопического зубца Т. Существенные изменения амплитуды и Vmax не проявляются вне первого постэкстрасистолического возбуждения. Изменения же в реполяризации сохраняются в течение нескольких возбуждений. Отметки времени даны с интервалом 50 мс. Калибровка потенциала и времени показана справа вверху. Обсуждение в тексте [21].

Рис. 4.13. Трансмембранные потенциалы нормально поляризованной клетки миокарда, зарегистрированные в образце свободной стенки левого желудочка больного с желудочковой аневризмой.
Показано изменение зависимости длительности потенциала действия (ДПД) от длительности цикла (ДЦ), а также необходимость большего времени для достижения нового стабильного значения длительности после изменения частоты стимуляции. Фрагмент I: влияние резкого повышения частоты стимуляции. А — при стимуляции с ДЦ 2000 мс (30 уд/мин). Б—Г — непрерывная регистрация активности до и после резкого повышения частоты стимуляции до 300 уд/мин (ДЦ=200 мс). Артефакты стимуляции отмечены точками. Вначале полное возбуждение наблюдается при каждом втором стимуле, за исключением одного локального ответа (первая стрелка, запись Б). Стрелки в конце записи Б, в начале и в конце записи В, а также в начале записи Г указывают моменты репрезентативно неэффективной стимуляции. Уменьшение ДПД, необходимое для возникновения ответа 1:1, наблюдается лишь через 15 с после повышения частоты (конец записи Г). Отмечается начальное чередование амплитуд ответов вследствие различий в величине мембранного потенциала при возбуждении. Такая вариабельность сохраняется до тех пор, пока ДПД не уменьшится в достаточной мере, что обеспечит возникновение последующих возбуждений при том же уровне потенциала (запись Д). Достижение нового стабильного состояния требует дополнительно 30 с, в целом составляя 45 с (190 возбуждений). Отмечается также более выраженное замедление фазы нарастания потенциала действия (Vmах) при ДЦ 200 мс по сравнению с нормальным миокардом желудочка собаки (см. рис. 4.10). Фрагмент II: влияние последующего снижения частоты стимуляции снова до 30 уд/мин (ЛЦ= 2000 мс). Запись А получена вскоре после записи Д на фрагменте I; она показывает стабильные потенциалы действия при ДЦ 200 мс, а также первое возбуждение после снижения частоты стимуляции. Записи А и Б являются непрерывными; записи В, Г и Д получены соответственно через 48, 106 и 206 с после снижения частоты. При сравнении с записью А на фрагменте I видно, что форма потенциалов действия возвращается к контрольной лишь через 206 с после снижения частоты стимуляции (103 возбуждения). Калибровка потенциала и времени показана справа вверху и внизу. Отметки времени даны с интервалом 50 мс. Обсуждение в тексте.
Изменение зависимости длительности потенциала действия от продолжительности цикла. В отношении вероятности аберраций важное значение имеют также данные о том, что в частично деполяризованных или нормально поляризованных волокнах миокарда после экспериментального инфаркта у собаки [70, 71, 74, 75] и в тканях сердца человека [21, 36, 77, 80—84, 87] необязательно отмечается обычная связь между длительностью потенциала действия и продолжительностью цикла. В некоторых волок-
нах данная зависимость может быть качественно нормальной, однако степень сокращения длительности потенциала действия при этом ниже, чем в норме, а время стабилизации нового уровня больше (рис. 4.13). В ряде волокон длительность потенциала действия остается практически неизменной при изменении продолжительности цикла, тогда как в остальных — возможно ее изменение в противоположную сторону относительно нормы (рис. 4.14). Иногда спонтанные изменения длительности потенциала последовательных возбуждений наблюдаются даже в отсутствие изменений продолжительности цикла (см. рис. 4.11,11).
Частота и форма аберраций наджелудочковых экстрасистол при заболевании сердца. Описанные выше изменения (одно из них или в любой комбинации) в критических зонах системы Гис—Пуркинье в целом предрасполагают к усилению аберрантного проведения экстрасистол, особенно возникающих в конце фазы реполяризации и во время диастолы. Они также способствуют искажению проявлений аберрантности. Например, поскольку левый желудочек затрагивается патологическими процессами в большей степени, чем правый, эти изменения, способствующие увеличению числа аберраций типа блокады левой ножки и аберраций смешанного типа, чаще наблюдаются в органически пораженных тканях и реже — в здоровом сердце. Кроме того, подобные изменения нарушают обычное отношение между длительностью предшествующего цикла и развитием аберрации, так что последняя становится гораздо менее предсказуемой и, следовательно, труднее отличимой от желудочковой эктопии.
Сказанное, видимо, четко коррелирует с данными, полученными у больных с органическим заболеванием сердца при электростимуляции предсердий и гисографии: при повышении частоты стимуляции рефрактерные периоды у них остаются без изменений или даже возрастают. Более того, наблюдаемые у них аберрации чаще всего имеют тип блокады левой ножки пучка или бывают смешанного типа, а их возникновение не связано с длительностью предшествующего цикла [161, 179, 180]. И наконец, так как вызываемые заболеванием изменения обычно неоднородны [75, 80, 82, 87], они повышают электрическую негомогенность и предрасполагают к фрагментации возбуждения и его циркуляции, что дает дополнительные основания связать аберрантность с нарушениями ритма.
Характеристики системы Гис—Пуркинье. Электрофизиологические свойства системы Гис—Пуркинье служат дополнительным важным фактором, определяющим аберрантность короткого цикла. Вероятность прохождения преждевременного наджелудочкового импульса через не полностью реполяризованные волокна и аберрация проведения повышаются при постепенном увеличении длительности потенциала действия между проксимальной частью пучка Гиса и периферическими волокнами Пуркинье (см. рис. 4.1, Б) [17, 25, 145, 156, 188]. В результате ранние преждевременные импульсы, поступающие в систему Гис—Пуркинье из АВ-узла, вероятнее всего, будут встречать на своем пути к дистальным отделам проводящей системы все менее поляризованные волокна, что приведет к угнетению распространяющегося потенциала действия и развитию нарушений проведения. Удивительно, что аберрация при этом возникает не чаще, чем это наблюдается даже в нормальном сердце. Как полагают, многие импульсы, которые должны бы проводиться аберрантно, по мере своего продвижения к менее поляризованным участкам постепенно затухают и блокируются [17, 18, 145, 188, 189].
Преобладание аберрации типа блокады правой ножки пучка отмечалось неоднократно. Для его объяснения был предложен целый ряд гипотез [11, 170, 188, 190—192]. Rosenbaum и соавт. [11] относят это на счет большей длины правой ножки. Они постулировали следующее: хотя ранний наджелудочковый преждевременный комплекс должен бы проводиться с одинаковой скоростью по обеим ножкам, большая длина правой ножки обусловливает задержку активации правого желудочка. Предполагается также определенная ответственность анатомических особенностей правой ножки, которые делают ее необычайно чувствительной к влиянию перерастяжения в сочетании с дилатацией правого желудочка. Однако большинство исследователей интерпретируют эти находки как отражение различий в реполяризации и рефрактерности правой и левой сторон. Экспериментальные данные противоречивы, причем некоторым исследователям не удалось найти достоверных различий между правой и левой сторонами [188— 191]. Однако достаточно весомые данные, полученные во время недавних исследований системы Гис— Пуркинье собаки как in vitro [156, 157, 192, 193], так и in situ [170], а также при клинических электрофизиологических исследованиях [161], указывают, что длительность реполяризации и рефрактерность справа действительно несколько больше. Данные некоторых из этих исследований [156] относительно наблюдаемой иногда большей длительно-

сти потенциала действия слева (по сравнению с правой стороной) и отсутствия в ряде случаев достоверных различий между двумя сторонами позволяют объяснить эпизодическое возникновение в нормальном сердце аберрации типа блокады левой ножки пучка Гиса и аберрации смешанного типа.
Рис. 4.14. Трансмембранные потенциалы действия нормально поляризованного (клетка 2) и частично деполяризованного (клетка 1) волокон в образце папиллярной мышцы больного с тяжелым ревматическим заболеванием сердца.
Показаны зависимые от длительности цикла (ДЦ) изменения характеристик потенциала действия, включая амплитуду, Vmax, длительность потенциала действия (ДПД) и продолжительность реполяризации. Справа приведены значения ДЦ стимуляции, максимального диастолического потенциала (МДЦ) и ДПД (на уровне 75 % реполяризации). Амплитуда зубца на нижней кривой каждого фрагмента показывает величину Утаи в клетке 2. Обратите внимание: в то время как ДПД нормально поляризованного волокна быстро уменьшается при повышении частоты стимуляции, ДПД частично деполяризованного волокна не только не обнаруживает значительного снижения, но даже возрастает, что приводит к возникновению последующего потенциала действия на хвосте предыдущего при гораздо более низкой частоте (60 уд/мин; ДЦ= 100 мс), чем в нормальном волокне (240 уд/мин;
ДЦ = 250 мс). Затем наблюдается постепенное снижение МДП, амплитуды и Vmaх, а также замедление проведения. На то, что клетка 2 в действительности не является вполне нормальной, несмотря на приемлемый уровень диастолического потенциала, указывает постепенное уменьшение Утих при повышении частоты стимуляции в отсутствие изменений МДП. Обсуждение в тексте.
Однако причины увеличения числа аберраций двух указанных типов у больных органическим поражением сердца пока до конца не выяснены. Одно из возможных объяснений может основываться на относительно большем вовлечении левого желудочка в патологические процессы, которые способны понизить диастолический потенциал и вызвать электрофизиологические изменения, характерные для угнетения волокон. В той же степени, в какой эти процессы увеличивают длительность потенциала действия или рефрактерности на одном или нескольких участках левосторонней проводящей системы
(относительно таковых на правой стороне), они будут способствовать усилению аберрации типа блокады левой ножки и аберрации смешанного типа.
Интенсивно изучался также вопрос о возможном месте (местах) функциональных нарушений проведения, ответственных за появление аберрации. Теоретически блок может возникнуть у любом месте проводящей системы проксимальнее участка (или на участке) с максимальной длительностью потенциала действия периферических волокон Пуркинье (см. рис. 4.1, Б). Большинство исследователей считают, что в аберрации повинны собственно ножки пучка, а также их основные ветви [11, 17, 145, 170, 190— 195]. Другие исследователи, в том числе Lewis [I, 2] и (позднее) Myerburg и соавт. [156, 157], полагают, что блок является периферическим. Данные о том, что разрез мышцы правого желудочка может обусловить появление картины блокады правой ножки пучка [196], также указывают на периферическую локализацию блока, поскольку подобные повреждения предположительно разрушают лишь субэндокардиальную сеть Пуркинье. Третья группа авторов [160] на основании данных Moore и соавт. [197] о том, что повреждения на проксимальных и дистальных участках системы правой ножки обусловливают проявления соответственно полной и неполной блокады этой ножки, постулирует наличие двух или более мест блока.
Концепция, впервые выдвинутая Kaufman и Rothberger в 1913 г. [151] и впоследствии развитая Scherf и James [152], о наличии продольной функциональной диссоциации АВ-проводящей системы, согласно которой отдельные волокна основного ствола пучка Гиса и, возможно, даже АВ-узла соединены с определенными участками системы правой ножки пучка, а другие — с участками левой ножки, еще больше усложняет вопрос о локализации блока, поскольку это предполагает, что повреждения в АВ-узле или пучке Гиса могут приводить к нарушениям внутрижелудочкового проведения. Важное значение в этом отношении имеют электрофизиологические данные, свидетельствующие о существовании двойного проводящего пути в АВ-узле как у собак [153], так и у человека [198], а также данные о том, что повреждения и электростимуляция пучка Гиса могут иногда создавать электрокардиографическую картину, типичную для блокады ножки пучка Гиса и (или) ее ветвей [199—203]. Это подтверждается также наблюдениями Narula [154] и El-Sherif и соавт. [204] у человека; авторы обнаружили, что стимуляция дистальной части пучка Гиса приводит к устранению различных типов дефектов внутрижелудочкового проведения, проявлявшихся ранее. Возможное анатомическое обоснование этого феномена дали гистологические исследования пучка Гиса [205], показавшие разделение продольно организованных клеток плохо проводящими фиброзными перегородками с очень редкими поперечными соединениями. Однако в электрофизиологических исследованиях in vitro были представлены следующие контраргументы: хотя поперечные соединения немногочисленны, они все же присутствуют и вполне адекватны для обеспечения равномерной активации АВ-проводящей системы в нормальных условиях [200]. Отсюда следует, что возникновение диссоциации будет в основном ограничиваться теми случаями, когда поперечные соединения повреждены или разрушены патологическим процессом или внешними воздействиями на больное сердце. В подавляющем большинстве описанных случаев продольная диссоциация наблюдалась у больных с явным заболеванием сердца [154, 200], что соответствует этой точке зрения.
Тем не менее выявление специфических мест и особых механизмов блокады может оказаться иллюзорным. Если учесть большое количество переменных, влияющих на проведение, а также степень, в которой они в свою очередь испытывают локальное воздействие различных внешних факторов, не будет удивительно, что расположение, а возможно, и механизм (ы) блока меняются с изменением условий.

Рис. 4.15. Ритмограммы 4 больных, обнаруживающие предрасположенность к аберрации-, которая возникает при более низкой частоте ритма при меньшем сокращении длительности цикла (у больных с явным поражением проводящей системы сердца), чем у лиц с клинически здоровым сердцем. В конце концов аберрации могут появляться даже при более или менее нормальном ритме и при минимальном или же неощутимом уменьшении длительности цикла. Последнее, как правило, связано с блокадой левой ножки пучка Гиса и не наблюдается при блокаде правой ножки. Обсуждение в тексте.
Рис. 4.16. ЭКГ в 12 отведениях у больного 35 лет с рекуррентной пароксизмальной наджелудочковой тахикардией.
А—во время приступа тахикардии с частотой 140 уд/мин. Обратите внимание на конфигурацию комплекса, отражающего блокаду правой ножки пучка Гиса. Б — вскоре после восстановления синусового ритма.

Постоянно расширенные зубцы S в отведении от конечностей и в левых грудных отведениях указывают на остаточную задержку правостороннего проведения, которая исчезла вскоре после получения этой записи. Обсуждение в тексте.
Аберрантность и наджелудочковая тахикардия
Изменения формы QRS при наджелудочковой тахиаритмии представляют второй основной тип аберрации короткого цикла. В норме он встречается гораздо реже, чем аберрация отдельных наджелудочковых экстрасистол. По своим характеристикам он в подавляющем большинстве случаев также напоминает блокаду правой ножки пучка Гиса. С другой стороны, блокада левой ножки (неспецифическая мультиформная аберрация), видимо, часто наблюдается у больных с предшествующим заболеванием сердца или проводящей системы. Аберрация ограничивается лишь несколькими тахикардическими возбуждениями, обычно (но не всегда) начальными, или же сохраняется до возврата частоты к нормальному уровню. Отмечаются также изменения степени аберрации во время приступа тахикардии и вариации частоты ритма, при которых появляются и исчезают изменения QRS [161, 179, 180, 207]. Аберрация различной (обычно незначительной) степени может сохраняться короткое время после замедления сердечного ритма. Данный показатель, по-видимому, более характерен для больных с явным заболеванием сердца или проводящей системы, чем для лиц с клинически здоровым сердцем. Аберрации наблюдаются также при снижении частоты и при меньшем сокращении длительности цикла, поэтому они могут случайно появляться даже при нормальной частоте и минимальном уменьшении цикла [6, 179].
Рис. 4.17. Различные типы аберрантности, наблюдавшиеся при однократном холтеровском мониторинге
утого же больного, что и на рис. 4.8.
А— приступ частой наджелудочковой тахикардии (возбуждения 3—18). При первых семи возбуждениях (3—9) отмечается вариабельная аберрантность, связанная с блокадой левой ножки пучка Гиса; остальные возбуждения аналогичны доминирующим. Обратите внимание: интервал сцепления (0,52 с) первого аберрантного комплекса и длительность предшествующего ему цикла (0,92 с) больше соответствующих величин для последнего аберрантного комплекса (0,36 с и 0,34 с). Б (фрагмент I): запись, полученная рано утром во время сна или в период покоя, показывает возникновение и исчезновение аберрантности типа блокады левой ножки в сочетании с небольшими изменениями длительности цикла при синусовой аритмии. Обратите внимание на различие в величине интервала, при котором аберрация возникает (0,88 с) и исчезает (1,0 с). Б (фрагмент 2): запись, полученная через 2 ч после предыдущей, демонстрирует аберрантность типа блокады левой ножки с коротким циклом (два преждевременных предсердных возбуждения 3 и 4) и аберрантность типа блокады левой ножки с длительным циклом (постэктопическое синусовое возбуждение 7). Обратите внимание: преждевременный желудочковый комплекс (возбуждение б) имеет форму, характерную для блокады правой ножки, что предполагает его левостороннее происхождение. Обсуждение в тексте.
На рис. 4.15, А и Б показаны ритмограммы, полученные при предсердной тахикардии (150—180 уд/мин) у 2 больных в возрасте 19 лет и 51 года с анамнезом пароксизмов учащенного сердцебиения, но без каких-либо других признаков заболевания сердца. У первого больного, несмотря на частый ритм, аберрация не возникает, у второго же — в первых шести сокращениях наблюдается аберрация типа блокады правой ножки пучка Гиса. Последующие сокращения имеют нормальную конфигурацию. Запись на рис. 4.15, В и Г, сделанная у больных с коронарной болезнью сердца, демонстрирует аберрацию при последовательном понижении частоты (90 и 60 уд/мин) и минимальном сокращении длительности сердечного цикла. На рис. 4.15, Г аберрация имеет тип блокады левой ножки пучка Гиса. На рис. 4.16 показана запись, полученная у больной 35 лет с анамнезом пароксизмальной предсердной тахиаритмии на фоне ревматического поражения сердца. Электрокардиограмма на рис. 4.16, А получена во время приступа предсердной тахикардии при частоте 140 уд/мин. Обратите внимание: хотя частота тахикардии здесь ниже, чем в случае, показанном на рис. 4.15, А и Б, все комплексы имеют аберрацию, характерную для блокады правой ножки пучка Гиса. Восстановление синусового ритма обычно приводит к нормализации внутрижелудочкового проведения. Однако иногда слабо выраженная аберрация сохраняется в течение некоторого времени после восстановления синусового ритма (рис. 4.16, Б).
Запись на рис. 4.17, полученная при холтеровском мониторинге у того же больного, что и на рис. 4.8, показывает вариабельность частоты, при которой может возникать аберрация у одного и того же человека в течение суток. Аберрация соответствует блокаде левой ножки пучка Гиса. На рис. 4.17, А показан 18-комплексный всплеск частой (185 уд/мин) пароксизмальной наджелудочковой тахикардии (комплексы 3—18), причем первые возбуждения (комплексы 3—7) имеют вариабельную аберрацию типа блокады левой ножки пучка, а последние девять — отражают нормальное внутрижелудочковое проведение, несмотря на отсутствие существенных изменений в частоте. На рис. 4.17, Б развитие аберрации двух преждевременных предсердных возбуждений (3 и 4) происходит при интервалах сцепления (0,64 и 0,68 с), эквивалентных частотам 90 и 95 уд/мин. На том же рисунке аберрация наблюдается при увеличившихся интервалах (0,76—0,80 с; частота — 75 уд/мин) в сочетании лишь с минимальным сокращением длительности синусового цикла. На рис. 4.17, А также отмечаются различия в интервалах сцепления, при которых аберрация появляется (0,44 с) и исчезает (0,32 с). В тот же день у этого больного наблюдалась аберрация типа блокады правой ножки пучка Гиса (см. рис. 4.8).
Электрофизиологические детерминанты аберрации
Аберрация при наджелудочковой тахиаритмии объясняется на том же основании, что и аберрация изолированных экстрасистол, т. е. распространением возбуждения по не полностью реполяризованным волокнам. Вероятность возникновения аберрации вследствие определенного повышения частоты, а также выраженность и продолжительность нарушений проведения зависят от ряда взаимосвязанных факторов, включая тип отношения продолжительности цикла и длительности потенциала действия и рефрактерности (1), величину и резкость изменений частоты (2) и характеристики системы Гис —Пуркинье (3).
Зависимость длительности потенциала действия от продолжительности цикла. Возможная связь между зависимостью длительности потенциала действия от продолжительности цикла и возникновением аберрации наджелудочковых экстрасистол уже обсуждалась ранее. Аберрация одного или двух начальных возбуждений при наджелудочковой тахикардии имеет то же объяснение, что и аберрация экстрасистолии. С другой стороны, объяснить сохранение аберрации в течение достаточно длительного времени значительно труднее, поскольку повышение частоты в норме сопровождается постепенным уменьшением длительности потенциала действия. Однако степень, до которой длительность потенциала действия способна уменьшаться, ограничена. По мере увеличения частоты сверх определенного предела такое сокращение длительности становится все менее эффективным для компенсации уменьшающейся диастолы. В конце концов новые потенциалы действия начинают возникать раньше завершения предшествующей реполяризации, что приводит к снижению амплитуды и Vmах, а также к развитию как преходящих, так и устойчивых аномалий проведения, в том числе аберраций.
Длительность цикла, при которой потенциалы действия начинают накладываться друг на друга и претерпевать изменения, сопровождающиеся развитием нарушений
проведения, варьирует. В нормальном миокарде, за исключением ткани синусового узла и АВ-узла [25, 30, 63, 64], для возникновения значительных изменений потенциала действия и угнетения проведения обычно требуется очень большое повышение частоты. На рис. 4.10 показано влияние ступенчатого повышения частоты стимуляции на длительность потенциала действия в нормальных волокнах Пуркинье. Для заметного уменьшения амплитуды и скорости нарастания потенциала действия требовалось повышение частоты стимуляции с 30 до 300 имп/мин. Но даже при такой частоте изменения практически минимальны, что не дает оснований ожидать значительной аберрации проведения.
При нормальной зависимости длительности потенциала действия от продолжительности цикла объяснение устойчивой аберрации во время наджелудочковой тахикардии требует учета каких-либо иных механизмов, нежели простая инициация аберрантных возбуждений до завершения реполяризации предшествующего возбуждения в вовлеченной области. Одна из точек зрения состоит в том, что такая аберрация отражает влияние скрытого транссептального проведения импульсов при тахикардии, которое сопровождается ретроградной активацией вовлеченной ножки пучка, поддерживая ее в рефрактерном состоянии [ 170]. Таким образом, повторяющаяся аберрация типа блокады правой ножки пучка объясняется с позиций скрытого транссептального проведения слева направо и ретроградной активации правой ножки, в результате чего импульсы, проникающие в нее ортодромно, непременно застают ее в рефрактерном состоянии. И наоборот, прекращение аберрации следует рассматривать с точки зрения блокады транссептального проведения и ретроградной активации, как следствие ортодромного проникновения импульсов в правую ножку до ее ретроградной активации либо как результат уменьшения продолжительности реполяризации или рефрактерности в зависимости от сокращения длительности цикла. Этот механизм успешно использовался для объяснения повторяющейся аберрации в ряде описанных случаев [208—210]; его наличие было подтверждено при внутрисердечной электрографии [211, 212] и микроэлектродных исследованиях in vitro [213]. Тем не менее для нормального проявления данного механизма, вероятно, необходима высокая частота ритма.
Время достижения новой стабильной длительности потенциала действия после изменения частоты. Достижение нового устойчивого значения длительности потенциала действия после резкого изменения частоты обычно не бывает мгновенным даже в нормальных волокнах; чаще оно происходит постепенно в течение нескольких сердечных циклов [25, 214]. Аналогичные данные получены для зависимых от частоты изменений рефрактерности в сердце in situ [215]. Отсюда следует, что вероятность инициации преждевременных ответов до завершения реполяризации предшествовавшего возбуждения (а значит, и вероятность аберрации) максимальна сразу после изменения частоты и снижается с каждым комплексом при новой частоте ритма. Это позволяет объяснить случаи, когда начальный комплекс (ы) тахикардии является аберрантным, а также когда аберрация постепенно уменьшается или исчезает (см. рис. 4.15, Б). Для достижения новой устойчивой длительности потенциала действия после повышения частоты до того или иного уровня необходим ряд возбуждений, причем некоторые исследователи указывают, что обычно для этого требуется до 40—50 возбуждений [214]. И в отдельном волокне (см. рис. 4.13), и в сердце в целом (см. рис. 4.17) возможна определенная вариабельность количества возбуждений, необходимых для установления равновесия после повышения или снижения частоты. Однако большая часть изменений обычно происходит во время относительно небольшого числа возбуждений.
Изменения при заболевании сердца
Результаты исследования образцов ишемизированного и пораженного миокарда указывают, что рассмотренные ранее механизмы аберрантности вовсе не обязательно должны учитываться у больных с заболеванием сердца. В основном здесь приемлем подход, аналогичный используемому при оценке аберраций отдельных наджелудочковых возбуждений.
Дополнительного рассмотрения требуют только два фактора (см. ниже).
Изменение зависимости длительности потенциала действия от продолжительности цикла. Одним из таких факторов является то, что в препаратах ишемического или поврежденного миокарда уменьшение длительности потенциала действия при повышении частоты может быть выражено слабее как в частично деполяризованных,
так и в нормально поляризованных волокнах (см. рис. 4.14) [21, 74, 81, 82, 87]. При прочих равных условиях это обусловит большее, чем обычно, снижение амплитуды и Vmax потенциала действия при том или ином повышении частоты, а также развитие аберрации при частоте ниже ожидаемой и ее сохранение на протяжении приступа тахикардии. Замедление реполяризации (см. рис. 4.4, 4.7 и 4.14), изменение реактивности (см. рис. 4.3, Б) и сохранение рефрактерности после завершения реполяризации (см. рис. 4.6,111), которые характерны для пораженного миокарда, еще больше усилят эту тенденцию. В связи с этим полезно сравнить потенциалы действия при сопоставимых частотах в нормальном волокне Пуркинье у собаки (см. рис. 4.10) и в нормальных и частично деполяризованных волокнах пораженного желудочка человека (см. рис. 4.13 и 4.14). Обратите внимание: при сопоставимых частотах длительность потенциала действия в волокнах желудочкового миокарда человека больше, чем в нормальных волокнах Пуркинье у собаки. Кроме того, в частично деполяризованном волокне на рис. 4.14 при уменьшении длительности цикла отмечается более сильное угнетение амплитуды и Vmax потенциала действия, чем в нормально поляризованном волокне. Однако даже в нормально поляризованном волокне при повышении частоты Vmax постепенно снижается, что предполагает существование постреполяризационной рефрактерности, которая, возможно, обусловлена задержкой восстановления вследствие инактивации Na+-каналов и (или) зависимой от частоты блокады этих каналов.
Увеличение времени достижения стабильной длительности потенциала действия после изменения частоты. Второй фактор состоит в том, что для достижения стабильного состояния потенциала действия после изменения частоты в ишемизированном и пораженном миокарде может потребоваться значительно больше времени, чем в норме [21, 36, 87]. На рис. 4.13 показано последовательное изменение длительности потенциала действия в ответ на резкое (десятикратное) увеличение (фрагмент I) и уменьшение (фрагмент II) частоты стимуляции нормально поляризованного волокна желудочкового миокарда из пограничной зоны аневризмы желудочка человека. На фрагменте I, А показана запись, полученная при стимуляции с периодом 2000 мс (30 уд/мин). Затем длительность цикла стимуляции была увеличена до 200 мс (300 уд/мин) (фрагмент 1,Б). И сразу же последовал ответ 2:1. Только через 14 с после изменения частоты длительность потенциала действия сократилась в достаточной мере для обеспечения хотя бы абортивного ответа 1:1 (фрагмент 1,Г). После установления стабильного ответа 1:1 (фрагмент 1,Д) потенциал действия продолжает изменяться на протяжении последующих 30 с вплоть до достижения его новой устойчивой длительности (фрагмент II, А). В общей сложности для установления стабильного уровня требуется 45 с (или 190 комплексов). Обратите также внимание на более выраженное, чем в нормальном волокне миокарда собаки, снижение при длительности цикла 200 мс (см. рис. 4.10).
На фрагменте II рис. 4.13 показаны эффекты следующего резкого снижения частоты стимуляции вновь до 30 уд/мин. Первые несколько комплексов после снижения частоты обнаруживают вариабельное увеличение длительности потенциала действия, в последующих комплексах отмечается сокращение длительности, а затем ее постепенное возрастание вплоть до нового стабильного значения. Время достижения равновесия вновь очень велико — 206 с (103 комплекса).
Частота и форма аберраций наджелудочковой тахикардии при заболевании сердца. На основании приведенных выше данных можно сделать вывод, что развитие стойкой аберрации при наджелудочковой тахикардии обычно маловероятно, за исключением случаев ее возникновения при высокой частоте ритма (хотя не обязательно столь уж высокой, как это показано на рис. 4.10). С другой стороны, электрофизиологические изменения в волокнах ишемизированного и пораженного миокарда, по-видимому, обеспечивают необходимую основу как для увеличения числа аберраций в целом, так и для их появления при более низких, чем обычно, частотах. Аберрации наджелудочковой тахикардии при физиологических частотах ритма связаны с изменением электрофизиологических свойств проводящей системы и (или) геометрии распространения импульсов под влиянием ишемии, повреждений, медикаментов или других факторов. Кроме того, как и в случае экстрасистолии, такие изменения способствуют искажению формы аберраций. В частности, поскольку патологический процесс, как правило, затрагивает левый желудочек в большей степени, чем правый, эти изменения способствуют увеличению числа аберраций типа блокады левой ножки и аберраций смешанного типа относительно частоты аберрации типа блокады правой ножки, обычно наблюдаемой в отсутствие заболевания сердца. Можно также ожидать, что изменения электрофизиологических свойств миокарда приведут к искажению зависимости реполяризации и рефрактерности
от длительности цикла, что обусловит возникновение менее предсказуемой, чем обычно, аберрации и, следовательно, затруднит ее дифференциацию с желудочковой эктопией.
Особенности форм аберрации при ишемии или повреждении миокарда связывают также с тем, что достижение нового стабильного значения длительности потенциала действия после резких изменений частоты может быть процессом гораздо более постепенным, чем в норме. Например, кратковременное сохранение аберрации после прекращения тахикардии может объясняться локальными различиями в скорости стабилизации длительности на новом уровне после снижения частоты ритма. Тем же можно объяснить посттахикардические изменения сегмента ST—Т. Вариабельностью длительности потенциала действия после резкого повышения частоты вплоть до достижения ее нового стабильного состояния объясняется и ряд других особенностей. Например, при изменениях частоты ритма, обусловливающих изменения длительности потенциала действия, показанные на рис. 4.13,1Б и В, будет наблюдаться чередование комплексов нормальной формы и аберрантных комплексов. Кроме того, при резком уменьшении длительности цикла ответы 1:1 появляются с некоторой задержкой, что позволяет объяснить повышение частоты первоначально медленной наджелудочковой тахикардии, а также возникновение аберрации за пределами эпизодов тахикардии.
Появлению и исчезновению аберраций короткого цикла при различных частотах (см. рис. 4.17) могут предшествовать данные о разном количестве комплексов, необходимых для достижения новой стабильной длительности потенциала действия в одном и том же волокне после повышения и снижения частоты (см. рис. 4.13). Дополнительный вклад может внести определение различий в длительности предшествующего цикла между первым аберрантным (возбуждение 3) и неаберрантным (возбуждение 10) комплексами тахикардии, которые показаны на рис. 4.17, А. На основании исследований распространения импульсов в частично деполяризованных областях с локальным блоком Hoffman [216] предложил третье возможное объяснение: 1) замедление проведения в угнетенной области связано с увеличением длительности потенциала действия на проксимальном участке; 2) нарушение проведения, с другой стороны, сопровождается значительным сокращением длительности потенциала в той же ткани [134, 158]. В таких условиях резкое повышение частоты приводит к возникновению таких потенциалов действия на проксимальном участке, длительность которых не соответствует продолжительности сердечного цикла. В результате при определенной продолжительности цикла развивается зависимый от частоты блок. С его развитием длительность потенциала действия уменьшается. При последующем снижении частоты нормальное проведение восстанавливается при более коротком цикле по сравнению с тем циклом, при котором блок возникает впервые. Таким образом, при резких изменениях длительности сердечного цикла аберрация возникает при более низких частотах ритма, чем те, при которых она исчезает.
Резкие изменения длительности цикла. Резкие изменения частоты также могут влиять на аберрантность. В целом развитие аберрации в ответ на резкое повышение частоты представляется более вероятным, чем в случае постепенного увеличения частоты ритма до того же уровня. Постепенное повышение частоты дает больше времени для уменьшения длительности потенциала действия, снижая тем самым вероятность того, что первые возбуждения при новом уровне частоты появятся раньше завершения реполяризации предшествующего возбуждения. Это позволяет объяснить более низкую вероятность возникновения аберрации при синусовой тахикардии по сравнению с пароксизмальной наджелудочковой тахикардией при сопоставимых частотах, поскольку в первом случае изменения частоты обычно происходят более постепенно. В здоровом сердце данный феномен, по-видимому, более выражен, чем в пораженном, где наблюдаемые изменения, включая ослабление зависимости длительности потенциала действия от продолжительности цикла и увеличение времени, необходимого для достижения нового стабильного состояния после изменения частоты, способствуют сглаживанию различий, обусловленных резким изменением частоты.
Электрофизиологические характеристики системы Гис—Пуркинье. Развитию аберрации при наджелудочковой тахикардии способствуют те же свойства проводящей системы, которые предрасполагают к аберрации наджелудочковых преждевременных комплексов.
При наджелудочковой тахикардии аберрации обычно наблюдаются нечасто, что связано скорее всего с тем, что при сокращении цикла происходит уменьшение длительности потенциала действия, а также неоднородности его длительности в различных об-
ластях сердца [157, 158, 170, 188], т. е. на сопоставимых уровнях правого и левого желудочковых компонентов системы Гис— Пуркинье [157, 170] и на различных участках этой системы [157, 158, 188]. Кроме того, Наn и соавт. [170, а] показали, что степень временной неоднородности восстановления возбудимости миокарда желудочков обнаруживает обратную зависимость от частоты. На рис. 4.11.IA показан пример уменьшения неоднородности длительности потенциалов действия, зарегистрированных одновременно в двух нормальных волокнах Пуркинье при сокращении длительности цикла.
Сдругой стороны, повышение аберрантности при наджелудочковой тахиаритмии
впораженном сердце отражает и ослабление обычно наблюдаемого уменьшения неоднородности длительности потенциала действия на различных участках проводящей системы при изменении частоты ритма, которое обусловлено следующими факторами: 1) ослаблением зависимости длительности потенциала действия от продолжительности цикла; 2) появлением постреполяризационной рефрактерности одновременно с изменением реактивности, как показано на рис. 4.6 и 4.3, Б. В пользу такой интерпретации говорит тот факт, что эффекты ишемии и заболевания сердца не являются одинаковыми. На рис. 4.14 показано повышение неоднородности реполяризации в препарате желудочка человека при уменьшении длительности сердечного цикла.
Антиаритмические препараты и аберрация короткого цикла
Многие медикаментозные препараты, включая стандартные антиаритмические средства и препараты наперстянки, применяемые для лечения заболеваний сердца [24, 25, 27—29, 33, 38—47, 117], влияют на процесс реполяризации и рефрактерности независимо от каких-либо изменений диастолического потенциала. Хорошо известно, что новокаинамид и хинидин [117] вызывают замедление реполяризации, особенно в конце фазы 3 потенциала действия. И уже давно было показано, что эти препараты усиливают аберрантность [217]. Напротив, такие препараты, как дифенилгидантоин [218] и пропранолол [219], которые сокращают время реполяризации, способны уменьшить и аберрации [220].
Хинидиноподобные препараты, кроме того, оказывают влияние на проведение преждевременных возбуждений, так как они блокируют быстрые Nа+-каналы [45, 46, 146, 221]. Много лет назад Hoffman [118] показал, что эти препараты изменяют реактивность миокарда таким образом, что кривая (клетка «а» на рис. 4.3, Б) смещается вниз и вправо в диапазоне средних и больших отрицательных потенциалов. Депрессивное влияние на Nа+-каналы зависит от величины потенциала, причем в деполяризованных клетках оно выражено больше, чем в нормально поляризованных [46, 116]. Кроме того, под влиянием этих препаратов происходит увеличение периода функциональной рефрактерности, которая сохраняется и по окончании реполяризации («постреполяризационная рефрактерность»), что связано с задержкой восстановления быстрых Nа+-каналов после инактивации [45]. При прочих равных условиях эти эффекты способствуют повышению вероятности аберрации при преждевременных возбуждениях, возникших как в конце фазы реполяризации, так и во время диастолы. Зависимость от потенциала медикаментозной блокады Nа+-каналов предполагает, что увеличение -аберрантности должно быть особенно выражено в ишемических и пораженных тканях сердца, причем главным образом — в частично деполяризованных клетках.
Следует ожидать, что в случае наджелудочковой тахикардии указанные выше изменения в целом будут предрасполагать к увеличению числа аберраций, а также облегчать их развитие при более низкой, чем обычно, частоте и, возможно, даже при постепенном (в противоположность резкому) повышении частоты ритма. Надо также иметь в виду недавно полученные данные о том, что хинидин и новокаинамид вызывают «использование» быстрых Nа+-каналов с зависимым от частоты блоком [45, 46, 146, 221], поскольку действие этих препаратов способствует дальнейшему усилению аберраций во время приступов тахикардии.

Рис. 4.18. Непрерывная ЭКГ (А—Г) в модифицированном отведении II, полученная у больной 78 лет во время начальной стадии острого переднесептального инфаркта миокарда.
Комплексы QRS ретушированы. Величина интервалов R—R указана в секундах. На большей части записи наблюдается предсердная бигеминия. Обратите внимание на вариабельную аберрантность по типу блокады правой ножки в конце возбуждений с длительностью цикла ^0,76 с, а также на степень аберрантности, обычно связанную здесь с увеличением длительности цикла. Отметьте также комплексы в конце двух идентичных циклов в 0,76 с (запись Г}, один из которых имеет форму, характерную для неполной блокады правой ножки, а другой является нормальным. Обсуждение в тексте.
Аберрантность длительного цикла
Искажения формы комплекса QRS, возникающие при увеличении сердечного цикла и исчезающие или уменьшающиеся при его сокращении, представляют второй основной тип аберрантности. Хотя аберрантность длительного цикла встречается не столь часто, как аберрантность короткого цикла, это достаточно хорошо изученное явление [11, 151, 179, 222—249], которое было впервые описано Kaufmann и Rothberger в 1913 г. [151] и Wilson в 1915 г. [222], а затем воспроизведено экспериментально Drury и McKenzie в 1934 г. [244], а также Elizari и соавт. [2401. Этот вариант аберрации лучше всего иллюстрируется картиной блокады ножки пучка Гиса при замедлении синусового ритма, а также изменением формы комплекса QRS при наджелудочковом ритме ускользания. Хотя аберрантные комплексы по своей форме часто соответствуют блокаде правой ножки, это, по-видимому, не столь характерно, как в случае аберрации короткого цикла [11, 179, 229, 232, 242, 243]. Кроме того, аберрация короткого цикла в нормальном сердце наблюдается так же часто, как при заболевании сердца, тогда как аберрация длительного цикла более типична для случаев с предшествующей патологией проводящей системы [6, 11, 178, 232, 235, 237, 238].
Общее прогностическое значение аберрации длительного цикла во многом аналогично рассмотренному ранее для аберрации короткого цикла. Аберрантные наджелудочковые комплексы, возникающие вскоре после длительных циклов, могут весьма напоминать одиночные наджелудочковые экстрасистолы ускользания, в том числе сливные комплексы и «пробежки» медленной желудочковой тахикардии. Их дифференциация представляет особую проблему в случае невыявления зубцов Р, в том числе при мерцании предсердий. Что еще более важно, наличие аберрации этого типа должно вызвать у клинициста подозрение на самостоятельное заболевание проводящей системы или функциональные расстройства, обусловленные такими факторами, как ишемия, токсическое действие препаратов и тяжелое нарушение баланса электролитов. Высказываемые предположения о том, что по крайней мере некоторые типы аберрации длительного
цикла могут быть обусловлены деполяризацией латентных пейсмекерных клеток в фазу 4 (см. ниже) , указывают на их возможную связь с усилением желудочковой эктопии.
На рис. 4.17, Б показана типичная аберрация длительного цикла по типу блокады левой ножки пучка Гиса в синусовом возбуждении (комплекс 7), замыкающем 1,8-се- кундную паузу после желудочковой экстрасистолы (комплекс 6). Во всех случаях, когда синусовое возбуждение возникает после паузы менее 1,4 с, аберрация не развивается, что подчеркивает ее зависимость от длительного цикла. Для сравнения на рис. 4.17, А и Б показана аберрация короткого цикла у того же больного.
На рис. 4.18 показан пример аберрации длительного цикла по типу блокады правой ножки пучка Гиса у женщины 78 лет, госпитализированной с острым переднеперегородочным инфарктом миокарда. Этот случай отличается от представленного на рис. 4.17 и является атипичным, так как аберрация возникает уже при незначительном увеличении цикла. Отмечается четкое чередование длительности цикла, обусловленное интермиттирующей предсердной бигеминией. Комплексы QRS, замыкающие циклы короче 0,76 с, имеют нормальную форму, а комплексы в конце более длительных циклов обнаруживают аберрантность типа блокады правой ножки разной степени. Степень блокады зависит от величины цикла: чем длительнее цикл, тем шире комплекс QRS. Этот феномен появился на 3-й день пребывания больной в стационаре и сохранялся в течение 4 дней, причем одновременно отмечались ранние наджелудочковые экстрасистолы с аберрацией типа блокады правой ножки пучка Гиса. Обе аномалии сменились постоянной блокадой правой ножки пучка, которая в свою очередь исчезла через 3 дня, после чего аберрация длительного цикла больше не возникала. В то же время исчезли и желудочковые экстрасистолы типа блокады левой ножки с переменным интервалом сцепления, которые наблюдались сразу после госпитализации.
В отличие от аберрации короткого цикла вариант нарушений при длительном цикле нельзя объяснить только распространением импульсов в не полностью реполяризованных волокнах, поскольку до появления аберрантного комплекса имеется более чем достаточное время для завершения восстановления возбудимости. Ввиду этого было предложено несколько альтернативных объяснений.
«Предпочтительное» проведение аберрантных возбуждений через АВ-соединение
Первоначально внимание исследователей было сосредоточено на аберрации ускользания возбуждений АВ-соединения. В первых гипотезах были сделаны попытки объяснения различий в форме нормальных синусовых и аберрантных АВ-узловых комплексов на основании наличия разных путей распространения импульсов в АВ-соединении [151, 226, 233, 245]. В соответствии с концепцией анатомической или функциональной продольной диссоциации в пределах собственно этих структур или в более обширных отделах проводящей предсердно-желудочковой системы, которая была обоснована Scherf и James [152, 245], Kaufman и Rothberger приписывали данный феномен селективной активации при синусовых и АВ-соединительных возбуждениях на различных участках пучка Гиса [151]. Wellens в своем объяснении также использовал идею функциональной диссоциации в системе ножек пучка Гиса [247]. Однако неясно, почему аберрация, обусловленная этим фактором, должна быть зависимой от брадикардии. Кроме того, учитывая степень распространения такой диссоциации, она должна бы являться довольно обычным феноменом, особенно у больных с патологией предсердно-желудочковой проводящей системы. Поскольку синусовая брадикардия и ускользающие возбуждения АВ-узла наблюдаются достаточно часто, аберрация длительного цикла также должна быть обычным явлением. Ее относительная редкость, таким образом, свидетельствует против данного объяснения.
Pick [226] и другие исследователи [230, 233] использовали для объяснения аберрации возбуждений АВ-соединения предположение об их распространении в параспецифических волокнах Махайма, отходящих от АВ-узла, пучка Гиса и его левой ножки к миокарду межжелудочковой перегородки [140, 141], количество которых с возрастом уменьшается [250]; это свидетельствует против данного объяснения, поскольку аберрация ускользающих возбуждений АВ-соединения наблюдается чаще всего у лиц пожилого возраста; кроме того, отсутствуют убедительные электрофизиологические данные о функциональной значимости этих волокон. Тем не менее нельзя исключать возможность того, что по крайней мере в некоторых случаях аберрантность длительного цикла отражает
распространение импульса по тем или иным предсердно-желудочковым путям, шунтирующим АВ-узел.
Эктопическое возникновение аберрантных комплексов
Аберрацию ускользающего возбуждения АВ-соединения можно также объяснить с точки зрения аномальности места его происхождения. Rick считает таким местом волокна Махайма [226]. Позднее Masumi и соавт. [236], а также Lie и соавт. [242] пришли к заключению, что многие из таких возбуждений возникают скорее в ветвях (передняя или задняя ветвь) левой ножки пучка Гиса, нежели в АВ-соединении. При таких возбуждениях следует ожидать появления относительно узких комплексов QRS с признаками неполной блокады правой ножки пучка Гиса, что представляет одну из возможных причин аберрации комплексов АВ-соединения с картиной блокады правой ножки. Однако таким образом нельзя объяснить аберрацию типа блокады левой ножки пучка Гиса и неспецифические типы аберрации. Более того, в этом случае остается без ответа вопрос о механизмах аберрации длительного цикла для синусовых возбуждений.
Влияние парасимпатической нервной системы
Поскольку во многих описанных ранее случаях аберрации наблюдались в сочетании с вагусноопосредованным замедлением синусового ритма, было также выдвинуто предположение, что удлинение QRS- обусловлено прямым депрессивным влиянием ацетилхолина на проведение в системе Гис—Пуркинье [222, 223, 229]. Однако данные об отсутствии угнетающего влияния ацетилхолина на нормальную систему Гис—Пуркинье [25], а также о его способности реально улучшать проведение в угнетенных тканях [251] исключают данное объяснение. Dressier предложил другое объяснение, согласно которому повышение парасимпатической активности вызывает изменение формы комплекса QRS вследствие вагусного сосудосуживающего эффекта [227]. Однако это не позволяет объяснить случаи аберрации, когда влияние парасимпатической активации несомненно отсутствует, например при аберрации наджелудочковых комплексов вскоре после постэкстрасистолических пауз.
Деполяризация в фазу 4
Латентные пейсмекерные клетки. Четвертый возможный механизм аберрации длительного цикла при замедленном синусовом ритме и при ритме ускользания в АВ-со- единении основывается на существовании в системе Гис—Пуркинье большого числа автоматических клеток (латентных водителей ритма), способных к спонтанной диастолической деполяризации [56, 238—241]; возникновение аберрации при этом обусловлено описанной ранее взаимосвязью автоматизма и проводимости (рис. 4.19) [56].
Медленное повышение диастолического потенциала, происходящее при деполяризации в фазу 4, вызывает постепенное, зависящее от потенциала и времени уменьшение Vmax и амплитуды потенциала действия, инициируемого в позднюю фазу диастолы, а также развитие нарушений, аналогичных наблюдаемым в не полностью реполяризованных волокнах (см. рис. 4.19) [56]. Поскольку латентные пейсмекерные клетки имеются практически везде в системе Гис—Пуркинье, ускорение их деполяризации в фазу 4 способно вызывать практически любой тип нарушений предсердно-желудочкового и внутрижелудочкового проведения, причем конкретная картина аберрации определяется локализацией аномальных волокон и степенью их деполяризации. Во всех случаях, когда такие волокна расположены в ножках пучка Гиса, наблюдаются изменения формы комплекса QRS, которые представляют собой аберрацию. Усиленный автоматизм в дистальных сегментах АВ-узла (зона NH) или в пучке Гиса, который обычно проявляется АВблокадой, при развитии продольной диссоциации предсердно-желудочковой проводящей системы может вызвать нарушение внутрижелудочкового проведения и аберрацию. Поскольку такая аберрация обусловлена уменьшением абсолютной величины мембранного потенциала во время фазы 4 потенциала действия, ее называют «блоком в фазу 4» или «аберрацией в фазу 4» [11, 238]. Однако эти термины недостаточно точны, так как

они используются для описания аберрации, связанной со стабильным повышением потенциала покоя без медленной диастолической деполяризации.
Massumi [234] составил перечень электрокардиографических характеристик аберрации длительного цикла. Из особенностей природы предложенного механизма следует, что постепенное увеличение длительности сердечного цикла должно сопровождаться усилением аберрантности. Это наглядно показано на рис. 4.18. И наоборот, факторы, замедляющие деполяризацию в фазу 4, предупреждают развитие аберрации длительного цикла и ослабляют или устраняют уже существующую аберрацию. Примером тому служит сокращение синусового цикла при физической активности или под влиянием таких препаратов, как атропин, а также повышение частоты основного ритма сердца вследствие имплантации пейсмекера в случаях брадиаритмии, как и фармакологическое подавление деполяризации в фазу 4. Таким образом, при выяснении причин аберрантности в неясных случаях целесообразно применение воздействий, изменяющих частоту синусового ритма.
Рис. 4.19. Схематическое изображение трансмембранных потенциалов латентного пейсмекера в системе Гис—Пуркинье и одновременно полученная поверхностная ЭКГ, которые иллюстрируют взаимосвязь автоматизма и проведения.
Фазы потенциала действия обозначены арабскими цифрами от 0 до 4, а ЭКГ-дефлексии — латинскими буквами Р, R, S и Т. А — во время первых трех возбуждений стимуляция проводилась достаточно быстро и деполяризация в фазу 4 оказалась подавленной — ситуация, аналогичная наблюдаемой при синусовом ритме. Мембранный потенциал имеет нормальную величину и остается постоянным во время диастолы (фаза 4). Потенциалы действия, развивающиеся примерно на уровне —90 мВ (а), так же нормальны, как и ЭКГ. Фаза реполяризации третьего возбуждения прерывается преждевременным ответом, который возникает приблизительно на уровне —60 мВ (б) и характеризуется существенным уменьшением амплитуды и Упшг, а также угнетенным проведением, что электрокардиографически проявляется аберрантной формой RS. Б — первые два возбуждения зарегистрированы при той же частоте стимуляции, что и на фрагменте А. Потенциалы действия и ЭКГ нормальны. Третье, четвертое и пятое возбуждения инициируются после развития деполяризации в фазу 4 вследствие сильного снижения частоты стимуляции. Третий потенциал действий, как показано, возникает в клетке при нормализации максимального диастолического потенциала (МДП, —90 мВ) и порогового потенциала (ПорП\, г, приблизительно —70 мВ). Поскольку процесс деполяризации не может уменьшить диастолический потенциал до величины ниже пороговой (ПорП), наблюдаемое в результате снижение амплитуды и Vmax является недостаточным для значительного угнетения проведения, поэтому ЭКГ остается нормальной. Четвертый потенциал действия отражает эффект смещения ПорП к менее отрицательному уровню (ПорП г). Такое смещение позволяет четвертому потенциалу действия инициироваться при значительно более низком потенциале — примерно —60 мВ (д), чем в норме. Снижение амплитуды и У max, а также замедление проведения становятся соответственно более выраженными. Комплекс RS на ЭКГ является аберрантным. Обратите внимание на сходство с преждевременным ответом на фрагменте А, который также инициируется на уровне примерно —60 мВ. Кроме того, следует отметить, что смещение ПорП сопровождается уменьшением МДП (е). Пятый потенциал действия показывает, как изменения реактивности типа представленных на фрагменте Б рис. 4.3 предрасполагают к аберрации вследствие деполяризации в фазу 4 при более отрицательных, чем обычно, потенциалах и при нормальном ПорП. Обратите внимание: хотя это возбуждение возникает на уровне около —70 мВ (ж), амплитуда и Vmax снижены достаточно для замедления проведения и появления аберрации комплекса RS. Это напоминает скорее четвертый ответ, возникающий на уровне примерно —60 мВ (д), нежели третий, хотя он также развивается на уровне —70 мВ (г). Снижение амплитуды и Vmax сверх ожидаемого, а также угнетение проведения для данного уровня потенциала отражают изменение реактивности [56}.
Кроме того, у больных с аберрацией, обусловленной деполяризацией в фазу 4, можно ожидать появления желудочковых экстрасистол, происходящих из области повышенного автоматизма: у больных с аберрацией типа блокады правой ножки пучка Гиса должны возникать экстрасистолы с признаками блокады левой ножки, и наоборот. Выявление экстрасистол соответствующего типа подтверждает обусловленность аберрации длительного цикла усиленным автоматизмом. На рис. 4.17, Б и 4.18 показано развитие аберрации типа блокады левой и правой ножек пучка Гиса в сочетании с наличием желудочковых эктопических сокращений, соответственно с формой блокады правой и левой ножек. На рис. 4.18 также наблюдается одновременное исчезновение аберрации и эктопии.
Электрофизиологические детерминанты. Аберрации, обусловленные деполяризацией в фазу 4 потенциала действия, вероятнее всего, возникнут в условиях усиления автоматизма латентных пейсмекерных клеток в системе Гис—Пуркинье, из которых наиболее очевидны следующие два обстоятельства.
1.Снижение частоты сердечного ритма в результате ослабления активности синусового узла или вследствие таких факторов, как АВ-блокада высокой степени или блокирование предсердной экстрасистолы. Продолжительная диастола дает достаточно времени для развития деполяризации в фазу 4 с последующим снижением уровня диастолического мембранного потенциала, с которым сталкивается распространяющийся импульс (см. рис. 4.19, Б). Это одно из возможных объяснений аберрации, возникающей при снижении частоты ритма до уровня, близкого К собственной частоте возбуждений латентных пейсмекеров АВ-соединения или системы Гис—Пуркинье или ниже (^40— 55 уд/мин) (см. рис. 4.17, Б).
2.Прямое усиление автоматизма латентных водителей ритма. Ряд физиологических воздействий, таких как изменения рН, рСО2 и температуры, ишемия, перерастяжение в дилатированном сердце, изменения внеклеточных концентраций ионов, а также многие медикаментозные средства, в том числе сердечные гликозиды, вызывают повышение скорости деполяризации в фазу 4 латентных пейсмекерных клеток системы Гис— Пуркинье [25, 28, 38—47]. Это позволяет объяснить явление, показанное на рис. 4.18, где аберрация возникает при небольшом увеличении длительности цикла и при такой частоте синусового ритма, которая обычно не обеспечивает значительной деполяризации латентных пейсмекерных клеток в фазу 4.
Учитывая большое количество автоматических клеток в сердце, а также существование целого ряда физиологических и фармакологических факторов, угнетающих активность синусового узла или повышающих автоматизм латентных пейсмекеров, можно сделать вывод, что данный тип аберрации должен быть достаточно обычным. Однако имеющиеся в литературе данные не подтверждают этого заключения. Это особенно касается больных с клинически здоровым сердцем, так как в большинстве случаев явление описано в органически пораженном сердце.
Анализ связи между мембранным потенциалом и скоростью проведения [56, 115] позволяет объяснить этот явный парадокс. Как отмечалось ранее, проведение возбуждения обычно поддерживается и даже несколько улучшается до тех пор, пока мембранный потенциал не становится меньше — 70 мВ, чему способствуют следующие факторы: 1) уменьшение тока, необходимого для возбуждения (т. е. повышение возбудимости), по мере приближения диастолического потенциала к пороговому уровню; 2) увеличение константы длины вследствие повышения сопротивления мембраны при деполяризации в фазу 4. Оба фактора способствуют повышению эффективности электротонического распространения тока и компенсируют снижение Удах при деполяризации [56]. Поскольку пороговый потенциал в нормальных волокнах Пуркинье близок к —70 мВ [116], деполяризация в фазу 4 не способна уменьшить диастолический мембранный потенциал до менее отрицательной величины: при потенциале выше порогового обязательно возникнет спонтанное возбуждение, а значит, и желудочковая экстрасистола. Поэтому в нормальном миокарде деполяризация в фазу 4 вряд ли вызовет медленное проведение и аберрацию (см. рис. 4.19, Б).
Однако в некоторых особых условиях деполяризация в фазу 4 способна вызывать значительное уменьшение диастолического потенциала, вполне достаточное для, развития аберрации, причем одно из таких условий может выполняться и в нормальном мио-

карде. На рис. 4.20 показана активность латентных пейсмекерных клеток, в которых скорость деполяризации в фазу 4 повышена; она лишь немного ниже скорости диастолической деполяризации клеток синусового узла. При таких близких частотах возбуждение синусового узла может достигнуть латентной пейсмекерной клетки в момент приближения ее диастолического потенциала к пороговому уровню. Так как пороговый потенциал определяет переход между диастолой (фаза 4) и быстрой деполяризацией (фаза 0) следующего потенциала действия, при его достижении происходит быстрое нарастание скорости деполяризации и резкое уменьшение мембранного потенциала за очень короткое время (10—20 мс). В таких условиях даже очень небольшие вариации во времени прихода распространяющегося импульса, которые обусловлены либо изменением синусового ритма, либо скоростью диастолической деполяризации латентных пейсмекерных клеток, приведут к значительным изменениям уровня мембранного потенциала в момент прихода импульса и, следовательно, изменяет его проведение. Соответственно этому, небольшое увеличение длительности синусового цикла обусловит значительную аберрацию проведения. И наоборот, столь же небольшое его уменьшение способно нормализовать проведение. Аналогично небольшие изменения скорости деполяризации в фазу 4 латентных пейсмекерных клеток повлияют на проведение в отсутствие каких-ли- бо изменений частоты синусового ритма. Этот механизм позволяет объяснить изменения проведения практически от комплекса к комплексу, а также развитие интермиттирующей аберрации При наджелудочковом ритме ускользания и вариабельность форм комплексов, возникающих вблизи аналогичных интервалов ускользания (см. рис. 4.18, Г).
Рис. 4.20. Аберрантность длительного цикла, связанная с медленной диастолической деполяризацией.
А — трансмембранные потенциалы латентного пейсмекера, зарегистрированные в правой ножке пучка Гиса, показывают, каким образом деполяризация в фазу 4 может привести как к аберрантности длительного цикла, так и к аберрации проведения в отсутствие заметных изменений синусового ритма даже в нормальном сердце. Скорость деполяризации в фазу 4 в клетках правой ножки предположительно повышена до уровня, несколько меньшего, чем частота синусового ритма. Такая близость частот позволяет распространяющемуся синусовому импульсу достигнуть клеток ножки пучка в тот момент, когда их диастолический потенциал приближается к уровню порогового потенциала. Этот период (переход фазы 4 в фазу нарастания следующего потенциала действия) характеризуется быстрым увеличением скорости деполяризации и существенным снижением потенциала
втечение короткого времени (20 мс). Поэтому даже небольшие изменения времени прихода распространяющегося возбуждения, обусловленные изменениями частоты синусового ритма или скорости деполяризации латентного пейсмекера клетки, будут сопровождаться выраженным различием в величине потенциала в этот момент, что приведет к вариабельности формы ответа и его дальнейшего распространения. Обратите внимание на постепенное уменьшение амплитуды и Vm,, трех ответов (I, 2 и 3), инициированных с возрастающей задержкой (шаг 20 мс), а также на усиливающееся угнетение проведения (определяется по ЭКГ-изменениям QRS). Ответ 1 возникает непосредственно перед появлением порогового потенциала и распространяется нормально. Ответы 2 и 3 характеризуются возрастающей аберрантностью типа блокады правой ножки вследствие ее активации при все более положительных потенциалах. Небольшие временные различия не обнаруживаются на стандартной ЭКГ, так что вариации формы QRS определяются как возникающие в отсутствие изменений частоты ритма. Наличие этого механизма обеспечивает также разумное объяснение типа изменений формы QRS в каждом последовательном возбуждении, который показан на рис. 4.18. Б — стандартная ЭКГ в 12 отведениях у больного 68 лет с ишемической болезнью сердца, демонстрирующая появление и исчезновение аберраций типа блокады левой ножки
вотсутствие явных изменений частоты синусового ритма (см. отведения V1—V6). Выявление такой вариабельности вместе со спонтанными желудочковыми экстрасистолами, характеристики которых указывают на их левостороннее происхождение (см. отмеченные стрелками комплексы в отведениях I—III), позволяет предположить, что аберрации могут быть обусловлены ускорением деполяризации в фазу 4 в латентном водителе ритма, расположенном в левой ножке пучка Гиса. Обсуждение в тексте.
Учитывая результаты, полученные при исследовании ишемического и патологически измененного миокарда, следует отдельно рассмотреть еще два условия возникновения нарушений проведения и аберрации, а именно: 1) смещение порогового потенциала к уровню ниже —70 мВ, что позволяет мембранному потенциалу в процессе деполяризации понизиться до уровня, при котором проведение существенно ухудшится [56]; 2) изменения соотношения реактивности, аналогичные показанным на рис. 4.3, Б и снижающие степень, при которой автоматические клетки должны деполяризоваться до замедления проведения с последующим блокированием. На рис. 4.19, Б, например, существенные нарушения проведения могли бы появиться скорее при деполяризации до —70 мВ, нежели до —60 мВ. Для возникновения аберрации также должно быть достаточно меньшего увеличения длительности цикла. Стоит отметить, что экспериментальное воспроизведение нарушений проведения, связанных с постепенной деполяризацией изолированных волокон Пуркинье в фазу 4, обычно сопровождается изменениями зависимости реполяризации от времени и потенциала, что проявляется снижением максимального диастолического потенциала и генерализованной гипополяризацией кардиомиоцитов [56], а также смещением потенциала за нулевой уровень [56J. Эти изменения иллюстрирует рис. 4.19, Б. Верхний и средний фрагменты рис. 4.21 позволяют объяснить изменения формы комплекса QRS на рис. 4.18с точки зрения зависящих от длительности цикла изменений диастолического потенциала в клетках латентных пейсмекеров правой ножки пучка Гиса. Ввиду небольших изменений длительности цикла, сопровождающихся появлением и исчезновением аберрации, здесь предполагается ускорение деполяризации
вфазу 4 вследствие ишемии, а также вызванное деполяризацией смещение порогового потенциала к менее отрицательным значениям или упомянутые ранее изменения реактивности миокарда. Дальнейшее подтверждение значимости этих факторов для развития аберрации длительного цикла было получено El-Sherif и соавт. [252] при исследовании нарушений проведения в системе Гис — Пуркинье собаки после перевязки коронарной артерии. Важная роль изменений возбудимости, зависимых от длительности цикла,
вразвитии аберрации этого типа подчеркивалась другими исследователями [150].
Осцилляторная активность. Предполагается также, что нарушения проведения могут быть связаны с осцилляторной активностью, вызванной деполяризацией, или с другими типами этой активности [30, 253]. Если циклические изменения мембранного потенциала, обусловленные осцилляторной активностью, происходят достаточно медленно, обеспечивая тем самым изменения электрофизиологических свойств мембраны, то создаются условия для возникновения нарушений проведения, аналогичных наблюдаемым при деполяризации в фазу 4 латентных пейсмекерных клеток. Так, относительно медленные колебания мембранного потенциала, связанные с действием сердечных гликозидов [253], могут сопровождаться циклическими изменениями Ушах и скорости проведения в фазу диастолы. С другой стороны, быстрые колебания должны обусловить более однородное угнетение свойств мембраны до уровня, обеспечивающего усреднение потенциала при осцилляторной активности. Это в свою очередь приведет к изменениям возбудимости и проведения, более характерным для ситуации с низким потенциалом покоя, чем для повышенного автоматизма. Данные о существовании относительно медленной Осцилляторной активности во многих препаратах ишемического и патологически измененного миокарда (см. рис. 4.4) и о наличии во многих спонтанно активных клетках изменений порогового потенциала [77] и реактивности [74, 75, 77, 87], облегчающих развитие медленного проведения, указывают на потенциальную значимость такой активности как причины нарушений проведения. Определенное значение имеют и сообщения о наличии связи между осцилляторной активностью и вариабельной местной блокадой в подобных препаратах [74, 75, 77, 87, 91—93].
Антиаритмические препараты и аберрация длительного цикла. Все антиаритмики, используемые в настоящее время, угнетают деполяризацию в фазу 4 потенциала действия латентных пейсмекерных клеток и, следовательно, должны влиять на аберрантность длительного цикла. Однако к такому выводу следует относиться с определенной осторожностью. Ярким примером служат хинидин и прокаинамид, действие которых на нарушения проведения в фазу 4 представляется весьма парадоксальным [40, 256, 257]. С одной стороны, в терапевтической концентрации они ослабляют или устраняют автоматизм латентных пейсмекеров. Это предотвращает развитие аберрации (или устраняет уже имеющуюся). С другой стороны, прямое блокирующее действие этих препаратов на Na+-кaнaлы [45, 46, 146, 221] способно облегчить развитие аберрации или усилить уже существующую аберрацию. Их суммарное влияние на проведение и аберрантность зависит от того, насколько благотворное подавление деполяризации в фазу 4

превышает прямое угнетение проведения. При низких концентрациях их прямое угнетающее влияние на проведение может быть столь небольшим, что замедление деполяризации в фазу 4 приведет к улучшению проведения и ослаблению аберрантности. С другой стороны, при высоких концентрациях этих препаратов может преобладать угнетающее влияние на проведение. Кроме того, хинидин и прокаинамид в высокой концентрации способны уменьшить диастолический потенциал, облегчив тем самым развитие автоматизма, связанного с деполяризацией [40, 254, 255].
Рис. 4.21. Альтернативный механизм возникновения аберраций при ускорении деполяризации в фазу 4 латентного клеточного пейсмекера в отсутствие значительных изменений частоты синусового ритма.
Показан также возможный механизм «сверхнормального» внутрижелудочкового проведения. Слева приведена упрощенная схема проводники системы, аналогичная представленной на рис. 4.1, А. Кривые показывают трансмембранные потенциалы, зарегистрированные в синусовом узле (СУ), пучке Гиса (Гис) и правой ножке пучка (ПНП); ниже дана ЭКГ во И отведении. Верхний фрагмент (контрольные условия): частота синусового ритма в нормальном диапазоне. Латентные пейсмекеры в пучке Гиса и его правой ножке не подвергаются деполяризации в фазу 4, ЭКГ в норме. Средний фрагмент: синусовый ритм не изменяется. Автоматизм латентного пейсмекера в правой ножке усиливается до степени, лишь немного уступающей таковой синусового узла. Одновременно отмечается смещение порогового потенциала до менее отрицательного, чем в норме, уровня, а также угнетение реактивности. В результате амплитуда и Vmах ответа, возникающего в клетках правой ножки, значительно снижаются и проведение угнетается. На ЭКГ наблюдается блокада правой ножки пучка Гиса. Нижний фрагмент: предсердная экстрасистола достигает клеток правой ножки в тот момент, когда диастолический потенциал имеет максимальную величину. Следовательно, амплитуда и Vmax превосходят таковые основного возбуждения, что соответствует улучшению проведения в правой ножке по сравнению с основным возбуждением. Форма QRS соответственно менее аберрантна, чем во время основного возбуждения («сверхнормальное» внутрижелудочковое проведение). Обсуждение в тексте.
Если аберрантность фазы 4 в ишемическом или поврежденном миокарде обусловлена изменением электрофизиологических свойств большого количества частично деполяризованных, спонтанно активных волокон, то восстановление максимального диастолического потенциала до более отрицательной величины может способствовать угнетению автоматизма и ослаблению аберрантности. Такое действие оказывают катехоламины [56, 77, 254, 255]. Однако они одновременно усиливают автоматизм нормальных латентных водителей ритма, что уменьшает целесообразность их применения.
Сверхнормальное проведение
Для объяснения по крайней мере некоторых случаев аберрантности длительного цикла была предложена концепция «сверхнормального внутрижелудочкового проведения» [235, 246—249]. Этот термин обозначает улучшение проведения импульсов, возникающих в раннюю фазу диастолы у больных с предшествующими нарушениями проведения [3—5, 19, 20, 238, 241, 248]. Было предложено несколько объяснений этого явления [3—5, 19, 20, 238, 241—248], которое фактически заключается в исчезновении аберрации. Парадоксально то, что одной из причин сверхнормального проведения является деполяризация в фазу 4 латентных пейсмекерных клеток системы Гис—Пуркинье [56, 238, 241, 248, 258].
Так как автоматические клетки начинают деполяризоваться сразу же по окончании реполяризации, мембранный потенциал максимален в начале цикла, а затем он постепенно уменьшается.
Поэтому потенциалы действия, возникающие в терминальную фазу реполяризации и сразу после ее завершения, имеют большую амплитуду и Vmax и проводятся быстрее инициируемых в более поздние фазы цикла. Таким образом, в случаях, когда ухудшение внутрижелудочкового проведения вызвано усилением деполяризации в фазу 4, форма комплексов QRS ранних преждевременных возбуждений может быть ближе к нормальной, чем форма QRS основного ритма. Такого рода изменения в пучке Гиса вызывают сверхнормальное АВ-проведение. На рис. 4.21 (нижний фрагмент) схематически показано, каким образом деполяризация в фазу 4 вызывает сверхнормальное внутрижелудочковое проведение и приводит к аберрантности длительного цикла. Примечательно, что синусовые комплексы, замыкающие длительные циклы, имеют признаки блокады правой ножки пучка Гиса, тогда как сверхнормально проведенные ранние предсердные преждевременные возбуждения, по-видимому, нормально конфигурированы.
Аберрация без существенных изменений длительности цикла
Аберрация может также возникать при минимальных или даже вовсе не заметных изменениях длительности цикла и при нормальной или сниженной частоте сердечного ритма. По-видимому, первый такой случай был описан в 1913 г. сэром Томасом Льюисом [259], определившим это явление как «нестабильный блок» ножки Пучка Гиса. В настоящее время используется множество других терминов, в том числе «интермиттирующая блокада ножки пучка», «транзиторная блокада ножки пучка», «непостоянная блокада ножки пучка», «обратимая блокада ножки пучка», «частотнозависимая блокада ножки пучка» и «частотнозависимая аберрация» {161, 172, 179, 223, 224, 260—262]. Хотя точные цифры пока не известны, аберрация этого типа, без сомнения, довольно обычна для заболеваний сердца, причем описаны аберрации типа блокады как правой, так и левой ножки [161, 172, 179, 180, 223, 224, 260— 263]. Однако в отличие от аберрантности короткого и длинного циклов здесь, безусловно, преобладает картина блокады левой ножки пучка Гиса. Клиническое значение аберрантности этого типа практически то же, что и у других типов, но по сравнению с аберрантностью длительного цикла она даже в большей степени означает наличие существенной патологии проводящей системы и служит предвестником постоянного блока ножки пучка Гиса. Практически все известные случаи описаны у больных с серьезным заболеванием сердца [161, 172, 179, 180, 223, 224, 260—263].
На рис. 4.15, Г, 4.15, Б, 4.18, В, 4.20, А и 4.22, Б представлены типичные случаи интермиттирующего блока правой и левой ножек пучка Гиса без изменений (или при минимальных изменениях) длительности основного цикла при нормальной физиологической

частоте ритма сердца. Как и при других типах аберрантности [179, 180], появление и исчезновение аберрантных комплексов этого типа наблюдается при разной длительности цикла. Кроме того, стойкие признаки блока ножки обычно появляются сразу же; степень аберрантности варьирует лишь минимально или вовсе не изменяется (см. рис. 4.15, Г, 4.20, А и 4.22, Б). Однако в некоторых случаях возможны ее существенные вариации. Например, как показано на рис. 4.18, Г, один из двух циклов в 0,76 с заканчивается желудочковым комплексом нормальной формы, а другой — обнаруживает некоторое запаздывание терминального зубца S, указывающее на неполную блокаду правой ножки. Увеличение цикла сверх 0,76 с приводит к дальнейшему усилению аберрации, что завершается картиной полной блокады правой ножки см. рис. 4.18, А, Б и В).
Рис. 4.22. Запись, Полученная при холтеровском мониторировании больного 70 лет с гипертонической болезнью, осложненной предсердной эктопией и полиморфной аберрантностью вследствие блокады правой ножки пучка Гиса.
А — брадикардия синусового узла и аритмия прерываются тремя преждевременными возбуждениями предсердий (возбуждения I, 3 и 5) по типу бигеминии. Возбуждения в конце коротких циклов (1, 3 и 5), как и возбуждения в конце длительных циклов (7, 8 и 9), обнаруживают полную блокаду правой ножки пучка. Возбуждения в конце постэктопических циклов (2, 4 и 6), промежуточных по своей длительности, показывают неполную блокаду правой ножки. Б — синусовый ритм с признаками чередования неполной и полной блокады правой ножки, которое не .связано явно с изменением длительности цикла, причем колебания длительности цикла в среднем не превышают 0,04 с. Обсуждение в тексте.
Электрофизиологические детерминанты аберрации
Аберрантность, возникающая при минимальных изменениях длительности цикла или без каких бы то ни было изменений, означает, что распространяющийся импульс встречает на своем пути ткани с вариабельной рефрактерностью на протяжении всего сердечного цикла или большей его части. Это довольно трудно объяснить только на основании зависимых от длительности цикла изменений рефрактерности или диастолического потенциала.
Выше были перечислены физиологические и фармакологические факторы, способные повлиять на мембранный потенциал и рефрактерность независимо от длительности цикла. Учитывая преимущественное возникновение аберрации этого типа у больных с , серьезным заболеванием сердца или проводящей системы, особое внимание следует уделить изменениям электрофизиологических свойств, связанным с ишемией и патологическими процессами. Изменения, наблюдаемые в ишемических и пораженных тканях сердца, в целом предрасполагают к увеличению рефрактерности на протяжении всего сердечного цикла. Это подтверждается существованием в измененном миокарде большого количества клеток с пониженным диастолическим потенциалом, усиленным автоматизмом и вариабельным увеличением реполяризации, поскольку такие изменения облегчают прохождение распространяющегося импульса на участках с низким потенциалом в течение всего сердечного цикла независимо от его длительности. Дополнительным фактором является увеличение рефрактерного периода, превышающее длительность реполяризации (см. рис. 4.6). Эти факторы вместе с ослаблением зависимости длительности потенциала действия от продолжительности цикла (см. рис. 4.13 и 4.14) и увеличением времени, необходимого для установления новой стабильной длительности
(см. рис. 4.13), усиливают и продлевают депрессивное влияние на проведение и рефрактерность, связанную с реполяризацией, даже при очень небольших изменениях частоты ритма. Еще одним фактором может быть изменение реактивности миокарда, аналогичное показанному на рис. 4.3, Б, так как оно способствует замедлению проведения даже при незначительном уменьшении мембранного потенциала в любой момент сердечного цикла.
Важную роль играет влияние лекарственных препаратов. Ряд основных кардиоактивных препаратов, особенно антиаритмики в высокой концентрации (например, амиодарон и хинидиноподобные препараты), вызывают изменения длительности потенциала действия, реактивности миокарда, проведения и диастолического потенциала, способствуя развитию аберрации как во время реполяризации, так и в фазу 4. Усиление или ослабление таких эффектов при различных концентрациях препаратов приводит к возникновению вариаций формы QRS, независимо от длительности цикла. Такие препараты применяются главным образом у больных с заболеванием сердца, что может скрывать потенциальное значение их побочного действия из-за синергизма эффектов препаратов и влияния электрофизиологических изменений, связанных с заболеванием.
На рис. 4.19, Б, 4.20, А и 4.21 схематически представлены два возможных механизма возникновения аберраций проведения из-за деполяризации в фазу 4, которые не зависят от длительности цикла. Оба механизма уже обсуждались в связи с аберрантностью длительного цикла. Первый механизм участвует в ускорении деполяризации в фазу 4 латентных пейсмекерных клеток одновременно с угнетением реактивности вовлеченных тканей (см. рис. 4.19, Б и 4.21); второй — предполагает возбуждение латентных пейсмекерных клеток в тот момент, когда они уже в значительной степени претерпели быстрые изменения потенциала перед спонтанной активацией (т. е. вблизи порогового уровня потенциала; см. рис. 4.20), и способен действовать даже в нормальном сердце. Поскольку эти механизмы обеспечивают развитие аномалий проведения в отсутствие существенных изменений основного цикла, они позволяют объяснить различия в форме комплексов QRS, замыкающих 0,76-секундные циклы на рис. 4.18, Г. Так как дальнейшее увеличение цикла (свыше 0,76 с) приводит к постепенному усилению аберрации (см. рис. 4.18, А—-В) и у больного отмечаются также преждевременные желудочковые возбуждения с признаками блока левой ножки пучка Гиса, это подтверждает заключение о том, что различия в форме двух комплексов QRS на рис. 4.18, Г отражают изменение уровня диастолического потенциала в правой ножке вследствие вариабельности деполяризации в фазу 4. На рис. 4.19, Б показана интермиттирующая блокада левой ножки пучка Гиса, которая сопровождается преждевременными желудочковыми комплексами с признаками блокады правой ножки; это предполагает, что данная картина обусловлена вариабельностью усиления автоматизма, но уже в системе левой ножки.
Записи на рис. 4.12, полученные на препарате папиллярной мышцы человека при регулярной стимуляции с периодом 1000 мс, дают несколько необычный пример возникновения аберраций вследствие изменений электрофизиологических свойств пораженных тканей сердца без изменения длительности цикла. На всех трех фрагментах видно, что реполяризация в фазу 3 потенциала действия прерывается спонтанной преждевременной деполяризацией (см. рис. 4.12, возбуждения а, б и в). Экстравозбуждение «а» приводит к развитию аберрантного распространяющегося ответа (аберрантность короткого цикла), а в момент прихода возбуждений «б» и «в» уровень потенциала оказывается столь низким, что возникают лишь локальные ответы. Постэкстрасистолические возбуждения (комплексы 1, 2 и 3) также характеризуются уменьшением амплитуды и Vmах, а их проведение, по-видимому, замедлено. Если бы подобные изменения происходили в соответствующих частях проводящей системы, они сопровождались бы аберрацией. Поскольку преждевременные ответы «б» и «в» не способны распространяться в остальных областях сердца и вызвать экстрасистолу, которая повлияла бы на основной ритм, изменения формы постэкстрасистолических комплексов 2 и 3 воспринимаются как возникающие в отсутствие изменений длительности цикла.
Описанное выше изменение формы комплекса QRS является, вероятно, вариантом аберрации короткого цикла, так как первый постэктопический цикл короче интервала между основными возбуждениями из-за преждевременного ответа. Хотя причины изменения характеристик постэктопических комплексов неясны, наилучшее объяснение, пв- -видимому, заключается в том, что рефрактерность в пораженном миокарде может значительно превышать период завершения реполяризации, а преждевременные ответы способствуют еще большему замедлению процесса восстановления возбудимости.
Аберрантность смешанного типа
Из сказанного ранее следует, что основные типы аберрантности можно объяснить в рамках какого-либо одного механизма или, во всяком случае, одного главного механизма. Такое обобщение справедливо для большинства случаев аберрантности короткого цикла, особенно в нормальном сердце. Однако это, вероятно, в целом непригодно для объяснения аберраций, наблюдаемых в отсутствие существенных изменений длительности цикла, или в случаях возникновения аберрации разных типов у одного и того же больного (см. рис. 4.17 и 4.22). В таких случаях приходится предполагать наличие одновременно двух иди нескольких механизмов.
Одновременному проявлению двух (или более) механизмов аберрации, по-видимо- му, способствует существование сложной взаимосвязи нескольких электрофизиологических переменных. Это, в частности, относится к связи между деполяризацией в фазу 4 автоматических клеток, диастолическим потенциалом, длительностью потенциала действия и проведением [56]. Деполяризация в фазу 4 вызывает снижение конечно-диасто- лического потенциала автоматических клеток с последующим уменьшением амплитуды и Vmax потенциалов действия вовлеченных волокон и угнетением проведения, что предрасполагает к аберрантности длительного цикла [56, 238—241]. Так как временные характеристики реполяризации и длительность потенциала действия зависят также от величины потенциала (см. рис. 4.3, А, 4.7 и 4.14), уменьшение диастолического потенциала при деполяризации в фазу 4 может влиять на эти переменные (см. рис. 4.19, Б) и, следовательно, на развитие аберрантности короткого цикла. Точнее говоря, поскольку ответы, инициированные в частично деполяризованных волокнах, характеризуются сокращением ранней и увеличением! терминальной стадии реполяризации, ускорение деполяризации в фазу 4 также может создать условия, благоприятные для аберрантности короткого цикла. Если деполяризация в фазу 4 протекает бесконтрольно и конечно-диастоли- ческий потенциал снижается до достаточно низкого уровня, то изменения реполяризации в отношении времени и потенциала могут развиваться таким образом, что максимальный диастолический потенциал начнет уменьшаться, за чем может последовать общая гипополяризация клетки [56]. Потенциалы действия, возникающие в таких волокнах, имеют характеристики медленных ответов со всеми вытекающими отсюда последствиями — угнетением реактивности ткани, увеличением периодов рефрактерности и уменьшением зависимости длительности потенциала действия от продолжительности цикла. Могут наблюдаться и различные типы осцилляторной активности. Такая комбинация изменений увеличит период сердечного цикла, в течении которого может возникнуть аберрация. А зона нормального проведения, наоборот, уменьшится. По мере сокращения зоны нормального проведения, появление аберрации становится все более независимым от длительности цикла и момента возбуждения в цикле. Кульминацией процесса станет возникновение аберрации без каких-либо заметных изменений (или с минимальными изменениями) длительности цикла с последующим постоянным блоком ножки пучка Гиса.
Можно привести множество других примеров того, как взаимосвязь ряда электрофизиологических параметров обусловливает изменения, предрасполагающие- к одновременному проявлению нескольких клеточных механизмов аберрантности. Дополнительные предрасполагающие факторы включают независимое возникновение изменений Двух или более электрофизиологических параметров в одной и той же области или, на разных участках АВ-проводящей системы вследствие влияния кардиоактивных препаратов, ишемии и других заболеваний, перерастяжения стенок и т. д. К этому же ряду факторов относят изменения кабельных свойств сердечных волокон. Изменения удельного сопротивления и емкости мембраны, а также внутреннего сопротивления, могут существенно повлиять на скорость проведения во всех фазах сердечного цикла. Однако пока неясно, в какой степени нарушения проведения обусловлены реальными изменениями кабельных свойств. Тем не менее по причинам, изложенным ранее, было бы неразумным предполагать, что изменения сопротивления мембраны и внутриклеточного пространства не являются важными факторами, определяющими нарушения проведения в таких ситуациях, как перерастяжение, изменения вегетативного тонуса и внеклеточной концентрации ионов (особенно калия), воздействие некоторых кардиоактивных препаратов, и (что наиболее важно) при ишемии и заболевании сердца.
