
Техпроцессы в машиностроении_лек
.pdf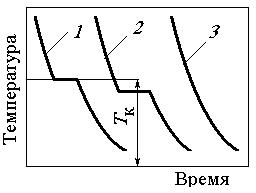
форма нарушается. В месте соприкосновения кристаллов рост отдельных граней прекращается и продолжается лишь в тех направлениях, где сопри-
косновение между кристаллами еще не достигнуто. В результате при пра-
вильном внутреннем строении растущих кристаллов после затвердевания об-
разуются кристаллы неправильной формы – кристаллиты или зерна.
Величина зерна зависит от числа центров кристаллизации и скорости роста кристаллов. Температура жидкого металла, скорость его охлаждения,
направление отвода теплоты, содержание примесей оказывают определяю-
щее влияние на форму и размер зерен, образующихся при кристаллизации.
При разливке жидкого металла в изложницы или в формы кристаллизация протекает при высоких скоростях охлаждения, что приводит к неравномер-
ному росту кристаллов, и, следовательно, к неравномерности свойств полу-
ченного слитка.
Процесс кристаллизации развивается, если созданы условия, когда воз-
никает разность свободных энергий, образующаяся вследствие меньшей сво-
бодной энергии твердого металла, чем жидкого. Процессы кристаллизации зависят от температуры и протекают во времени, поэтому кривые кристалли-
зации строятся в координатах температура – время (рис. 1.18).
Рис. 1.18. Кривые охлаждения материалов:
1 – идеальный процесс кристаллизации; 2 –
кристаллизация металла с переохлаждени-
ем; 3 – затвердевание неметаллов; Тк – тем-
пература кристаллизации.
На кривой 1 показан идеальный про-
цесс кристаллизации металла без переохлаждения. В начале процесса, когда металл находится в жидком состоянии, температура понижается равномерно
– кривая идет вниз. При достижении температуры кристаллизации падение температуры прекращается – на кривой образуется горизонтальная площад-
ка, так как отвод теплоты в окружающую среду компенсируется выделяю-
214
щейся при кристаллизации скрытой теплотой кристаллизации. После окон-
чания затвердевания кривая снова идет вниз, так как температура понижает-
ся. Практически кристаллизация протекает иначе, так как при температуре затвердевания металл какое - то время остается жидким и его кристаллизация начинается при более низкой температуре. Разница между идеальной и ис-
тинной температурами кристаллизации называется степенью переохлажде-
ния. Кривая 2 соответствует кристаллизации металла с переохлаждением.
Кривая 3 характерна для затвердевания неметаллов, у нее нет четко выра-
женной температуры кристаллизации, затвердевание происходит постепенно.
Степень переохлаждения является важнейшим фактором, определяю-
щим размеры зерна. Если степень переохлаждения невелика, охлаждение происходит медленно, число центров кристаллизации небольшое, а скорость роста зерна значительная, образуются крупные зерна. При большой скорости охлаждения скорость роста кристаллов невысокая, центров кристаллизации много и структура металла мелкозернистая. Измельчение зерна может дости-
гаться не только изменением скорости охлаждения, но и введением в рас-
плавленный металл специальных веществ, называемых модификаторами, ко-
торые играют роль добавочных центров кристаллизации.
Некоторые металлы (железо, титан, никель, кобальт и другие) в зави-
симости от температуры могут иметь различное расположение атомов в про-
странстве. Такое существование одного металла в нескольких кристалличе-
ских формах носит название полиморфизма или аллотропии. Процесс пере-
хода из одной кристаллической формы в другую называется аллотропиче-
ским превращением. Такие превращения имеют место при вторичной кри-
сталлизации, когда новые кристаллы образуются из твердой фазы.
Фазовые превращения в сплавах
По сравнению с чистыми металлами сплавы имеют более сложное строение. Процессы их кристаллизации сложнее и существенно отличаются от процессов кристаллизации чистых металлов, так как сплавы кристаллизу-
215
ются не при одной строго определенной температуре, как чистые металлы, а
имеют температуры начала и конца кристаллизации. В интервале между эти-
ми температурами имеются две фазы: жидкий сплав и образовавшиеся кри-
сталлы. Процессы кристаллизации определяют выбор сплава для метода по-
лучения заготовки: литья, ковки и других видов, а также режимы термообра-
ботки. Температуры кристаллизации чистых металлов определены и сведены в таблицы, а температур кристаллизации сплавов в зависимости от содержа-
ния компонентов можно получить много.
Для изучения состояния каждого сплава определенной серии при раз-
личных температурах используют графическое изображение, суммируя все данные на одной диаграмме, называемой диаграммой состояния системы.
Диаграмма состояния представляет собой собрание и обобщение результатов всех наблюдений для данной системы сплавов, касающихся температур плавления и кристаллизации, структуры сплавов при разных температурах и тех процессов, которые протекают в сплавах при охлаждении из области жидкого состояния вплоть до комнатных температур.
Диаграммы состояния рассматривают при условии, что все процессы,
которые могут протекать в данной системе, находятся в равновесии.
Системой называется совокупность фаз одного или нескольких компо-
нентов при различных давлениях и концентрациях. Закономерности всех из-
менений системы в зависимости от внешних условий подчиняются правилу фаз.
Фаза – однородная часть системы, ограниченная от остальных частей поверхностью раздела.
Под числом степеней свободы системы понимают возможность изме-
нения внешних и внутренних факторов (температура, давление, концентра-
ция) без изменения числа фаз в системе.
216

Правило фаз устанавливает зависимость между числом степеней сво-
боды, числом компонентов и числом фаз. Применительно к металлическим системам правило фаз выражается уравнением: С = К + 1 – Ф, где: С – сте-
пень свободы системы; К – число компонентов, образующих систему; Ф – число фаз, находящихся в равновесии; 1 – число внешних факторов (темпе-
ратура)
Понятие о диаграммах состояния.
Для построения диаграмм состояния по оси абсцисс откладывают в процентах концентрацию компонентов (от 0 до 100%), а по оси ординат -
температуру.
Для экспериментального построения диаграммы состояния сплавов не-
обходимо приготовить серию сплавов с различным содержанием компонен-
тов, входящих в состав сплава. Для каждого сплава получают кривые охлаж-
дения и по перегибам или остановкам на этих кривых, называемых критиче-
скими точками, строят диаграммы состояния.
Любому составу сплава отвечает при каждой температуре одна точка диаграммы. Процесс нагревания или охлаждения сплава графически изобра-
жается перемещением точки, соответствующей данному сплаву, вверх или вниз по вертикали (рис.
1.19).
Рис. 1.19. Схема построе-
ния диаграммы состоя-
ния:
K0, K20, K40, K60, K80, K100 –
сплавы с концентрацией соответственно 0, 20, 40 ,
60, 80, 100%; L, S – температуры ликвидус и солидус.
217
Переход сплава из одного состояния в другое при изменении температуры отмечается точкой на соответствующей вертикали. Ряд таких точек для раз-
ных сплавов дает на диаграмме состояния линию, которая отделяет область одного состояния от области другого.
Линия ликвидус – геометрическое место точек, которые определяют температуру начала кристаллизации сплавов: все сплавы, лежащие выше этой линии, находятся в жидком состоянии. Линия солидус соответствует точкам, определяющим температуру конца кристаллизации сплавов: все сплавы, лежащие ниже этой линии, находятся в твердом состоянии. В интер-
вале между линиями ликвидус и солидус сплав состоит из двух фаз – жидко-
го раствора и кристаллов одного из компонентов. Левая крайняя точка на го-
ризонтальной оси соответствует 100% - ному содержанию одного компонен-
та. Процентное содержание второго компонента откладывается по этой оси слева направо. Правая крайняя точка соответствует 100% второго компонен-
та.
Имея диаграмму состояния, можно проследить фазовые превращения любого сплава и указать состав и количественное соотношение фаз при лю-
бой температуре. Химический состав выделяющихся кристаллов по мере снижения температуры изменяется по линии солидус, а состав жидкой фазы -
по линии ликвидус. Это позволяет сформулировать правило определения со-
става фаз (правило концентраций). Для определения концентрации компо-
нентов в двух фазах через точку, характеризующую состояние сплава, прово-
дят горизонтальную линию до пересечения с линиями ликвидус и солидус.
Проекции точек пересечения на горизонтальную ось диаграммы покажут со-
ставы фаз.
Зная диаграмму состояния, можно представить полную картину фор-
мирования структуры любого сплава, определить оптимальную температуру заливки для получения литых деталей, выбрать режим термической обработ-
ки, температуру нагрева для методов горячей обработки давлением.
218

Существуют различные типы диаграмм состояния сплавов в зависимо-
сти от компонентов, входящих в сплав, и их взаимодействия друг с другом.
Диаграммы состояния сплавов, компоненты которых в жидком состоянии неограниченно растворяются друг в друге, а в твердом состоянии образуют простую механическую смесь кристаллов обоих компонентов
В этом случае после затвердевания сплав будет состоять из простой механической смеси исходных компонентов. Смесь кристаллов в структуре сплава называют эвтектической или эвтектикой, если происходила одно-
временная кристаллизация составляющих сплав компонентов при постоян-
ной и самой низкой для данной системы сплавов температуре.
На рис.1.20 приведена диаграмма состояния сплава компонентов А и В.
Рис. 1.20. Диаграмма состояния спла-
вов, образующих механическую смесь компонентов:
а – кривые охлаждения; б – изображе-
ние температур ликвидуса и солидуса в координатах «температура - концен-
трация»; в – диаграмма состояния; А,
В - компоненты сплава; эвт. – эвтек-
тика; L0, L20, L40, L60, L80, L100 - темпе-
ратура начала затвердевания раствора при концентрации компонента «В»
соответственно 0%, 20%, 40%, 60%, 80%, 100%; S0, S20, S40, S60, S80, S100 - тем-
пература конца затвердевания раствора при концентрации компонента «В»
соответственно 0%, 20%, 40%, 60%, 80%, 100%; С - Т – ордината эвтектики;
K-C-N – линия ликвидуса; D-C-E – линия солидуса; ж.с – жидкий сплав; эвт.
(А+В) – эвтектика компонентов А и В.
219
На диаграмме точки, на линии ликвидуса КСN показывают при какой температуре любой сплав данной системы начинает затвердевать, а точки на линии солидуса DCE – при какой температуре затвердевание кончается. Вы-
ше линии ликвидуса все сплавы находятся в жидком состоянии, а ниже ли-
нии солидуса – в твердом состоянии. В интервале температур между ликви-
дусом и солидусом сплавы состоят из двух фаз - жидкого раствора и кри-
сталлов одного из компонентов.
В точке С у сплава, содержащего 40% компонента В, температура на-
чала и конца затвердевания совпадают и имеют самую низкую температуру.
Такой сплав называется эвтектическим. Эвтектика – это очень мелкая и рав-
номерная механическая смесь двух видов кристаллов, образовавшихся при неизменной и самой низкой температуре. Сплавы, лежащие левее эвтектики,
называют доэвтектическими, а правее – заэвтектическими. Структура и свойства их резко отличаются. В структуре доэвтектических сплавов, кроме эвтектики, имеются кристаллы компонента В, а в заэвтектических сплавах – кристаллы компонента А. Для определения состояния сплава заданного со-
става при любой температуре и нахождения точки его кристаллизации с по-
мощью диаграммы состояния, нужно из точки, указывающей состав сплава,
восстановить перпендикуляр до пересечения с линиями ликвидуса и солиду-
са. Точки показывают начало и конец кристаллизации данного сплава.
Диаграммы состояния сплавов, компоненты которых обладают неограни-
ченной растворимостью, как в жидком, так и в твердом состояниях
Такие диаграммы состояния имеют сплавы медь – никель, молибден -
вольфрам, кобальт – хром и другие. Их строят так же, как и диаграммы пер-
вого рода по кривым охлаждения сплавов с различным содержанием компо-
нентов. Диаграмма состояния таких сплавов имеет простой вид (рис. 1.21) и
состоит из двух линий, пересекающихся между собой в точках кристаллиза-
ции чистых компонентов А и В. Линия ликвидуса – МЕN линия солидуса –
МСN. Выше линии ликвидуса все сплавы состоят из однородного жидкого
220
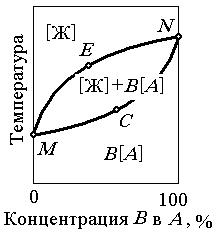
сплава, внутри МЕNС – из кристаллов твердого раствора и жидкого сплава,
ниже линии солидуса – из однородного твердого раствора.
Рис. 1.21. Диаграмма состояния сплавов, компо-
ненты которых полностью растворимы в жид-
ком и твердом состояниях:
А, В - компоненты сплава; MEN – линия ликви-
дуса; MCN – линия солидуса; [Ж] – зона жидкой фазы; [Ж]+ В[А] - зона кристаллизации сплава;
В[А] - зона твердой фазы.
Диаграмма состояния сплавов, компоненты которых ограниченно раство-
римы в твердом состоянии и образуют эвтектику
Сплавы, составы которых расположены в областях твердых растворов
и (рис. 1.22). Кристаллизуются точно так же, как и сплавы предыдущей диаграммы состояния, т.е. в этих областях образуются однородные твердые растворы: , на базе компонента «А», с атомной решеткой, характерной для этого компонента, и с атомной решеткой компонента «В».
Предельная концентрация компонента «А» в фазе определяется лини-
ей FQ и практически не изменяется. Твердый раствор компонента «В» в «А»
является ограниченным раствором с переменной растворимостью, которая меняется по линии ЕР в зависимости от температуры.
Максимальное содержание компонента «В» в - фазе определяется точкой «Е» и при охлаждении снижается до точки «Р». Рассмотрим превра-
щения сплава I состава х1. После полного затвердевания в точке 2 кристаллы имеют состав х1 и сохраняют его до точки 3. При дальнейшем охлаждении концентрация компонента «В» в твердом растворе уменьшается до состава,
соответствующего точке «Р».
221
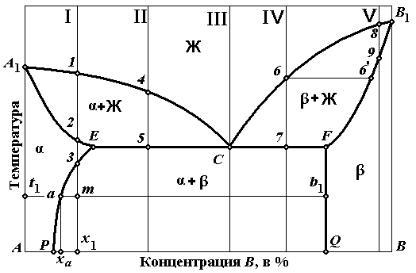
Определим фазовое состояние сплава I для какой либо температуры,
например для t1. Проведем через точку m горизонтальную линию до пересе-
чения с ближайшими линиями диаграммы состояния (EP и FQ); проекции точки пересечения (а, в) на ось концентраций укажут состав фаз, находящих-
ся в равновесии при температуре
Рис. 1.22. Диаграмма состояния сплавов,
компоненты которых ограничено растворимы в твердом состоянии и образуют эвтектику
(растворимость двусто-
ронняя, переменная,
увеличивающаяся с по-
вышением температуры):
I, II, III, IV, V – сплавы; Ж – жидкость; α, β – твердые фазы; A, B, C, E, P, Q –
точки диаграммы состояния; xa, x1 – состав сплава I.
Таким же образом можно определить состав фаз, находящихся в равно-
весии для любой температуры – правило определения состава фаз.
Количественное соотношение и - фаз при t1 определяется соответ-
ственно отрезками аm и mв1 (в масштабе всего отрезка ав1) – правило отрез-
ков.
По мере уменьшения концентрации в твердом растворе компонент «Б» выпадает в виде твердого раствора состава, соответствующего точке Q.
Выпадающие кристаллы твердого раствора называются вторичными (т.к.
они выпали из твердого раствора, а не из жидкого) и обозначаются II. Ко-
нечная структура сплава 1 будет состоять из двух фаз + II. Сплавы III назы-
222
ваются эвтектическими (наиболее легкоплавкими). Он кристаллизуется с од-
новременным выделением двух твердых фаз определенной концентрации:
твердого раствора состава точки «Е» и твердого раствора состава точки
«F». Эвтектическая реакция протекает по схеме: [ж]с →← [αЕ + βF].
При эвтектической реакции одновременно существуют три фазы – жидкая и два твердых раствора, поэтому степень свободы равна нулю и ре-
акция протекает изотермически и при постоянном составе реагирующих фаз.
Эвтектические кристаллы и имеют форму пластин и равномерно череду-
ются между собой, образуя колонии.
В доэвтектическом сплаве II эвтектическому превращению предшест-
вует выделение кристаллов из жидкого раствора в интервале температур точек 4-5. В результате жидкая фаза обогащается компонентом «В» и охлаж-
дение до температур точки 5 приводит к образованию в сплаве двух фаз оп-
ределенного состава Е + Жс. Количество жидкой фазы выражается отрезком
5-Е, а количество твердой фазы – отрезком 5-С.
При эвтектической температуре (точка 5) жидкий раствор превращает-
ся в эвтектику состава ( Е + F). По мере охлаждения из твердого раствора выделяются кристаллы и при комнатной температуре структура сплава за-
пишется в виде: р + эвт.( P+ Q).
Для заэвтектического сплава IV кристаллизация в интервале темпера-
тур точек 6-7 сопровождается выделением - фазы, богатой компонентом
«В», что приводит к обеднению жидкого раствора этим элементом. Состав выделяющихся кристаллов изменяется от точки 6' до точки «F», а состав жидкой фазы – от точки 6 до точки «С». При охлаждении до температур точ-
ки 7 произойдет эвтектическое превращение: [ж]с ↔ эвт.(αЕ+βF). При ком-
натной температуре структура сплава будет иметь вид: βQ + эвт.(αР+ βQ).
223
