
Техпроцессы в машиностроении_лек
.pdf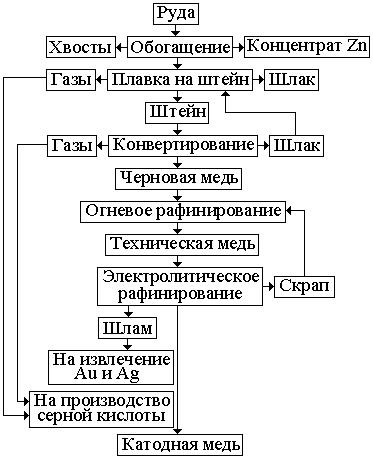
Обогащение медных руд осуществляют флотацией, которая основана на различной смачиваемости частиц ценного компонента и пустой породы.
Получаемый концентрат, содержащий до 35 % меди, подвергают окисли-
тельному обжигу при температуре 750 … 800 оС для уменьшения содержания серы.
Рис. 1.12. Схема получения меди.
Продукт обжига - ога-
рок является смесью сульфи-
дов и оксидов. Огарок плавят в отражательных или элек-
трических печах для полу-
чения медного штейна – сплава Си2S*FeS, который содержит примерно 20 … 60 % Сu и около 20 % S. Рас-
плавленный штейн заливают в конвертеры с горизонтальной осью вращения и продувают воздухом для получения черновой меди, которая содержит до 2 % примесей.
Полученная черновая медь непригодна для технических целей, так как наличие различных примесей заметно снижает электропроводность меди и другие свойства. Для получения чистого металла черновую медь рафинируют огневым или электролитическим способом. Огневое рафинирование основа-
но на окислении примесей черновой меди, которые обладают большим срод-
ством к кислороду, чем сама медь. Рафинирование производится в отража-
204
тельных печах, в которые заливают расплавленную черновую медь. Полу-
ченная техническая (красная) медь М2, М3 содержит 99,5 … 99,7 % меди.
Для получения особо чистой меди производят электролитическое ра-
финирование меди. Электролитом служит раствор серной кислоты медного купороса в воде. Пластины черновой меди служат анодом, а тонкие листы из электролитической меди – катодом. При пропускании через электролит по-
стоянного тока аноды из технической меди растворяются и положительно за-
ряженные ионы меди осаждаются на катоде из чистой меди. Катодная медь содержит до 99,9 … 99,99 % меди.
Производство алюминия
По содержанию в земной коре алюминий занимает среди металлов первое место около 8 %). Алюминийметалл серебристо-белого цвета с удельным весом 2,7т/м3 и температурой плавления 660 °С. На воздухе он бы-
стро покрывается тонкой пленкой окисла АL2О3. Алюминий и его сплавы нашли широкое применение благодаря достаточно высокой пластичности,
тепло- и электропроводности.
Алюминий очень активный металл, поэтому встречается в природе только в связанном виде - в виде оксидов и гидроокисей. Добывают алюми-
ний из горных пород с высоким содержанием глинозема – боксита, каолина,
нефелина, алунита.
Бокситы являются основным сырьем для получения алюминия. Они представляют собой сложный минерал, содержащий 40 … 60% свободного гидрата окиси алюминия AI(ОН)з и ряд таких примесей как SiO2, AI2O3, TiO2
и CaO. Внешний вид и химический состав бокситов очень непостоянен.
Качество бокситов определяется количеством окиси алюминия и со-
держанием кремнезема – вредной примеси, затрудняющей получение алю-
миния.
205
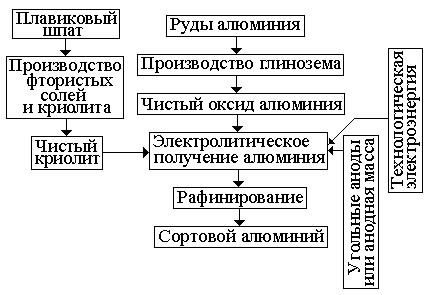
Получение алюминия складывается из двух самостоятельных этапов:
извлечение из руды окиси алюминия (глинозема) и получение алюминия электролизом глинозема. Упрощенная схема технологического процесса производства алюминия приведена на рис. 1.13.
Рис. 1.13. Схема полу-
чения алюминия.
В зависимости от состава руды при-
меняются различные способы получения глинозема: щелочной,
кислотный, спекания или комбинированный, которые предусматривают одну цельотделение от руды посторонних примесей и получение растворимого в воде соединения алюминия - алюмината натрия.
Наибольшее распространение получили щелочные способы извлечения глинозема. Одним из лучших щелочных методов является способ, разрабо-
танный в 1882 - 1892 г.г. в России К.И Байером, который применяется для переработки руд, содержащих небольшое количество кремнезема. Этот спо-
соб усовершенствован на отечественных заводах и широко применяется как в России, так и за рубежом.
Измельченный боксит обрабатывают концентрированной щелочью в автоклавах при температуре 150 оС и избыточном давлении, в результате че-
го образуется алюминат натрия Аl2О3 Na2О. Алюминат натрия переходит в водный раствор, а окись железа, двуокись титана и другие примеси, нерас-
творимые в щелочах, выпадают в осадок (красный шлам). Раствор алюмината
206
натрия, отделенный от красного шлама, подвергают декомпозиции (выкру-
чиванию) для получения гидроокиси.
При выщелачивании кремнезем удается перевести в хвосты, так как он образует со щелочью силикат натрия, который взаимодействует с алюмина-
том натрия и выпадает в осадок
Отделение алюминатного раствора от красного шлама осуществляют обычно в специальных устройствах – сгустителях.
Очищенный и профильтрованный раствор алюмината натрия подвер-
гают декомпозиции (выкручиванию), сущность которого сводится к само-
произвольному разложению алюминатного раствора с выделением гидрооки-
си алюминия:
Na2O*Al2O3+ 4 Н2О = AI(ОН)з + 2 NaOH
Процесс ускоряют добавлением (для создания центров кристаллиза-
ции) кристаллической гидроокиси алюминия.
Гидрат окиси алюминия выпадает в осадок, который фильтруется, про-
мывается и прокаливается. При прокаливании образуется чистый глинозем:
Al(OH)3 → Al2O3 + H2O
Для получения тонны глинозема по этому способу расходуется 3 тонны боксита и 0,25т 42 % раствора NaOH.
Алюминий получают электролизом расплавленных солей - смеси гли-
нозема и криолита. Чистый глинозем имеет высокую температуру плавления
–2030 °С, поэтому его растворяют в расплавленном криолите – фториде алю-
миния и натрия Na3AlF6, что позволяет снизить температуру электролиза до
950 … 1000 °С.
Электролиз проводят в электролизных ваннах-электролизерах, которые состоят из стального корпуса (рис. 1.14), футерованного внутри угольными блоками. В подовую часть электролизера с помощью шин подведен отрица-
207

тельный полюс источника тока. Положительный полюс подведен к угольным электродам, которые опускают в электролит.
Рис. 1.14. Схема электролизера.
При прохождении через расплав-
ленный электролит постоянного элек-
трического тока большой силы (до
120кА) происходит диссоциация глино-
зема: на катоде разряжается положи-
тельный ион ионов Al 3+ и образуется алюминий, а на аноде – ион О2-, в ре-
зультате чего электроды постепенно сгорают и заменяются новыми. Алюми-
ний собирается на дне ванны под слоем электролита, откуда его периодиче-
ски извлекают.
Полученный в электролизере алюминий содержит металлические и не-
металлические примеси и газы, для очистки от которых производят рафини-
рование алюминия продувкой хлором. Пары хлористого алюминия увлекают неметаллические примеси и газы и всплывают на поверхность металла, обра-
зуя рыхлый шлак, который удаляют. Для получения более чистого алюминия
(до 99,99 %) прибегают к электролитическому рафинированию, в процессе которого удаляются также и металлические примеси.
Производство магния
Магний – серебристобелый металл, плотность которого 1,74 т/м3,
температура плавления 651 °С. Это очень активный металл, в свободном виде не встречается, является составляющей многих пород, в которых содержится в виде хлоридов или карбонатов, образуя магниевые руды: карналлит, магне-
зит, доломит, бишофит.
208

Основным методом получения магния является электролитический способ переработки карналлита (MgCl2 * KCl * 6H2O), однако выделить маг-
ний этим способом из водных растворов его солей невозможно, так как элек-
трохимический отрицательный потенциал магния по абсолютной величине значительно больше отрицательного потенциала разряда ионов водорода на катоде. Исходя из этого, проводят электролиз не водных растворов, а рас-
плавленных солей магния.
Электролитом является безводный хлористый магний, для снижения температуры плавления которого и повышения электропроводности в элек-
тролит добавляют NaCl, CaCl2 и KCl. Хлористый магний получают хлориро-
ванием окиси магния или обезвоживанием карналлита. Упрощенная схема технологического процесса получения магния приведена на рис. 1.15.
Рис. 1.15. Схема получения магния.
Электролитическое получение магния осуществляют в электролизере, в котором анодами служат графитовые
пластины, а катодами - стальные пластины. Электролизер заполняют рас-
плавленным электролитом и пропускают электрический ток. Удельная плот-
ность магния меньше удельной плотности электролита, поэтому выделяю-
щийся на катоде жидкий магний, не растворяясь в электролите, в виде капель всплывает на его поверхность, откуда его периодически сливают. Получае-
мый магний содержит значительное количество примесей (до 5 %), поэтому его рафинируют переплавкой с флюсами или возгонкой.
Производство титана
Титан – металл серебристого цвета с голубоватым отливом, плотно-
стью 4,5 т/м3, температурой плавления около 1660 оС, довольно широко рас-
пространен в земной коре. Механические свойства титана зависят от содер-
209
жания в нем примесей. Чистый титан обладает достаточно высокой пластич-
ностью и невысокой твердостью, технический титан хрупок и тверд. На по-
верхности титана образуется стойкая оксидная пленка, вследствие чего титан обладает высокой сопротивляемостью коррозии в некоторых кислотах, мор-
ской и пресной воде. На воздухе титан устойчив и мало изменяет свойства при нагреве до 400 °С. Вредные примеси титана – азот и кислород резко сни-
жают его пластичность, а углерод при содержании более 0,15 % снижает ков-
кость титана, затрудняет обработку резанием и резко ухудшает сваривае-
мость.
В природе титан встречается в составе более семидесяти минералов, из которых наибольшее промышленное значение получили ильменит - FeO* TiO2 и рутил - TiO2.
Известно несколько способов получения титана из его руд, но во всех случаях, как и для большинства металлов, металлургической обработке все-
гда предшествует обогащение руды и получение концентрата.
Основным методом переработки титановых руд является магнийтерми-
ческий способ, сущность которого заключается в получении четыреххлори-
стого титана и восстановлении из него металлического титана с помощью жидкого магния. Упрощенная схема получения титана из ильменита приве-
дена на рис. 1.16.
Ильменитовый концентрат плавят в смеси с древесным углем, антраци-
том в рудно-термических печах, где оксиды железа и титана восстанавлива-
ются. Образующееся железо науглероживается, и получается чугун, а низшие оксиды титана переходят в шлак. Чугун и шлак разливают отдельно в излож-
ницы. Титановый шлак содержит 80 … 90 % TiO2, 2 .. 5 % FeO и примеси
SiO2, Al2O3, CaO и др. Чугун используют в металлургическом производстве.
Для получения четыреххлористого титана пористые брикеты подвер-
гают хлорированию в специальных печах при температуре 800 … 950 °С.
210
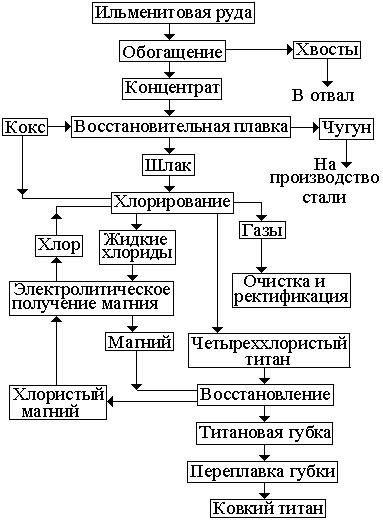
Титановый шлак подвергают хлорированию в специальных печах при температуре 800 … 950 °С и получают четыреххлористый титан:
TiO2 + 2C + 2Cl2 = TiCl4 + 2CO.
Рис. 1.16. Схема по-
лучения титана.
Образующийся четы-
реххлористый титан нахо-
дится в парообразном со-
стоянии в смеси с хлорида-
ми других элементов, по-
этому производят отделение и очистку TiCl4 от осталь-
ных хлоридов. Очищенный четыреххлористый титан в специальных печах - реак-
торах восстанавливают ме-
таллическим магнием высо-
кой чистоты при темпера-
туре 850 … 1000 ºС в атмо-
сфере аргона.
Между жидким магнием и четыреххлористым титаном происходит ре-
акция
2Mg + TiCl4 = Ti + 2MgCl2 + Q
Образующийся металлический титан спекают в пористую губчатую массу. Титановая губка содержит 35 … 40% магния и хлористого магния.
Для удаления из титановой губки этих примесей производят ее рафинирова-
ние методом вакуумной дистилляции.
211

Титановые губки для получения слитков плавят в вакуумных дуговых печах. Полученные слитки могут иметь дефекты (раковины, поры). Поэтому их переплавляют, используя как расходуемые электроды. Чистота титана, по-
сле вторичного переплава, составляет 99,6 … 99,7 %.
1.9.Основные сведения из теории сплавов
Ксовременным конструкционным материалам предъявляют обширные
иразнообразные требования по свойствам, которые зависят от их состава и внутреннего строения.
Чистые металлы встречаются в природе редко и в большинстве случаев не обеспечивают требуемого комплекса механических и технологических свойств, поэтому обычно применяют сплавы металлов, которые можно полу-
чить с заданными свойствами.
Металлический сплав представляет собой кристаллическое вещество,
состоящее из двух или более элементов, полученное сплавлением элементов в жидком состоянии (рис. 1.17). Элементы или их химические соединения,
образующие сплав,
принято называть ком-
понентами сплава.
Рис. 1.17. Виды спла-
вов:
а – схема микрострук-
туры механической смеси; б – кристалличе-
ская решетка твердого раствора замещения; в - кристаллическая решетка твердого раствора внедре-
ния; г - кристаллическая решетка химического соединения; 1 – атомы раство-
рителя; 2, 3 – атомы растворенного элемента; A, B - компоненты.
212
Структура сплавов более сложная по сравнению с чистыми металлами.
В зависимости от природы компонентов атомы последних могут взаимодей-
ствовать между собой и образовывать твердые растворы, химические соеди-
нения и механические смеси.
Твердые растворы, как и металл, имеют одну кристаллическую решет-
ку – компонента – растворителя. Различие состоит в том, что в кристалличе-
ской решетке металла размещаются атомы одного элемента, а в твердом рас-
творе - атомы различных элементов, образующих этот твердый раствор.
Атомы растворенных элементов или замещают атомы растворителя
(твердые растворы замещения), или внедряются в решетку между атомами растворителя (твердые растворы внедрения). Твердые растворы образуются при любом соотношении компонентов.
Характерной особенностью кристаллического строения химического соединения является его кристаллическая решетка, не похожая на решетки сплавляемых элементов. Эти сплавы имеют новые физико – химические и механические свойства. Соотношение компонентов в них строго определено.
В сплаве, образующем механическую смесь, находятся кристаллы всех компонентов, имеющих различный объем атомов и различные по типу кри-
сталлические решетки.
Переход металлов из жидкого состояния в твердое называется кри-
сталлизацией. Превращения, связанные с кристаллизацией, в значительной степени определяют свойства металлов. Процесс кристаллизации состоит из двух одновременно идущих процессов зарождения и роста кристаллов. В
жидком металле атомы непрерывно движутся, по мере понижения темпера-
туры движение замедляется, атомы сближаются, образуются центры кри-
сталлизации, к которым присоединяются вновь появляющиеся кристаллы.
Сначала кристаллы растут свободно, форма их геометрически правильная и друг от друга они отличаются лишь размерами и ориентировкой. Как только
растущие кристаллы придут в соприкосновение друг с другом, их правильная
213
