
- •Міністерство освіти та науки україни
- •Одеської національної академії харчових технологій
- •Розроблено:
- •2. Виконавець:
- •Рецензент:
- •Правила виконання лабораторних робіт
- •Інструкція 1.1.
- •Инструкція 1.2.
- •Лабораторна робота № 1 Тема: “Характерні реакції катіонів s-елементів”
- •Пам’ятайте!
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
- •Хід роботи
- •Правила зважування
- •Контрольні питання
- •Лабораторна робота № 5 Тема: «Визначення кристалізаційної води у кристалогідраті мідного купоросу.»
- •Хід роботи
- •Контрольні питання
- •Лабораторна робота № 6 Тема: «Визначення відсотку барію у кристалогідраті хлориду барію.»
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота № 7 Тема: «Вивчення будови мірного посуду. Засвоєння техніки титрування.»
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота № 9 Тема: «Визначення еквівалентності молярної концентрації розчину сильної кислоти з використанням стандартизованого розчину гідрооксиду калію.»
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
Хід роботи
Сутністю комплексонометричного методу аналізу є взаємодія робочого розчину комплексну, з визначаємими іонами. Ця реакція аналогічна реакції осадження. У ролі комплексну дуже часто використовують кислу двухнатрієву сіль етилендіамінтетраоцтової кислоти. Цей комплекс має назву трилон Б.
Реакція комплексоноутворення зворотна. Внаслідок утворення комплексона утворюється іони водню. Щоб змістити рівновагу комплексоноутворення, треба вивести іони водню з сфери реакції.
Виводяться вони додаванням аміачної буферної сміши, рН якої 9.
Індикатор – це органічний барвник, який утворює забарвлений комплекс з визначеними іонами винно-червоного кольору.
Хімізм реакції комплексоноутворення йде за рівнянням:
N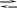 a2H2T4
+ Mg2+
Na2(MgT4)
+ 2H+
a2H2T4
+ Mg2+
Na2(MgT4)
+ 2H+
Приготування стандартного розчину сульфату магнію.
Сульфат магнію використовується як стандартний розчин, так як ця речовина відповідає всім вимогам, яким потрібні відповідати вихідні речовини.
Це біла кристалічна речовина, гарно розчинна у воді. Формула сульфату магнію: MgSO4 · 7H2O.
Розрахунок еквівалентної маси сульфату магнію: ___________________
________________________________________________________
Розрахунок наважки сульфату магнію робимо за формулою:
q = , г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,05);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
По величині наважки розраховуємо еквівалентну молярну концентрацію сульфату магнію:
![]()
де q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
Визначення еквівалентної молярної концентрації розчину трилону Б.
Бюретка заповнюємо розчином трилону Б, точку еквівалентної молярної концентрації якого необхідно визначити. В реакційну колбу піпеткою відміряємо точний об’єм розчину сульфату магнію і додаємо 5 см3 аміачної буферної суміші і 10-15 краплин еріохрому чорного Т, розчин сульфату магнію забарвлюється у винно-червоний колір. Цей розчин титрується розчином трилону Б і по краплям, при енергійному струшуванні до того, доки від однієї краплини розчину трилону Б розчин не стане такого ж кольору, як і індикатор – блакитного. Титрування проводимо 3-4 правильних рази.
Результати титрування заносять у таблицю:
MgSO4 |
Трилон Б |
Ceкв = 0,05 моль·екв/дм3
V1 = V2 = V3 = Vср = =
|
V = об’єм піпетки, см3
|
Контрольні питання:
Сутність комплексонометричного методу.
Для чого використовується буферна суміш?
Особливості дії еріохрому чорного Т?
Показати механізм комплексоноутворення з іонами кальцію, використовуючи структурну формулу трилону Б.
Захист
________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 20
Тема: «Визначення загальної твердості води.»
Мета: навчитися контролювати якість води – загальної сировини харчової промисловості.
Прилади та реактиви: титрувальні установки, мірні колби на 100 см3, розчин трилону Б, аміачна буферна суміш, еріохром чорний Т.
