
- •Міністерство освіти та науки україни
- •Одеської національної академії харчових технологій
- •Розроблено:
- •2. Виконавець:
- •Рецензент:
- •Правила виконання лабораторних робіт
- •Інструкція 1.1.
- •Инструкція 1.2.
- •Лабораторна робота № 1 Тема: “Характерні реакції катіонів s-елементів”
- •Пам’ятайте!
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
- •Хід роботи
- •Правила зважування
- •Контрольні питання
- •Лабораторна робота № 5 Тема: «Визначення кристалізаційної води у кристалогідраті мідного купоросу.»
- •Хід роботи
- •Контрольні питання
- •Лабораторна робота № 6 Тема: «Визначення відсотку барію у кристалогідраті хлориду барію.»
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота № 7 Тема: «Вивчення будови мірного посуду. Засвоєння техніки титрування.»
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота № 9 Тема: «Визначення еквівалентності молярної концентрації розчину сильної кислоти з використанням стандартизованого розчину гідрооксиду калію.»
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
Хід роботи
Розчин солі Мора – це розчин солі (NH4)2 · Fe(SO4)2 · 6H2O.
Відновники у методі пермаганатометрії визначаються методом прямого титрування. Це означає, що до точного об’єму невідомого відновника додають еквівалентний об’єм відомого окислювача.
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
2Fe2+ - 2e = 2Fe3+ │5
MnO4- + 8H+ + 5e = Mn2+ │2
Отриманий розчин, який досліджуємо розчиняємо дистильованою водою до мітки і вирівнюємо концентрацію.
У колбу для титрування піпеткою відміряємо точний об’єм досліджуємого розчину і додаємо циліндром такий же об’єм розчину сірчаної або соляної кислоти. Відновник титрують розчином перманганату калію при нормальних умовах до з’явлення блідо-рожевого забарвлення. Титрування проводять 3 правильних рази. Результати титрування заносять у таблицю.
KMnO4 |
FeSO4 |
Ceкв = з роботи № 13
V1 = V2 = V3 = =
|
Vзаг. = 100 см3 V = об’єм піпетки, см3
Е
Е заліза =
q
=
|
Контрольні питання:
В чому сутність титрометричного аналізу?
Визначення відновників методом перманганатометрії.
Подвійні солі, їх характеристика.
Розрахункові формули.
Захист
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 15
Тема: «Визначення еквівалентної молярної концентрації розчину дихромату калію з використанням стандартного розчину перманганату калію.»
Мета: засвоїти визначення відновників у методі перманганатометрії методом зворотного титрування та розрахунки пов’язані з ним.
Прилади та реактиви: титрувальні установки, мірні колби на 100 см3, циліндри, розчин перманганату калію з визначеною еквівалентною молярною концентрацією, розчин сірчаної кислоти, дистильована вода.
Хід роботи
В основі даної лабораторної роботи лежать окисно-відновні реакції:
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Fe2 (SO4)3 + Cr2 (SO4)3 + 7H2O
Cr2O72- + 14H+ + 6e = 2Cr3+ +7H2O │1
2Fe2+ - 2e = 2Fe3+ │3
Розрахунок еквівалентної маси дихромату калію: ___________________
________________________________________________________
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe (SO4)3 + K2SO4 + 2MnSO4 + 8H2O
2Fe2+ - 2e = 2Fe3+ │5
MnO4- + 8H+ + 5e = Mn2+ + 4H2O │2
Бюретку заповнюємо розчином перманганату калію, у колбу для титрування піпеткою відмірюється точний об’єм розчину дихромату калію, додаємо до нього подвійний об’єм розчину солі Мора (2 піпетки) з відомою еквівалентною молярною концентрацією та розчин сірчаної або соляної кислоти такий же об’єм відмірений циліндром. Реакційна суміш змінює своє забарвлення внаслідок того, що в розчині замість іонів Cr2O72- з’являються іони Cr3+, цю суміш титрують розчином перманганату калію до появлення рожево-сірого забарвлення (комір каменя олександріт). Титрування проводять 3-4 рази:
K2Cr2O7 |
FeSO4 |
KMnO4 |
V = об’єм піпетки, см3 |
Vзаг. = об’єм піпетки, см3
Секв = 0,025 моль·екв/дм3
|
Секв = з роботи № 13
V1 = V2 = V3 = =
|
Розрахунок об’єму солі Мора, який взаємодіє з перманганатом калію за рівнянням:
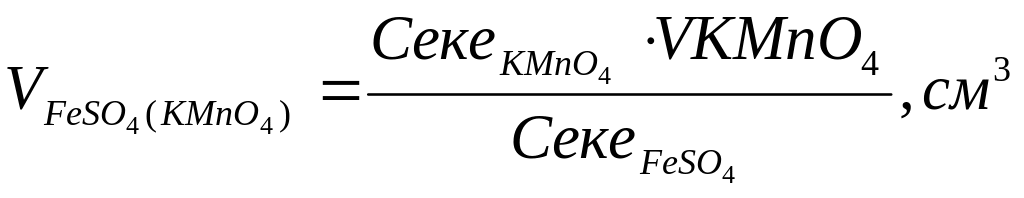
________________________________________________________________________________________________________________________________________________________________________
2. Знаючи загальний об’єм солі Мора і об’єм солі Мора по перманганату калію, по різниці визначаємо об’єм сульфату заліза по дихромату калію.
V![]() /(
/(![]() )
= VFeSO4(заг)
– VFeSO4
/(KMnO4),
см3
)
= VFeSO4(заг)
– VFeSO4
/(KMnO4),
см3
________________________________________________________________________________________________________________
3. Розрахунок еквівалентної молярної концентрації розчину дихромату калію за рівнянням:
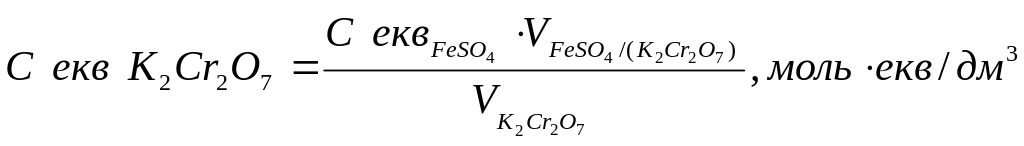
________________________________________________________________________________________________________________________________________________________________________
Контрольні питання:
Сутність титрометричного аналізу.
Які речовини титрують прямим, а які зворотнім титрування.
Галузі використання перманганатометрії.
Які речовини утворюються при доданні розчину солі Мора до розчину дихромату калію.
Захист
________________________________________________________________________________________________________________
Оцінка викладача: ________________________________________________________
Лабораторна робота № 16
Тема: «Приготування стандартизованого розчину тіосульфату натрію. Приготування стандартного розчину дихромату кальцію. Визначення еквівалентної молярної концентрації розчину тіосульфату натрію з використанням стандартного розчин.»
Мета: закріпити навики, пов’язані з приготуванням титрантів. Засвоїти методику йодометричного титрування.
Прилади та реактиви: терези та різноваги до них (т/х та аналітичні), мірні колбі, воронки, чашки фарфорові, дихромат калію, дистильована вода, розчини сірчаної кислоти, йодид калію, скла, розчин крохмалю (свіже приготовлений).
