
- •Міністерство освіти та науки україни
- •Одеської національної академії харчових технологій
- •Розроблено:
- •2. Виконавець:
- •Рецензент:
- •Правила виконання лабораторних робіт
- •Інструкція 1.1.
- •Инструкція 1.2.
- •Лабораторна робота № 1 Тема: “Характерні реакції катіонів s-елементів”
- •Пам’ятайте!
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
- •Хід роботи
- •Правила зважування
- •Контрольні питання
- •Лабораторна робота № 5 Тема: «Визначення кристалізаційної води у кристалогідраті мідного купоросу.»
- •Хід роботи
- •Контрольні питання
- •Лабораторна робота № 6 Тема: «Визначення відсотку барію у кристалогідраті хлориду барію.»
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота № 7 Тема: «Вивчення будови мірного посуду. Засвоєння техніки титрування.»
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
- •Лабораторна робота № 9 Тема: «Визначення еквівалентності молярної концентрації розчину сильної кислоти з використанням стандартизованого розчину гідрооксиду калію.»
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Хід роботи
- •Контрольні питання:
Хід роботи
Приготування стандартизованого розчину гідроксиду калію або натрію.
Гідрооксид калію або натрію – речовина гігроскопічна вбирає з повітря діоксиду вуглецю, отже, не відповідний вимогам, пред’явленим до речовини. Готовиться методом приблизної наважки.
Розрахунок еквівалентної маси КОН (NaOH): ______________________
________________________________________________________
Розрахунок наважки гідроксиду калію (натрію) робимо за формулою:
q
=
![]() ,
г
,
г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,1);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 500).
________________________________________________________________________________________________________________
На т/х терезах зважуємо суха чиста фарфорова чашка, масу уточнюємо на аналітичних терезах. До зваженої фарфорової чашки додаємо розраховану наважку лугу та зважуємо на т/х терезах, уточнюємо масу на аналітичних терезах. Результати заносять у таблицю.
№ |
Зважуємий предмет |
Маса на т/х терезах, гр |
Маса на аналітичних терезах, гр |
1 |
Порожня фарфорова чашка |
|
|
2 |
Наважка лугу |
|
|
3 |
Чашка з наважкою |
|
|
При роботі з лугом потрібно дотримуватися правил безпеки. Луги потрібно брати сухими шпателями, обережно, не розсипаючи на стіл, терези та чашка повинні бути сухими. Зважену кількість речовини обережно через воронку переносимо в ємкість на 500 см3 розчиняючи у дистильованій воді, розчин перемішати, обережно закрити кришкою, оформити етикеткою, покласти в відведене місце.
2. Приготування стандартного розчину щавлевої кислоти.
Для приготування стандартного розчину щавлевої кислоти користуємося сухою щавлевою кислотою.
Складаємо рівняння реакції
Н2С2О4 + КОН = К2С2О4 + 2Н2О
Розрахунок еквівалентної маси щавлевої кислоти: ___________________
________________________________________________________
Розрахунок наважки щавлевої кислоти робимо за формулою:
q = , г
де Секв – еквівалентна молярна концентрація, моль·екв/дм3 (дорівнює 0,1);
q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
На т/х терезах зважуємо суха чиста фарфорова чашка, масу уточнюємо на аналітичних терезах. До зваженої фарфорової чашки додаємо розраховану наважку щавлевої кислоти та зважуємо на т/х терезах, уточнюємо масу на аналітичних терезах. Результати заносять у таблицю.
№ |
Зважуємий предмет |
Маса на т/х терезах, гр |
Маса на аналітичних терезах, гр |
1 |
Порожня фарфорова чашка |
|
|
2 |
Наважка С2Н2О4 |
|
|
3 |
Чашка з наважкою |
|
|
3. Визначення еквівалентної молярної концентрації розчину гідроксиду калію або натрію по стандартному розчину щавлевої кислоти.
По величині точної наважки щавлевої кислоти ведемо розрахунок точної еквівалентної молярної концентрації оксалатної кислоти
![]()
де q – наважка речовини, г;
Е – еквівалентна маса, г/моль;
V – об’єм, см3 (дорівнює 100).
________________________________________________________________________________________________________________
Обираємо індикатор: у випадку титрування слабої кислоти розчинником сильного гідрооксиду момент еквівалентних настань при рН більше 7, у лужному середовищі при такому значенні рН змінює забарвлення індикатора фенолфталеїну, який і обираємо у цьому випадку титрування.
Для визначення еквівалентної молярної концентрації розчину гідрооксиду натрію або калію, промиваємо бюретку розчином, обережно заповнюють її до нульового ділення по нижньому меніску, перевірив заповнення капіляру, виймають із бюретки мікроворонку. Піпеткою шляхом висмоктування рідини вище мітки набираємо розчин щавлевої кислоти, потім, прикрив отвір піпетки вказівним пальцем правої руки, доводимо рівень розчину кислоти у піпетці до відмітки по нижньому меніску, переносимо виміряний піпеткою об’єм кислоти у колбу для титрування, додаємо 2-3 краплини фенолфталеїну і титруємо розчином гідрооксиду калію або натрію до появи блідо-рожевого забарвлення, після кожного титрування рівень гідрооксиду калію або натрію доводимо до нульового ділення. Титруємо 3 правильних рази.
Результати титрування заносимо у таблицю (результати записуємо тільки тоді, якщо розходження між титруваннями не більше, чим 0,2 см3.)
Щавлева кислота |
Гідрооксид натрію або калію |
Секв =
V = об’єм піпетки, см3 |
V1 = V2 = V3 =
Т
=
|

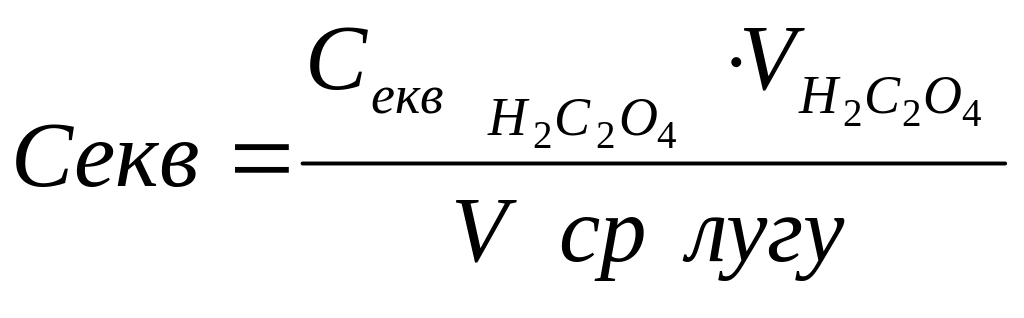 =
=