
- •В ведение
- •Глава 1 гели для электрофореза полиакриламидныи гель (пааг) Исходные материалы
- •Процесс полимеризации пааг
- •Выбор концентраций мономеров
- •Агароза
- •Ацетатцеллюлозная пленка, импрегнированная пааг
- •Глава 2 техника приготовления гелей и аппаратура
- •Вертикально расположенные трубки
- •Вертикально расположенные пластины
- •Горизонтально расположенные пластины
- •Глава 3 электрофорез белков
- •Замечания общего характера Миграция белков в геле
- •Напряженность электрического поля (н)
- •Выбор буфера рабочего геля
- •Выделение тепла при электрофорезе
- •Загрузка геля. Ширина белковых зон
- •Введение мочевины и -меркаптоэтанола. Некоторые артефакты
- •Лидирующие красители
- •Разделение белков по размерам и заряду
- •Выбор рабочего буфера
- •Использование мочевины
- •Загрузка геля и подготовка препарата
- •Некоторые примеры
- •Фракционирование гистонов и других щелочных белков.
- •Разделение белков по размеру с использованием ддс-Na Существо метода
- •Выбор пористости геля
- •Присутствие мочевины и неионных детергентов
- •Выбор рабочего буфера геля
- •Подготовка белкового препарата
- •Проведение электрофореза
- •Окрашивание и элюция белков
- •Ступенчатый электрофорез (disc-electrophoresis)
- •Градиент пористости пааг
- •Двумерный электрофорез в пааг
- •Электрофорез с использованием тритона х-100 и цетавлона Тритон х-100
- •Цетавлон
- •Окрашивание белков в пааг
- •Кислые красители
- •Другие красители и методы окрашивания
- •Флюоресцентные красители
- •Локализация ферментов после электрофореза
- •Локализация белковых полос осаждением ддс-Na
- •Элюция белков из геля
- •Определение радиоактивности белков после электрофореза в пааг
- •Счет радиоактивности в элюатах белка
- •Растворение пааг
- •Импрегнирование сцинтиллятора в гель
- •Авторадиография
- •Флюорография
- •Препаративныи электрофорез белков
- •Оглавление
- •Глава 1
- •Глава 2
- •Глава 3
- •Глава 4
- •Глава 1 . Основные понятия теории седиментации ............ 175
- •Глава 2 Ультрацентрифуга ..................... 177
- •Глава 3 Роторы и пробирки .................... 182
- •Глава 4 Раздельное осаждение частиц (дифференциальное центрифугирование) 199
- •Глава 5
Локализация ферментов после электрофореза
В ряде случаев электрофорез ферментов в мягких условиях (без ДДС-Na или мочевины) не сказывается на их активности. Положение полос ферментов в геле можно идентифицировать с помощью специфических реакций, дающих окрашенные продук- ты. Для этого гель вымачивают в растворе субстратов и кофак- торов, необходимых для протекания определенной ферментатив- ной реакции, иногда с добавлением реагентов, сообщающих окраску продукту этой реакции. Эту операцию следует проводить быстро во избежание диффузии нефиксированных белков из их полос. Если субстрат реакции полимерен и плохо диффундирует, его можно заполимеризовать прямо в гель и следить за продви- жением фронта ферментативной реакции вместе с миграцией фермента. Разумеется, при этом необходимо ясно представлять, каково будет поведение субстрата в электрическом поле во вре- мя электрофореза.
101
Можно заполимеризовать субстрат и кофакторы в другом («индикаторном») геле на основе агарозы или импрегнировать ими фильтровальную бумагу. После окончания электрофореза белков в пластине рабочего ПААГ на его поверхность наклады- вают индикаторный гель или бумагу. Ферменты диффундируют в них из рабочего геля и обнаруживают себя соответствующей цветной реакцией. Габриель привел длинный список индикатор- ных цветных реакций для ферментов [Gabriel, 1971]. Во многих случаях в этих реакциях фигурирует восстановление НАД с дальнейшей передачей электрона на краситель. Удобно в каче- стве заключительного этапа реакции воспользоваться нефермен- тативным восстановлением тетразолиевой соли до ее формазана,. что дает сильно окрашенные и зачастую нерастворимые продук- ты (схема реакции приведена ниже),
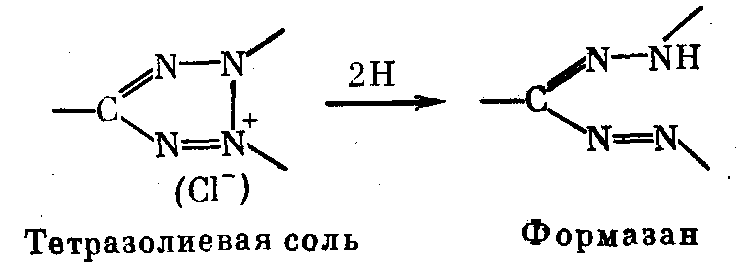
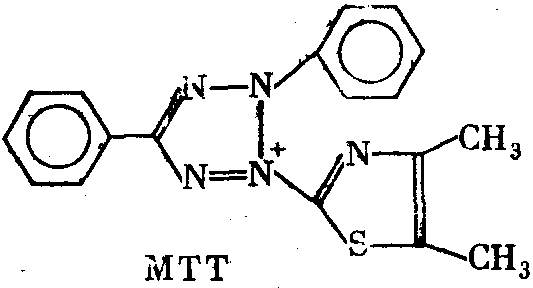
В качестве примера можно назвать часто употребляющийся препарат «Methyl thiazolyl blue» (MTT) или еще более сложное соединение «Nitro blue tetrazolium» (NBT). В окисленном виде
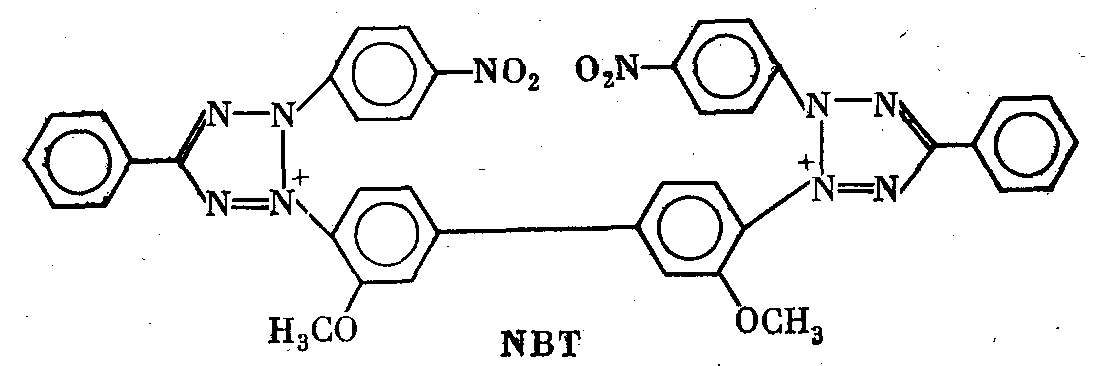
обе эти соли бесцветны. При восстановлении первая дает сине- пурпурную, а вторая—иссиня-черную окраску. Реакция восста- новления красителей ускоряется в присутствии промежуточного переносчика электронов «Phenazine methosulfate» (PMS) или нового, более стойкого реагента, выпускаемого для этой цели фирмой «Boehringer» под названием «Meldolablue» [Turner, Hopkinson, 1979].
102
Для обнаружения в геле протеолитических ферментов пред- ложен ряд нетривиальных методов. Например, после электрофо- реза гель вымачивают в течение 2 ч при 37° в 8%-ном растворе цитохрома с в буфере с рН 8,5, содержащем 8 М мочевину и 1,7 мМ CaCl2. Затем белок фиксируют в 12,5%-ной ТХУ. Диф- фундируя в гель, цитохром с окрашивает его в коричневый цвет по всему объему. Полосы протеаз, разрушающих цитохром с, остаются прозрачными и хорошо видны на коричневом фоне [Ward, 1976]. Суть другого подхода заключается в том, что на гель накладывают обработанную закрепителем в темноте (для удаления серебра) и вымоченную в буфере фотопленку. После трехчасовой выдержки при 35° во влажной камере на фотоплен- ке можно обнаружить следы диффузии в нее протеаз, разрушаю- щих слой желатины [Burger, Schroeder, 1976].
Для обнаружения нуклеаз при полимеризации геля в него вносят ДНК (10 мкг/мл) или РНК (25 мкг/мл). Если нуклеазы для своего действия нуждаются в ионах Mg2+, Са2+ или Zn2+, то в их растворе ПААГ вымачивают после окончания электрофоре- за. Далее следует окрашивание геля красителем для нуклеино- вых кислот—бромистым этидием (см. главу 4). Окрашивается весь гель, за исключением полос, содержащих нуклеазы, где нуклеиновая кислота разрушена. Можно вести разделение нук- леаз и в присутствии ДДС-Na, блокирующего их действие во время электрофореза. Перед обработкой бромистым этидием ДДС-Na из геля вымывают.
Заполимеризовав в ПААГ денатурированную ДНК, можно выявить нуклеазы, специфичные для однонитевых ДНК. Мож- но также исследовать оптимизацию условий, необходимых для активности нуклеаз, варьируя состав буфера геля, или опробо- вать различные ингибиторы нуклеазной активности. С помощью кольцевых ДНК удается отличить эндонуклеазы от экзонуклеаз. Электрофорезу можно подвергнуть лизаты бактерий для выяс- нения содержания в них нуклеаз [Rosenthal, Lacks, 1977]. Окра- шивание бромистым этидием в описанных опытах можно заме- нить авторадиографией (см. ниже), если в гель заполимеризо- вать меченную 32Р нуклеиновую кислоту или синтетический полинуклеотид [Iborra et al., 1979].
Выше указывалось, что для локализации ферментов по их активности электрофорез желательно проводить в условиях, исключающих возможность денатурации. Однако в недавней ра- боте [Lacks, Springhorn, 1980] было показано, что очистку цело- го ряда ферментов (ДНКазы I, некоторых протеаз, амилазы, глюкозо-6-фосфатдегидрогеназы) можно производить электро- форезом в ПААГ с ДДС-Na после соответствующей обработки их детергентом при повышенной температуре. Денатурация ока- зывается обратимой. По окончании электрофореза ДДС-Na от- мывают и одновременно снимают с белка встряхиванием геля в течение 1—2 ч в 0,04 М Трис-буфере, рН 7,6. Ферментативная активность в ряде случаев восстанавливается.
103
По данным Хагера и Буржесс, при снятии ДДС-Na с фермен- та имеет смысл денатурировать его кратковременной обработ- кой 6 М гуанидинхлоридом с последующей ренатурацей при раз- бавлении. Возможно, что при этом восстанавливается нативная конфигурация белка, нарушенная при первоначальной обработке ДДС-Na [Hager, Burgess, 1980]. Для ферментов, содержащих несколько полипептидных цепей (химотрипсин), предваритель- ную обработку (-меркаптоэтанолом, разумеется, следует исклю- чить. Впрочем, то же самое относится и к одноцепочечному трип- сину. По-видимому, разрыв внутрицепочечных S—S-связей в нем приводит к необратимой денатурации. Ферменты, состоящие более чем из двух субъединиц, не ренатурируют.
В заключение отметим, что гликопротеиды после электрофо- реза в ПААГ можно локализовать, вымачивая гель в растворе конканавалина А, конъюгированного с флюоресцентной меткой, например с флюоресцеинизотиоцианатом [Furlan et al., 1979], или радиоактивно меченного введением 125I [Horst et al., 1980].
