
- •Техника безопасности
- •1. Электропроводность растворов электролитов
- •Электропроводность растворов электролитов
- •Удельная электропроводность
- •Кондуктометрическое титрование
- •Определение растворимости труднорастворимой соли.
- •Работа 1.1. Определение концентрационной зависимости удельной и молярной электропроводности сильного электролита
- •Порядок выполнения работы:
- •Работа 1.2. Определение константы диссоциации слабого электролита методом электропроводности
- •Порядок выполнения работы:
- •Работа 1.3. Кондуктометрическое титрование
- •Порядок выполнения работы:
- •Работа 1.4. Кондуктометрическое определение термодинамических параметров растворения труднорастворимого соединения
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •2. Электродвижущие силы Возникновение потенциалов на границах фаз.
- •Электродный потенциал
- •Водородный электрод
- •Измерение электродных потенциалов
- •Электрохимический (гальванический) элемент
- •Концентрационный гальванический элемент
- •Измерение эдс гальванического элемента компенсационным методом
- •Температурная зависимость эдс.
- •Электроды сравнения
- •Хлорсеребряный электрод
- •Окислительно-восстановительные электроды и их потенциалы
- •Мембранные равновесия. Стеклянный электрод
- •Кислотно-основные буферные системы
- •Механизм буферного действия
- •Буферная емкость
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Окислительно-восстановительных потенциалов
- •Порядок выполнения работы:
- •Буферной ёмкости буферных систем
- •Порядок выполнения работы:
- •Порядок выполнения работы:
- •Контрольные вопросы Перед выполнением работы:
- •К защите работы:
- •3. Адсорбция
- •Метод полных концентраций
- •Термодинамика адсорбции по Гиббсу
- •Уравнение адсорбции Гиббса
- •Адсорбция из жидких растворов на поверхности твердых адсорбентов
- •Теплоты адсорбции
- •Работа 3.1. Изучение адсорбции паров воды на твердом адсорбенте
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.2. Изучение адсорбции уксусной кислоты из водного раствора на активированном угле
- •Интерферометрический метод анализа концентрации растворов.
- •Технология проведения адсорбции и методика определения равновесных концентраций растворов и расчета адсорбции по результатам эксперимента:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 3.3. Изучение адсорбции поверхностно-активных веществ (пав) на границе воздух-раствор
- •Измерение поверхностного натяжения жидкостей методом Ребиндера.
- •Расчет адсорбции на границе раздела водный раствор – воздух.
- •Порядок выполнения работы:
- •Проверка выполнимости правила Дюкло – Траубе
- •Перед выполнением работы:
- •К защите работы:
- •4. Газовая хроматография
- •Общие сведения о газовом хроматографе
- •Детекторы
- •Детектор по теплопроводности (дтп)
- •Пламенно-ионизационный детектор (пид)
- •Качественный и количественный анализ в газовой хроматографии.
- •Определение мольных теплот растворения газов и паров в жидкостях газохроматографическим методом
- •Порядок работы на хроматографе лхм-80
- •Работа 4.1. Качественный и количественный анализ смеси углеводородов с помощью газовой хроматографии на колонке с апьезоном, нанесенным на хроматон.
- •Определение качественного состава смеси углеводородов по совпадению времен удерживания компонентов контрольной смеси с временами удерживания углеводородов c6 - с9 .
- •Расчет поправочных коэффициентов для углеводородов c6 - с9 и определение количественного состава контрольной смеси углеводородов в мольных процентах.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.2. Определение мольных теплот растворения нормальных углеводородов c6- c9 в апьезоне хроматографическим методом
- •Перед выполнением работы:
- •К защите работы:
- •Работа 4.3. Определение индексов ковача веществ и их температурных коэффициентов на апьезоне
- •Перед выполнением работы:
- •К защите работы:
- •Химическая кинетика
- •Кинетические уравнения реакций различных порядков Реакции нулевого порядка
- •Реакции первого порядка
- •Реакции второго порядка
- •Реакции n-го порядка
- •Способы определения порядков реакции.
- •Зависимость скорости реакции от температуры
- •Сложные реакции
- •Работа 5.1. Кинетика омыления этилацетата в присутствии ионов гидроксила.
- •Порядок выполнения работы:
- •Определение æ0.
- •Определение константы скорости реакции при разных температурах.
- •Определение энергии активации и предэкспоненциального множителя.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.2. Изучение кинетики гомогенно-каталитического разложения н2о2 .
- •Порядок подготовки установки к работе и работа на ней.
- •Порядок проведения кинетических опытов:
- •Варианты задания и методика расчетов.
- •Изучение зависимости скорости реакции разложения перекиси водорода от концентрации катализатора.
- •Влияние начальной концентрации н2о2 на период полупревращения. Определение порядка реакции.
- •III. Определение константы равновесия и константы скорости реакции разложения перекиси водорода.
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.3. Изучение кинетики инверсии сахарозы.
- •Методика измерения угла вращения на поляриметре (сахариметре)
- •Методика измерения угла вращения на автоматическом поляриметре
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
- •Работа 5.4. Изучение кинетики реакции окисления иодид-ионов ионами трёхвалентного железа фотометрическим методом
- •Порядок выполнения работы:
- •Перед выполнением работы:
- •К защите работы:
Работа 1.2. Определение константы диссоциации слабого электролита методом электропроводности
ЦЕЛЬ РАБОТЫ: Определение константы диссоциации слабой кислоты из величин молярной электропроводности растворов этой кислоты разных концентрации при постоянной температуре.
Оборудование: кондуктометр, ячейка, пипетка на 50 мл., химические стаканы.
Реактивы: слабая кислота (по указанию преподавателя), дистиллированная вода.
Порядок выполнения работы:
В работе использовать ячейку, для которой в работе а) измеряли удельную электропроводность.
Приготовить 100 мл раствора слабой кислоты концентрации 0.1 моль× л–1.
Промыть измерительную ячейку дистиллированной водой. С помощью пипетки налить в стакан 50 мл раствора слабой кислоты концентрации 0.1 моль× л–1.
Измерить удельную электропроводность раствора. Измерения повторить три раза, рассчитать среднее значение электропроводности.
Отобрать из стакана пипеткой 25 мл раствора кислоты и добавить в него 25 мл дистиллированной воды, тщательно перемешать раствор, измерить 3 раза его электропроводность.
Вновь отобрать из стакана 25 мл раствора, добавить 25 мл дистиллированной воды, вновь 3 раза измерить электропроводность раствора.
Ещё трижды выполнить разбавление раствора, каждый раз проводя измерение электропроводности полученного раствора.
Измерить температуру воздуха в лаборатории.
Результаты измерений и расчетов записать в таблицу 1.2.
Рассчитать значения lc = (1000 æ /С) , a = l/l¥ , значение кажущейся константы диссоциации Кс рассчитать по уравнению Оствальда для каждой концентрации слабой кислоты; величину l¥ рассчитать по уравнению Кольрауша, используя подвижности анионов и катионов из справочника.
Таблица 1.2.
C моль× л-1 |
V см3моль-1 |
æ (См·см1) |
lс (см2См.моль1) |
a |
Кс |
0.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.05 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.025 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0125 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0062 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Результаты работы представить в виде графиков зависимостей:
удельной эектропроводности от разведения æ= f (V);
мольной электропроводности от разведения lс = f (V);
кажущейся константы диссоциации Кс = f (c);
lgKc = f
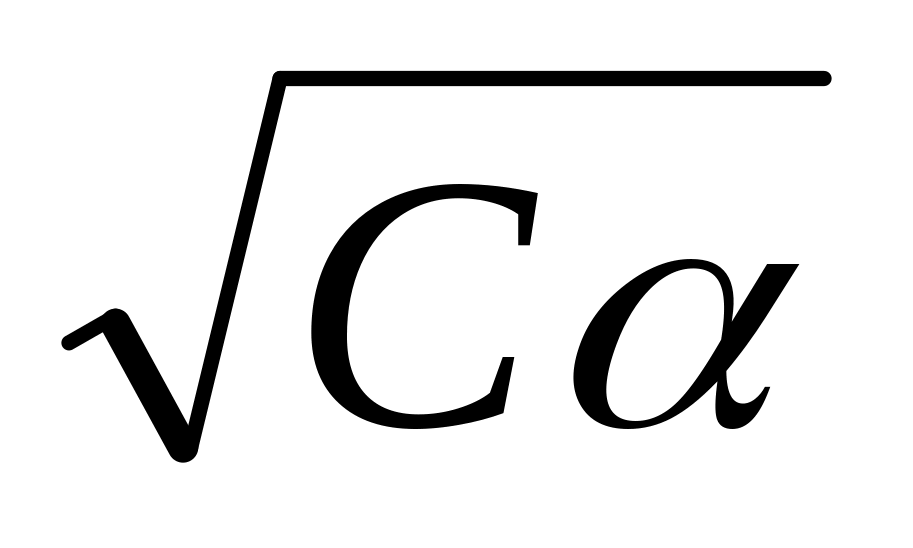 и
экстраполяцией определить величину
термодинамической константы диссоциации
КТ .
и
экстраполяцией определить величину
термодинамической константы диссоциации
КТ .
