
- •Содержание
- •Работа 1. Физико-химический анализ двухкомпонентной смеси.
- •Работа 3. Изучение взаимной растворимости трехкомпонентной системы
- •Свойства разбавленных растворов
- •Работа 4. Определение изотонического коэффициента I электролита в водном растворе методом криоскопии.
- •Электропроводность растворов электролитов.
- •Работа 5. Определение электропроводности и константы диссоциациислабого электролита.
- •Контрольные вопросы
- •Работа 7. Измерение эдс гальванического элемента.
- •Адсорбция
- •Работа 9. Влияние различных факторов на величину адсорбции израстворов.
- •Контрольные вопросы
- •Работа10. Изучение адсорбции поверхностно-активного вещества (пав) на границе воздух-раствор.
- •Контрольные вопросы
- •Газовая хроматография
- •Работа 13. Изучение кинетики гомогенного каталитического разложения н2о2.
- •1. Некоторые физические постоянные
- •2. Криоскопические и эбуллиоскопические постоянные некоторых растворителей
- •3. Константы диссоциации некоторых кислот
- •4. Удельная электропроводность раствора кСl (0,01 моль/л) при различных температурах, Ом-1 см-1.
- •7. Зависимость поверхностного натяжения воды от температуры.
- •8. Свойства логарифмов
- •9. Некоторые интегралы
Содержание
ВВЕДЕНИЕ…………………………………………………..…5
ФАЗОВЫЕ ДИАГРАММЫ……………………………………6
Работа 1 Физико-химический анализ двухкомпонентной смеси…………………………………………………………..……11
Работа 2 Термический анализ лекарственных смесей………………………………………………...…………..…16
Работа 3 Изучение взаимной растворимости трехкомпонентной системы…………………………………………………………...20
СВОЙСТВА РАЗБАВЛЕННЫХ РАСТВОРОВ.…………….24
Работа 4 Определение изотонического коэффициента i электролита в водномрастворе методом криоскопии……………...........................................................................26
ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ…………………………………………………………...…30
Работа 5 Определение электропроводности и константы диссоциации слабогоэлектролита………………………………………………………………..35
Работа 6 Кондуктометрическое титрование……………….…38
ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И ЭЛЕКТРОДВИЖУЩИЕ СИЛЫ…………………...…………………………..….42
Работа 7 Измерение ЭДС гальванического элемента…………………………………………………….………….51
Работа 8 Измерение окислительно-восстановительных потенциалов………………………………………………………..……..56
АДСОРБЦИЯ…………………………………………….…...59
Работа 9 Влияние различных факторов на величину адсорбции из растворов…………………………………………………….66
Работа 10 Изучение адсорбции поверхностно-активного вещества (ПАВ) награнице воздух-раствор……………………...68
Работа 11 Исследование поверхностной активности ПАВ одного гомологического ряда…………………………….......……75
ГАЗОВАЯ ХРОМОТОГФИЯ…………………….…………....77
Работа 12 Качественный и количественный анализ углеводородов с помощьюгазовой хроматографии…...…………………………………………………………84
ХИМИЧЕСКАЯ КИНЕТИКА……………………………..…91
Работа 13 Изучение кинетики гомогенного каталитического разложения Н2О2…………………………………………………...95
Работа 15 Определение константы скорости инверсии сахарозы…………………………………………………...…………108
ПРИЛОЖЕНИЕ..............................................................................115
ВВЕДЕНИЕ
Практикум по физической и коллоидной химии (ч.1) предназначен для студентов медицинского факультета специальности "Фармация" и включает 15 работ.
Лабораторные работы выполняются параллельно с изучением теоретического курса. Каждая работа представляет собой небольшое исследование, при проведении которого студенты получают навыки экспериментальной работы, овладевают методами физико-химических измерений, получивших широкое применение в фармации, учатся анализировать полученные экспериментальные данные и на основе этого делать обобщающие выводы.
Для выполнения каждой лабораторной работы необходимо:
Изучить по конспекту лекций и учебнику теоретический материал, необходимый для выполнения работы;
Внимательно прочитать описание лабораторной работы и ответить на вопросы в конце описания;
Выполнить опыт и в лабораторном журнале оформить отчет. В отчете указывается название лабораторной работы, ее цель, записываются основные уравнения и вычисления. Результаты опытов оформляются в виде таблиц и графиков на миллиметровой бумаге. Запрещается вести запись лабораторных работ на отдельных листочках и в черновых тетрадях. В заключении каждого отчета формулируются основные выводы.
Защитить лабораторную работу у преподавателя.
ФАЗОВЫЕ ДИАГРАММЫ
Фазовые диаграммы показывают зависимость состава многокомпонентных систем от внешних факторов (температуры, давления) и описывают происходящие в системах фазовые превращения. Эти диаграммы позволяют делать выводы о составе смеси веществ, их взаимодействии (образовании новых химических соединений и растворов), а также границах их существования.
Знание фазовых диаграмм используется в фармацевтическом анализе для идентификации и определения чистоты лекарственных препаратов, выбора наиболее оптимальных путей их выделения из смесей, определения состава смесей для решения вопроса о совместимости лекарственных препаратов.
Фазовые диаграммы "состав системы - температура" (диаграммы плавкости) строят на основании кривых охлаждения - зависимости температуры системы от времени ее охлаждения. Число компонентов К и число фаз в системе Ф связаны правилом фаз Гиббса, которое при постоянном давлении выражается уравнением:
С = К - Ф + 1 (1.1),
где С - число степеней свободы, показывающее количество параметров (число компонентов и температуру), которые можно менять при сохранении заданного числа фаз.
Однокомпонентные системы
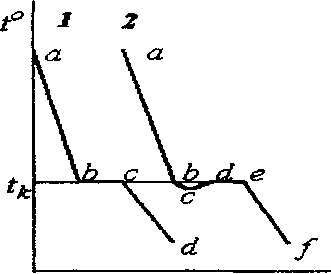
На рис.1.1 представлены кривые охлаждения для чистого вещества (К=1).
время
Рис. 1.1 Кривые охлаждения однокомпонентной системы.
Участок ab кривой 1 соответствует охлаждению жидкого вещества (Ф=1),что соответствует степени свободы С=1, и температура системы непрерывно уменьшается. При температуре кристаллизации tk в точке “b” появляются первые кристаллы и система становится двухфазной (Ф=2). При этом на кривой охлаждения наблюдается излом.
На участке bс число степеней свободы равно нулю (С=0), и температура в процессе кристаллизации не изменяется (горизонтальный участок площадки на кривой охлаждения). Потери тепла системой компенсируются теплотой выделяющейся при кристаллизации. В точке “с” исчезают последние капли жидкости и на участке cd происходит охлаждение твердого вещества , при этом С=1.
Однако на практике жидкость может переохладиться до температуры ниже tk. В этом случае на участке bс кривой 2 образования кристаллов не наблюдается, хотя температура ниже температуры кристаллизации, но после формирования первых кристаллов выделение теплоты кристаллизации приводит к повышению температуры до
tк (участок сd кривой 2). В точке “е” кристаллизация заканчивается и на участке ef происходит охлаждение кристаллов С=1.
Двухкомпонентные системы
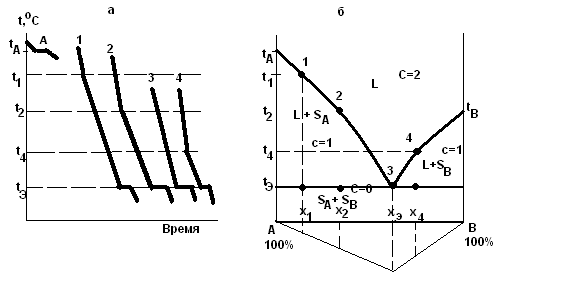
Рассмотрим систему из двух веществ А и В (К=2), температуры кристаллизации (плавления) которых tА и tВ. Если не происходит переохлаждения, то для чистого вещества А кривая охлаждения (кривая А рис. 1.2) имеет горизонтальную площадку при температуре tА.
D
F
Рис. 1.2 Кривые охлаждения (а) и диаграмма плавкости и треугольник Таммана (б) двухкомпонентной системы.
Для смеси А и В состава x1 температура начала кристаллизации вещества А t1 ниже температуры ta.На кривой охлаждения (рис. 1.2) системы состава x1 началу кристаллизации вещества А соответствует излом при температуре t1. В процессе кристаллизации компонента А его концентрация в жидкости уменьшается, а концентрация В увеличивается, что и приводит к постепенному понижению температуры кристаллизации А вплоть до tэ. По правилу фаз в ходе кристаллизации вещества А из раствора система, содержащая 2 компонентп и 2 фазы, имеет одну степень свободы (С=2-2+1=1), поэтому температура кристаллизации изменяется. Снижение скорости охлаждения системы при температурах ниже t1 связано с выделением в системе теплоты кристаллизации. При температуре tэ жидкий раствор становится насыщенным в отношении вещества В, которое при этих условиях также начинает кристаллизоваться. Система становится трехфазной (жидкость, кристаллы и кристаллы В), и число ее степеней свободы равно нулю (С=2-3+1=0). Таким образом, одновременная кристаллизация А и В из раствора происходит при постоянных температуре (tэ) и составе жидкого раствора (xэ).Эта температура называется эвтектической. На кривой охлаждения 1(рис.1.2) процессу одновременной кристаллизации А и В соответствует площадка при tэ. Расплав, из которого одновременно выпадают кристаллы А и В, называется эвтектическим расплавом, образующаяся при этом смесь мелких кристаллов двух веществ называется эвтектикой. Ниже tэ , система содержит две фазы (кристаллыА и кристаллыB) и число степенейсвободы равно 1 (C=2-2+1=1).
Для смеси состава x2 (кривая 2 (рис. 1.2)), содержащей больше веществ В, чем смесь x1, кристаллизация А начинается, в соответствии со сказаннымранее, при более низкой температуреt2. Когда выпадение кристалловА приведёт к такой концентрации вещества В, что оно также начнёт кристаллизоваться, то температура одновременной кристаллизацииAиВбудет такой же, как и для смеси 1. Если же взять смесь xэ, состав которой позволяет веществам А и В кристаллизоваться одновременно без предварительного выпадения кристаллов А или кристаллов В, то криваяохлаждения будет изображаться как кривая 3(охлаждение расплава эвтектического состава). Для смесиx4, содержащейизбыток вещества В по сравнению с концентрацией xэ , кривая охлаждения подобна кривой 2, но сначала выпадают кристаллы В, и только при достижении состава раствора, допускающего одновременную кристаллизациюА иВ, наблюдается горизонтальная площадка при температуреtэ .
Чем ближе по составу расплав к эвтектике, тем длиннее горизонтальные участки на кривых охлаждения, так как масса эвтектики увеличивается.
Диаграмма состояния двухкомпонентной системы в координатах температура-состав (рис. 1.2,б) строится на основании кривых охлаждения и называется диаграммой плавкости. Например, для чистого вещества А (левая ось ординат диаграммы плавкости) температура кристаллизации tА, для смеси x1 , содержащей 20% вещества В, кристаллизация начинается при температуреt1 , что на диаграмме соответствует точке 1. Для смесей x2,xЭ иx4 начало кристаллизации показано точками 2, 3 и 4. Следовательно, область диаграммы над линиейtА3 иtB3 соответствует жидкому состоянию системы.Такие линии называют линиями ликвидуса от латинского слова liquidus (жидкость), и область диаграммы над ней обозначают буквойL.Твёрдое тело по латыни называется solidus, поэтому существование твердой фазы в области диаграммы обозначают буквой S.
Области диаграммы между кривой ta3,tb3 и прямой tЭD отвечают двухфазным (гетерогенным) состояниям системы, так как в ней при этихусловиях присутствуют жидкость и кристаллы веществ А или В. Как видно из диаграммы( рис. 1.2.б) есть две области L + S: в левой - жидкая фаза находится в равновесии с кристаллами веществаA (L + SА), а в правой - с кристаллами веществаВ(L + SВ). Область диаграммы под прямой tЭDсоответствует двум твёрдым фазам и обозначается как (SА + SВ), потому что система в данном случае состоит из смеси кристалловАиВ. Система из трех фаз может существовать только при температуреtЭ (линия tЭD).
Если на диаграмме отложить по вертикали вниз отрезки, пропорциональные или равные длинам горизонтальных участков(площадок) от оси состава для всех исследованных смесей, и соединить их концы, то можно получить треугольник Таммана(∆ABF). Причем максимальную эвтектическую площадку имеет смесь эвтектического состава. Этот треугольник позволяет экстраполяцией определить эвтектический состав, если он не попал в составы исследуемых смесей.
Таким образом, получив из опыта кривые охлаждения ряда смесей с известным соотношением двух данных компонентов, можно построить диаграмму плавкости.
