
- •Третичный вторичный первичный.
- •Задачи (алканы)
- •Задачи (алкены)
- •2. С какими из приведенных соединений реагируют бутен-1 в указанных условиях?
- •H2o, 20c; 7) Br2 / 20c (в темноте); 8) hBr. 9) Na . Напишите уравнения реакций.
- •Задачи (алкины)
- •Задачи (диены)
- •Лабораторная работа № 2
- •Задачи (арены)
- •Галогенопроизводные
- •Лабораторная работа № 3
- •Задачи (галогенопроизводные)
- •Спирты и фенолы
- •Лабораторная работа № 4
- •Задачи (спирты, фенолы)
- •Задачи (амины)
- •Альдегиды и кетоны
- •Лабораторная работа № 5
- •Задачи (альдегиды и кетоны)
- •Карбоновые кислоты
- •Лабораторная работа №6
- •Задачи (карбоновые кислоты)
- •Задачи (оксикислоты)
- •Аминокислоты
- •Задачи (аминокислоты)
- •Углеводы
- •Лабораторная работа №7
- •Задачи (углеводы)
А.В. Варламов, Е.А. Сорокина, Л.Г. Воскресенский,
Ф.И. Зубков
МЕТОДИЧЕСКОЕ РУКОВОДСТВО
К ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ
ПО ОРГАНИЧЕСКОЙ ХИМИИ
Для студентов I курса специальностей
«Ветеринарно-санитарная экспертиза»
Москва
Издательство Российского университета дружбы народов
УГЛЕВОДОРОДЫ (АЛКАНЫ, АЛКЕНЫ, АЛКИНЫ)
В зависимости от их молекулярной массы углеводороды при обычных условиях могут быть газообразными, жидкими или твердыми. Они не растворимы в воде. Все они горят. В зависимости от процентного содержания углерода в молекуле углеводорода пламя имеет различную окраску, что позволяет сделать предварительное предположение о содержании углерода в молекуле. Так, метан и другие низкомолекулярные алканы горят на воздухе неокрашенным пламенем, алкены и алкины – светящемся пламенем. Алкины сильно коптят, так как не весь углерод успевает сгореть.
Точно установить принадлежность углеводорода к тому или иному классу можно только в результате изучения его химических свойств.
Алканы (парафины) инертны: в обычных условиях они не окисляются водным раствором перманганата калия, не взаимодействуют с галогенами и концентрированной серной кислотой. В более жестких условиях могут протекать реакции радикального замещения водорода на другие группы (галоген, нитро-группу, сульфо-группу). При этом атомы углерода по легкости протекания реакции радикального замещения можно расположить в следующий ряд:
Третичный вторичный первичный.
Отсутствие реакций с галогенами и устойчивость к окислению при обычных условиях используется как доказательство насыщенной структуры углеводорода, то есть наличия в молекуле только -связей.
Алкены содержат в своей структуре двойные связи, которые состоят из -связи и менее прочной -связи. -Связь в результате реакции электрофильного присоединения превращается в прочную -связь. Реакции присоединения протекают легко при обычных условиях. Присоединение брома сопровождается обесцвечиванием раствора.
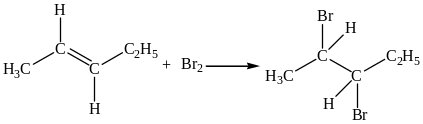
Также легко алкены окисляются нейтральным водным раствором перманганата калия в двухатомные спирты – гликоли.
CH3-CH = CH2 + KMnO4 CH3-CH(OH)-CH2(OH) + MnO2 + KOH
Раствор перманганата калия обесцвечивается и выпадает коричневый осадок MnO2.
Алкины содержат в своей структуре тройную связь, состоящую из -связи и двух -связей. Алкины так же, как и алкены, легко присоединяют галоген и легко окисляются.
CH3-CCH + 2 Br2 CH3-CBr2-CHBr2

Эти две реакции – присоединения брома и окисление раствором перманганата калия – используются для качественного обнаружения в молекулах двойных и тройных связей (кратные связи).
Тройную связь можно отличить от двойной специфическими реакциями или физико-химическими методами анализа. Наиболее легко можно обнаружить тройную связь, находящуюся на конце молекулы (терминальная связь). Терминальная тройная связь содержит атом водорода (терминальный водород). Этот атом водорода является «кислым» и легко замещается на активные металлы или вытесняет металлы из солей.

Образующиеся осадки ацетиленидов металлов нерастворимы в воде и имеют характерную окраску. Ацетиленид серебра – белый осадок, становящийся серым со временем; ацетиленид меди окрашен в красно-коричневый цвет, фенилацетиленид меди – в желтый цвет. Образование ацетиленидов является качественной реакцией для обнаружения концевой ацетиленовой группировки.
ЛАБОРАТОРНАЯ РАБОТА № 1
Опыт 1. Взаимодействие углеводородов с бромом.
Налейте в три пробирки по 1 мл бромной воды. В первую пробирку добавьте 2 мл н-гептана, во вторую – 2 мл циклогексена. Встряхните содержимое пробирок. В третью пробирку пропустите ацетилен, полученный из карбида кальция. Наблюдения и выводы запишите в лабораторный журнал.
Получение ацетилена: В колбу Вюрца, снабженную капельной воронкой и газоотводной трубкой, положите 2 г карбида кальция (СаС2). Газоотводную трубку опустите в пробирку, которая наполнена бромной водой. Из капельной воронки прибавьте к карбиду кальция 2-3 мл воды. При этом образуется ацетилен.
Опыт 2. Окисление углеводородов раствором перманганата калия.
Налейте в три пробирки по 1 мл раствора перманганата калия. В первую пробирку добавьте 2 мл н-гептана, во вторую – 2 мл циклогексена. Встряхните содержимое пробирок. В третью пробирку пропустите ацетилен, полученный из карбида кальция. Наблюдения и выводы запишите в лабораторный журнал.
Опыт 3. Получение ацетиленидов меди.
В две пробирки налейте по 1 мл раствора аммиачного комплекса однохлористой меди. В первую пробирку добавьте 1 мл фенилацетилена, а во вторую – пропустите ацетилен, полученный из карбида кальция. Наблюдения и выводы запишите в лабораторный журнал.
Опыт 4. Горение углеводородов.
Налейте в фарфоровые чашечки по 2 мл н-гептана и циклогексена, подожгите (опыт проводить под тягой!). Подожгите ацетилен, полученный из карбида кальция. Проследите за окраской пламени. Напишите уравнения горения н-гептана, циклогексена, ацетилена. Наблюдения и выводы запишите в лабораторный журнал.
