
Методичка_(часть_II)
.pdf
|
|
|
IV. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ |
|
|
|
Энергия Гиббса объемной фазы пропорциональна ее массе, а следовательно, |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
объему, занимаемому системой: |
|
|
|
|
|
|
|
|
||||||
|
Поверхностная энергия и поверхностное натяжение |
|
|
|
|
GV = k·V |
|
|
|
(4.2) |
|
|
|
||||||||||||
Живые организмы представляют собой системы с очень развитыми |
Поверхностная энергия Гиббса системы пропорциональна площади |
||||||||||||||||||||||||
поверхностями раздела, к которым относят кожные покровы, поверхность |
межфазной поверхности: |
|
|
|
|
|
|
|
|
||||||||||||||||
стенок кровеносных сосудов, слизистые оболочки, клеточные мембраны, |
|
|
|
GS = ·s, |
|
|
|
(4.3) |
|
|
|
||||||||||||||
мембраны ядер, митохондрий, лизосом и т.д. Так, например, поверхность |
где Gs − поверхностная энергия Гиббса системы, Дж; − коэффициент |
||||||||||||||||||||||||
кожи взрослого человека составляет 1,5 - 1,6 м2, площадь поверхности |
пропорциональности, называемый поверхностным натяжением, Дж/м2; s − |
||||||||||||||||||||||||
эритроцитов всей крови человека составляет 2500 - 3800 м2, площадь |
площадь межфазной поверхности, м2. |
|
|
|
|
|
|
|
|||||||||||||||||
поверхности капилляров печени − около 400 м2, площадь поверхности |
Поверхностное натяжение есть величина, измеряемая энергией Гиббса, |
||||||||||||||||||||||||
альвеол − около 1000 м2, поверхность скелета — около 2 тыс. км2 и т. д. |
приходящейся на единицу площади поверхностного слоя. Оно численно |
||||||||||||||||||||||||
Известно, что многие жизненно важные биохимические процессы в |
равно |
работе, которую необходимо совершить против сил |
|||||||||||||||||||||||
организме протекают на поверхности биологических мембран. Поэтому для |
межмолекулярного взаимодействия для образования единицы поверхности |
||||||||||||||||||||||||
понимания их механизма необходимо знание основных закономерностей, |
раздела фаз при постоянной температуре. |
|
|
|
|
|
|
||||||||||||||||||
которым подчиняются поверхностные явления. |
|
|
|
|
С учетом (4.2) и (4.3) уравнение (4.4) принимает вид: |
|
|
|
|
|
|||||||||||||||
Поверхностный слой, возникающий на границе различных фаз, согласно |
|
|
G k V s |
|
|
|
|
(4.4) |
|
|
|||||||||||||||
Гиббсу, представляет собой промежуточную фазу толщиной в несколько |
|
|
G |
k sуд |
|
|
|
|
(4.5) |
|
|
||||||||||||||
молекулярных диаметров. |
В этом |
слое свойства сильно |
различаются от |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||
точки к |
точке. |
В |
ряде |
случаев |
поверхностный |
слой |
имеет |
толщину, |
|
|
V |
|
|
|
|
|
|
|
|
|
|
||||
Из этого |
уравнения следует, что |
энергия |
Гиббса в |
расчете на |
единицу |
||||||||||||||||||||
примерно равную |
диаметру молекулы, и в этом |
случае |
его |
называют |
|||||||||||||||||||||
объема системы линейно возрастает с увеличением удельной поверхности |
|||||||||||||||||||||||||
мономолекулярным. |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
системы. При малых значениях удельной поверхности sуд можно пренебречь |
|||||||||||||||||||
Поверхностными явлениями называют процессы, происходящие на границе |
|||||||||||||||||||||||||
раздела |
фаз |
и |
обусловленные |
особенностями |
состава |
и |
строения |
поверхностной энергией Гиббса по сравнению с общей энергией Гиббса |
|||||||||||||||||
системы. При больших значениях sуд необходимо учитывать поверхностную |
|||||||||||||||||||||||||
поверхностного (пограничного) слоя. |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
энергию Гиббса. |
|
|
|
|
|
|
|
|
|
|
|||||||||||
Все поверхности раздела в зависимости от агрегатного состояния граничных |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Молекулы, |
атомы, |
ионы, находящиеся на |
поверхности |
раздела |
фаз, |
не |
|||||||||||||||||||
фаз делят на два класса: |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
равноценны |
по |
своему положению |
тем |
же частицам, |
находящимся |
в |
|||||||||||||
1) |
подвижные поверхности раздела между жидкостью и газом (ж − г) |
||||||||||||||||||||||||
глубине фазы. |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
и двумя несмешивающимися жидкостями (ж − ж); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
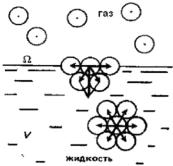
Удобно рассмотреть в качестве примера некоторую жидкость, находящуюся |
|||||||||||||||||||||
2) неподвижные поверхности раздела между твердым телом и газом (т |
|||||||||||||||||||||||||
в равновесии с |
собственным паром |
(рис. |
4.1). Молекулы, |
находящиеся |
|||||||||||||||||||||
|
− г), твердым телом и жидкостью (т − ж), твердым телом и твердым |
||||||||||||||||||||||||
|
внутри |
жидкости, |
окружены |
со |
всех |
сторон |
подобными. |
Силы, |
|||||||||||||||||
|
телом (т − т). |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
действующие на них со всех сторон, одинаковы, и равнодействующая этих |
||||||||||||||||||
Важнейшее свойство поверхностного слоя состоит в том, что находящиеся в |
|||||||||||||||||||||||||
сил Fм равна нулю. У молекул, находящихся на границе раздела фаз, силы, |
|||||||||||||||||||||||||
нем молекулы |
обладают |
избыточной энергией Гиббса (по |
сравнению с |
||||||||||||||||||||||
действующие со |
стороны жидкой |
и газообразной |
фаз, |
неодинаковы. |
|||||||||||||||||||||
молекулами внутренней части той же фазы. |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
Молекулярные |
взаимодействия |
в |
вертикальном |
направлении |
не |
||||||||||||||||
Общую энергию Гиббса G системы можно разделить на два слагаемых − |
|||||||||||||||||||||||||
уравновешены. Вследствие этого равнодействующая молекулярных сил Fм |
|||||||||||||||||||||||||
энергию Гиббса объемной фазы GV |
и поверхностную энергию Гиббса GS: |
||||||||||||||||||||||||
не равна нулю и направлена в глубь жидкой фазы. |
Следовательно, для |
||||||||||||||||||||||||
|
|
G = GV + Gs |
|
(4.1) |
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1
выведения молекул на поверхность Ω надо преодолеть эту силу, совершив работу, и сообщить таким образом молекулам определенную энергию. Если площадь поверхности увеличить на dS, то на такую же величину dGS возрастает поверхностная энергия и
dGS |
|
Дж |
или |
эрг |
|
Дн |
(4.6) |
||
|
|
|
; |
|
|
|
|
||
|
м2 |
см2 |
см |
||||||
|
dS T,P |
|
|
|
|
||||
|
Поверхностное натяжение для некоторых сред |
Таблица 4.1 |
||||||
|
|
|
||||||
|
|
на границе с воздухом при 293 К |
|
|
|
|||
|
|
Эталон |
Сыворотка |
Глицерин |
|
Вода |
Ртуть |
|
Дж/м2 |
|
крови |
|
|
||||
|
|
17,1 |
45,4 |
64,7 |
|
72,0 |
436 |
|
т.е. производная поверхностной энергии Гиббса по площади поверхности |
Анализ табл. 4.1 показывает, |
что |
поверхностное |
натяжение на |
границе |
|||||||||||||
или удельная поверхностная |
энергия и есть |
величина поверхностного |
||||||||||||||||
жидкость — газ |
возрастает |
с |
увеличением |
взаимодействия |
между |
|||||||||||||
натяжения. |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
молекулами жидкости. |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
Поверхностное натяжение жидкостей уменьшается с ростом температуры и |
|||||||||
|
|
|
|
|
|
|
|
|
вблизи критической температуры становится равным нулю (исчезает |
|||||||||
|
|
|
|
|
|
|
|
|
поверхность раздела фаз). |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
С увеличением давления поверхностное натяжение на границе жидкость − газ |
|||||||||
|
|
|
|
|
|
|
|
|
уменьшается, так как возрастает концентрация молекул в газовой фазе и сила |
|||||||||
|
|
|
|
|
|
|
|
|
Fм уменьшается. |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Растворенные вещества могут повышать, понижать и практически не влиять |
|||||||||
|
|
|
|
|
|
|
|
|
на поверхностное натяжение жидкостей. |
|
|
|||||||
Рис. 4.1. Межмолекулярные силы, действующие на молекулу |
Способность растворенных веществ изменять поверхностное натяжение |
|||||||||||||||||
растворителя называется поверхностной активностью. |
|
|||||||||||||||||
в поверхностном слое Ω и в объеме жидкости |
|
|||||||||||||||||
Мерой поверхностной активности является первая производная |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
Кроме энергетической, известна и силовая трактовка поверхностного |
поверхностного натяжения по концентрации, взятая со знаком минус: |
|||||||||||||||||
|
|
d |
|
|
|
|
|
|
||||||||||
натяжения. Исходя из модели Дюпре, поверхностное натяжение равно силе, |
g |
. |
|
|
(4.8) |
|
||||||||||||
dc |
|
|
|
|||||||||||||||
стремящейся уменьшить поверхность раздела, и отнесенной к единице |
|
|
|
|
|
|
|
|
||||||||||
длины контура, ограничивающего поверхность |
|
В узких интервалах концентраций производная может быть заменена |
||||||||||||||||
|
FS |
н |
Дж |
|
отношением конечных изменений: |
|
|
|
||||||||||
|
|
; |
|
|
|
|
. |
(4.7) |
|
|
|
|
|
|
|
|
|
|
l |
м |
|
м2 |
g |
|
|
. |
|
|
(4.9) |
|
|||||||
Оба определения эквивалентны. Заметим, что FS − сила поверхностного |
|
c |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||
натяжения − имеет ту же природу, что и результирующая Fм в предыдущей |
Поверхностное натяжение на границе раздела жидкость − жидкость зависит |
|||||||||||||||||
модели, но направлена она не перпендикулярно поверхности, а вдоль нее − |
от природы соприкасающихся фаз. Оно тем больше, тем меньше силы |
|||||||||||||||||
тангенциально. |
|
|
|
|
|
|
молекулярного взаимодействия между разнородными молекулами. |
|||||||||||
Поверхностное натяжение у различных жидкостей колеблется в |
Температура раствора и концентрация растворенных веществ оказывают |
|||||||||||||||||
значительных пределах (табл. 4.1) и зависит от природы жидкости, ее |
такое же влияние на поверхностное натяжение на границе раздела жидкость |
|||||||||||||||||
температуры, давления и концентрации растворенных веществ. |
− жидкость, как и в случае границы раздела жидкость − газ. Давление |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
практически не влияет на эту величину. |
|
|
|||||||
2

Поверхностно-активные и поверхностно-неактивные вещества
При растворении в данной жидкости какого-либо вещества наблюдают следующие случаи.
1.Растворенное вещество понижает поверхностное натяжение
растворителя ( р.р< 0). Такие вещества получили название поверхностноактивных (ПАВ), так как для них g > 0. По отношению к воде поверхностно-активными веществами являются многие органические соединения, например спирты и кислоты алифатического ряда, сложные эфиры, белки и др.
2.Растворенное вещество незначительно повышает поверхностное
натяжение растворителя ( р.р > 0). Такие вещества называют поверхностноинактивными (ПИВ). Для них g < 0. По отношению к воде поверхностноактивными веществами являются неорганические кислоты, основания, соли и такие органические соединения, как глицерин, -аминокислоты и др.
3. Растворенное вещество практически не изменяет поверхностного натяжения растворителя ( р.р = 0); поверхностно неактивными (ПНВ) по отношению к воде веществами являются сахароза и ряд других.
Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы молекулы этого вещества состояли из неполярной гидрофобной углеводородной группы («хвост») и полярной гидрофильной группы («голова»). Такие вещества называются дифильными. К полярным относятся группы:
−ОН, −СООН, −С−О, −NH2, −SO3 и др.
O
Зависимость поверхностного натяжения при постоянной температуре от концентрации растворенного вещества называют изотермой поверхностного натяжения (риc.4.2):
С ростом концентрации ПАВ поверхностная активность понижается. Она имеет наибольшее значение в области малых концентраций и наименьшее значение в области больших концентраций.
Поверхностная активность так же зависит от природы поверхностноактивного вещества. Согласно правилу Дюкло − Траубе: поверхностная активность вещества одного и того же гомологического ряда возрастает приблизительно в 3 раза при увеличении углеводородной цепи на одну метиленовую группу −СН2−:
|
gn 1 |
3 3,5 |
(4.10) |
|
gn |
||||
|
|
|
где n − количество метиленовых групп.
Правило хорошо иллюстрируется семейством кривых, изображенных на рис. 4.3. В ряде случаев биологическая активность (например, наркотическое действие, бактерицидность и др.) веществ одного и того же гомологического ряда возрастает с увеличением их поверхностной активности, т. е. в соответствии с правилом Траубе.
3

|
|
|
перераспределением растворенного вещества между объемом фазы и |
||||||
|
σ, Дн/см |
|
поверхностным (пограничным) слоем. |
|
|
||||
|
σ0, Дн/см |
|
|
|
|
|
|
|
|
|
|
1. НСООН |
|
|
|
|
|
|
|
|
|
2. СН3СООН |
|
|
|
|
|
|
|
|
|
3. СН3СН2СООН |
|
|
|
|
|
|
|
|
|
4.СН3СН2СН2СООН |
|
|
|
|
|
|
|
|
|
С, моль/л |
|
|
а |
|
б |
в |
|
Рис. 4.3. Семейство изотерм поверхностного натяжения для |
Рис. 4.4. Возможные случаи распределения растворенного вещества |
||||||||
|
гомологического ряда жирных кислот |
|
между поверхностным слоем и объемом фазы |
|
|||||
Это правило выполняется лишь для водных растворов ПАВ. Для растворов |
Теоретически можно представить три случая распределения растворенного |
||||||||
ПАВ в неполярных растворителях поверхностная активность при |
вещества между граничным слоем и объемом фазы (рис. 4.4, а, б, в). |
||||||||
увеличении |
длины углеводородного |
радикала, наоборот, уменьшается |
1) концентрация растворенного вещества в поверхностном слое (c ) |
||||||
(обращение правила Дюкло-Траубе). |
|
больше, чем в объеме фазы (сV)', |
|
|
|||||
|
|
|
2) концентрация растворенного вещества в поверхностном слое меньше, |
||||||
|
|
|
чем в объеме фазы; |
|
|
|
|
||
|
|
|
3) концентрация растворенного вещества в поверхностном слое такая же, |
||||||
|
Адсорбция на границе раздела жидкость − газ. |
как и в объеме фазы. |
|
|
|
|
|||
Любая система в соответствии со вторым началом термодинамики |
ПАВ накапливаются в поверхностном слое (c > cV). При этом система |
||||||||
стремится самопроизвольно перейти в такое состояние, в котором она |
уменьшает запас поверхностной энергии Гиббса, ПИВ накапливаются в объеме |
||||||||
обладает минимальным запасом энергии Гиббса (Gs = ·s). Следовательно, |
фазы (c < cV), так как в этом случае запас поверхностной энергии Гиббса |
||||||||
она стремится к минимуму поверхностной энергии Гиббса (Gs Gмин). |
уменьшается. |
|
|
|
|
|
|
||
Поверхностное натяжение при прочих равных условиях определяется |
У веществ, не влияющих на поверхностное натяжение растворителя, |
||||||||
природой вещества. Поэтому система, образованная одним компонентом ( |
концентрации в поверхностном слое и в объеме фазы будут одинаковы c = |
||||||||
= const), может понизить запас своей поверхностной энергии Гиббса в |
cV, так как перераспределение вещества не меняет поверхностное |
||||||||
данных условиях только одним путем − принять форму, при которой |
натяжение. |
|
|
|
|
|
|
||
поверхность раздела фаз минимальна (s sмин). Из разных форм |
Самопроизвольное изменение концентрации растворенного вещества на |
||||||||
одинаковой массы и вещества минимальной поверхностью обладает сфера. |
границе раздела фаз называется адсорбцией. Вещество, на поверхности |
||||||||
Этим, в частности, объясняется сферическая форма падающих капелек |
которого |
происходит |
адсорбция, |
называется |
адсорбентом, |
||||
жидкости (дождя). |
|
адсорбирующееся вещество − адсорбатом или адсортивом. Измеряется |
|||||||
Система, состоящая больше чем из одного компонента, помимо уменьшения |
адсорбция (Г) в моль/см2 или моль/м2. Ее можно вычислить по уравнению: |
||||||||
поверхности, |
может понизить |
поверхностную энергию Гиббса |
|
Γ |
c cV Vs |
, |
(4.13) |
|
|
|
|
|
|||||||
s
4
где Vs |
− объем поверхностного слоя. |
|
|
|
|
|
|
При очень малых равновесных концентрациях адсорбция пропорциональна |
|||||||||||||||||||||||||||||
Адсорбция ПАВ положительна Г > 0, поскольку c > cV. Адсорбция ПНВ |
концентрации, что находит выражение в прямолинейном ходе изотермы |
||||||||||||||||||||||||||||||||||||
отрицательна Г 0, так как c cV. Для веществ, не влияющих на величину |
адсорбции (участок 1). С дальнейшим ростом концентрации рост адсорбции |
||||||||||||||||||||||||||||||||||||
поверхностного натяжения, Г = 0, здесь c = cV. |
|
замедляется и этот участок изотермы изображается параболической кривой |
|||||||||||||||||||||||||||||||||||
Адсорбция вещества A представляет собой обратимый по направлению |
(участок 2). При больших концентрациях адсорбция достигает предельного |
||||||||||||||||||||||||||||||||||||
процесс, заканчивающийся установлением адсорбционного равновесия. При |
значения (Г ), которое не изменяется с дальнейшим увеличением |
||||||||||||||||||||||||||||||||||||
равновесии скорость адсорбции равна скорости обратного процесса − |
концентрации растворенного вещества (участок 3). Графически этот участок |
||||||||||||||||||||||||||||||||||||
десорбции: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
изображается горизонтальной прямой. |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
десорбция |
|
Помимо концентрации растворенного вещества, адсорбция зависит от |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
A(s) |
|
|
|
|
|
|
|
A(V) |
|
природы вещества и температуры. Для веществ одного и того же |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
адсорбция |
|
гомологического ряда адсорбция изменяется в соответствии с правилом |
||||||||||||||||||||
Зависимость адсорбции от равновесной концентрации растворенного |
Дюкло − Траубе. С ростом температуры адсорбция уменьшается. |
|
|||||||||||||||||||||||||||||||||||
вещества при постоянной температуре называют изотермой адсорбции. |
Для описания экспериментально наблюдаемой изотермы предложено более |
||||||||||||||||||||||||||||||||||||
Адсорбцию на границе раздела жидкость − газ непосредственно не |
20 уравнений. Из них наиболее часто в медико-биологических |
||||||||||||||||||||||||||||||||||||
измеряют, а вычисляют с помощью уравнения Гиббса, которое выведено |
исследованиях используют изотермы Фрейндлиха и Лэнгмюра. Однако, в |
||||||||||||||||||||||||||||||||||||
на основании 2-го начала термодинамики: |
|
этом случае, оценка процесса адсорбции происходит по абсолютному |
|||||||||||||||||||||||||||||||||||
|
Γ |
|
C |
|
d |
, |
|
|
|
|
|
|
|
|
(4.14) |
количеству адсорбированного вещества, выраженного в молях или граммах |
|||||||||||||||||||||
|
|
|
|
R T |
|
|
dC |
|
|
|
|
|
|
адсорбента на поверхности адсорбата. |
|
|
|
|
|
||||||||||||||||||
где Г − количество адсорбированного вещества, моль/м2; С − молярная |
1. Изотерма Фрейндлиха: |
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
концентрация растворенного вещества, |
моль/дм3; R − |
газовая постоянная, |
|
|
Г = КФ·Сn, |
|
|
|
|
(4.15) |
|
|
|||||||||||||||||||||||||
равная 8,32 Дж/(моль К); |
|
|
d |
|
− поверхностная активность. |
где Кф − константа, численно равная адсорбции при равновесной |
|||||||||||||||||||||||||||||||
|
|
концентрации, |
равной |
единице; |
п − константа, |
определяющая |
кривизну |
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
dС |
|
|
|
|
|
|
изотермы адсорбции, ее значение колеблется в пределах от 0,1 до 0,6. |
||||||||||||||||||||
Таким |
образом, |
|
для |
|
|
нахождения |
|
адсорбции |
необходимо знать |
||||||||||||||||||||||||||||
|
|
|
|
Изотерма |
Фрейндлиха |
представляет |
собой |
уравнение параболической |
|||||||||||||||||||||||||||||
поверхностную активность при данной концентрации и температуре. |
|||||||||||||||||||||||||||||||||||||
кривой. |
Оно |
применимо |
лишь |
при |
средних |
значениях |
равновесных |
||||||||||||||||||||||||||||||
График типичной экспериментальной изотермы представлен на рис. 4.5. |
|||||||||||||||||||||||||||||||||||||
концентраций |
адсорбата. |
Для |
нахождения |
постоянных |
в |
уравнении |
|||||||||||||||||||||||||||||||
|
Г |
1 |
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
Фрейндлиха его логарифмированием приводят к уравнению прямой: |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lgГ = lgКф + п·lgС. |
|
|
|
(4.16) |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отрезок ординаты от начала осей координат до ее пересечения с прямой |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Г∞ |
|
численно равен lgКф, а тангенс угла |
наклона прямой численно равен п |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(рис. 4.6а). |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. Изотерма Лэнгмюра: |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Г |
Г b c |
|
|
|
|
(4.17) |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 b c |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С, моль/л |
где Г − емкость монослоя − константа, равная предельной адсорбции, |
|||||||||||||
Рис. 4.5. Изотерма адсорбции ПАВ на границе раздела раствор - газ |
наблюдаемой при относительно больших равновесных концентрациях |
||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
адсорбата на энергетически однородной поверхности адсорбента (например, |
||||||||||||
5

сита), моль/м2; b − константа, равная отношению константы скорости |
|
P0 |
|
|
0 |
|
или |
0 |
P |
|
(4.19) |
||
адсорбции и константе скорости десорбции. |
|
|
|
|
|
||||||||
|
|
|
|
P0 |
|||||||||
В отличие от уравнения Фрейндлиха уравнение Лэнгмюра описывает ход |
|
P |
|
|
|
||||||||
где 0 и − поверхностные натяжения двух разных жидкостей, а Р0 и Р − |
|||||||||||||
экспериментальной изотермы при всех возможных значениях равновесных |
|||||||||||||
концентраций растворенного вещества при определенных допущениях, |
соответствующие им избытки давления над внешним давлением при |
||||||||||||
характеризующих процесс адсорбции соответствующей модели. |
проскоке пузырька. |
|
|
|
|
|
|||||||
При малых концентрациях, когда с << 1, уравнение (4.17) приобретает вид |
Прибор для определения поверхностного натяжения показан на рис. 4.8. |
||||||||||||
Γ Γ b c . |
|
Трубка 1, вставленная через пробку в пробирку с исследуемой жидкостью, |
|||||||||||
Такая зависимость является уравнением прямой, проходящей через начало |
оканчивается капилляром К, который погружается в жидкость не более чем |
||||||||||||
на 1 мм. Пробирка 2 имеет нижнюю трубку с зажимом 7 и боковую трубку, |
|||||||||||||
осей координат. При бóльших концентрациях, когда с >> 1, уравнение (4.17) |
|||||||||||||
соединяющую ее с манометром 3 и аспиратором 4. Манометр 3 заполнен |
|||||||||||||
принимает вид: |
|
||||||||||||
|
водой. |
|
|
|
|
|
|
|
|
||||
. Г = Г . |
(4.18) |
|
|
|
|
|
|
|
|
||||
Выпуская воду из аспиратора 4 через зажим 5 в стакан 6, уменьшают |
|||||||||||||
|
|
||||||||||||
|
|
давление над поверхностью исследуемой жидкости по сравнению с |
|||||||||||
Измерение поверхностного натяжения жидкостей |
атмосферным. Это |
вызывает |
продавливание воздуха |
через трубку 1, |
|||||||||
который в виду пузырьков выходит из конца капилляра К, опущенного в |
|||||||||||||
по методу Ребиндера. |
|
||||||||||||
|
жидкость. Скорость образования пузырьков регулируют зажимом 5. |
||||||||||||
Принцип метода заключается в следующем: если через капилляр радиуса r, |
|||||||||||||
погруженный в исследуемую жидкость, сверху подавать воздух, то давление в капилляре постепенно увеличивается до тех пор, пока пузырек воздуха, образующийся у конца трубки, не примет форму полусферы (см. рис. 4.7). После этого для отрыва пузырька уже не требуется дальнейшего увеличения давления. Сила, способствующая образованию пузырька, пропорциональна давлению, а сила, препятствующая его образованию, пропорциональна поверхностному натяжению.
Рис. 4.8. Прибор для определения поверхностного натяжения
Определение поверхностного натяжения производится методом сравнения и рассчитывается по формуле (4.19). В качестве жидкости с известным поверхностным натяжением берется дистиллированная вода. Зависимость поверхностного натяжения воды от температуры приведена в табл. 4.2.
Рис. 4.7. Образование пузырька в капилляре Таблица 4.2 Поверхностное натяжение воды при различных температурах
Пусть Р − избыток давления в пузырьке над внешним давлением в момент |
Температура, 0С |
Поверхностное |
отрыва пузырька. Для капилляра данного радиуса этот избыток давления |
|
натяжение, дн/см |
зависит от величины поверхностного натяжения. Для двух жидкостей с |
16 |
73,34 |
различными значениями поверхностного натяжения существует следующая |
17 |
73,20 |
зависимость: |
18 |
73,05 |
6

19 |
72,90 |
20 |
72,75 |
21 |
72,59 |
22 |
72,44 |
13 |
72,28 |
24 |
72,13 |
Расчет адсорбции на границе раздела водный раствор − воздух.
Величина адсорбции может быть рассчитана по уравнению (4.14):
Γ |
C |
|
d |
|
R T |
dC |
|||
|
|
|||
Здесь: R = 8,31 107 эрг моль-1 град-1; |
|
|
||
Т = 273,1 + t0 C; |
|
|
||
С − объемная концентрация в моль л-1.
Для нахождения величин (d /dC) по экспериментальным данным строится график зависимости поверхностного натяжения от концентрации, как показано на рис. 4.9. Величина (d /dC), приблизительно равная ( / C), находится графически.
Рис4.9. Изотермаповерхностногонатяжения.
Для этого берут, например, концентрацию 0,1 М. По графику 4.9 находят, что ей соответствует поверхностное натяжение 1. Затем выбирают немного большую концентрацию, допустим, 0,11 М, которой по графику соответствует другое значение 1, и, наконец, берут меньшую
концентрацию, например, равную 0,09 М, которой соответствует поверхностное натяжение 1" . Разность концентраций составит:
c= 0,11 – 0,09 = 0,02 М.
Соответствующая разность поверхностных натяжений C 1' 1" . Таким образом, для концентрации 0,1 М, лежащей посредине интервала C , поверхностная активность будет равна:
1' 1"
C 0,02
Точно также можно рассчитать поверхностную активность и для растворов других концентраций. В данном случае все они будут иметь отрицательное значение.
Подставляя найденные для разных концентраций значения в уравнение Гиббса (4.14), находят величины адсорбции, соответствующие этим концентрациям.
Лабораторная работа № 4
Изучение адсорбции поверхностно-активного вещества на границе водный раствор − воздух,
исследование поверхностной активности ПАВ одного гомологического ряда.
I. Изучение адсорбции поверхностно-активного вещества на границе водный раствор − воздух.
Цель работы: По результатам определения поверхностного натяжения растворов ПАВ построить изотерму адсорбции ПАВ на поверхности воды. Оборудование: Прибор для определения поверхностного натяжения, два химических стаканчика, штатив.
Реактивы: Поверхностно-активное вещество, дистиллированная вода, фильтровальная бумага.
Порядок работы:
1. Получить у лаборанта прибор для определения поверхностного натяжения. Проверить, достаточно ли плотно закрываются пробками пробирка 2 и аспиратор 4, а также, хорошо ли заполнен манометр (уровень
7
воды в нем должен составлять примерно половину от его высоты, и в воде |
поверхностные натяжения которых надо определить, указаны в табл. 4.3. |
|||||||||||||||||||||||
не должно быть пузырьков воздуха). |
|
|
|
|
|
Измерения начинать с наиболее разбавленного раствора и закончить наиболее |
||||||||||||||||||
2. Закрепит прибор в штативе и тщательно промыть пробирку 2 и трубку 1 |
концентрированным. Тогда изменение концентрации раствора за счет |
|||||||||||||||||||||||
дистиллированной водой. |
|
|
|
|
|
|
|
оставшихся в растворе капель жидкости будет минимальным. При переходе к |
||||||||||||||||
3. |
С помощью воронки залить дистиллированную воду в аспиратор 4 и |
новому раствору капилляр и пробирку несколько раз промыть этим |
||||||||||||||||||||||
плотно закрыть его пробкой. |
|
|
|
|
|
|
|
раствором. Результаты измерений записать в табл. 4.3. |
||||||||||||||||
4. В чистую пробирку 2 налить дистиллированной воды и плотно закрыть |
7. Подставляя в формулу (4.14) вместо Р0 и 0 , соответственно, давление, |
|||||||||||||||||||||||
пробирку со вставленной в нее трубкой с капилляром. При этом конец |
полученное для воды, и поверхностное натяжение воды, а вместо Р − |
|||||||||||||||||||||||
капилляра должен быть погружен в воду на небольшую глубину (около 1 |
давление для данного раствора, определить поверхностные натяжения |
|||||||||||||||||||||||
мм). |
|
|
|
|
|
|
|
|
|
|
|
|
растворов ПАВ и записать их значения в табл. 4.3. |
|||||||||||
5. При медленном нагревании воды из аспиратора 4 через зажим 5 |
||||||||||||||||||||||||
8. Построить изотерму поверхностного натяжения − график зависимости σ |
||||||||||||||||||||||||
убедиться в том, что на конце капилляра образуются пузырьки воздуха, |
раствора от его концентрации, как показано на рис. 4.8. Причем, по оси σ |
|||||||||||||||||||||||
которые проскакивают через жидкость в пробирке 2. При этом разность Р |
отсчёт производится не от нуля, а от наименьшего круглого значения σ по |
|||||||||||||||||||||||
между атмосферным давлением и давлением внутри прибора максимальна. |
экспериментальным данным таблицы 4.3. При этом Δσ = 10 эрг/см2 может |
|||||||||||||||||||||||
Определить максимальный h1 и h2 |
уровень воды в коленах манометра при |
соответствовать 3÷5 см, а |
С = 0,1 М − 4÷5 см. |
|||||||||||||||||||||
проскоке пузырьков через жидкость. Эти измерения провести не менее трех |
||||||||||||||||||||||||
9. Из изотермы поверхностного натяжения рассчитать величины |
||||||||||||||||||||||||
раз и записать их в табл. 4.3. Из этих данных найти средние значения h1 и h2 |
||||||||||||||||||||||||
поверхностных |
активностей ( / C) |
(рис. 4.8) для пяти указанных в |
||||||||||||||||||||||
и максимальную разность давлений Р по формуле: |
|
|
|
таблице концентраций и записать полученные значения в табл. 4.4. |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
P h1 h2 , мм вод.ст. |
|
|
|
|||||||||||||||||
|
|
|
|
|
Таблица 4.3 |
10. Рассчитать |
величины |
адсорбции |
ПАВ в зависимости от его |
|||||||||||||||
t = |
°С |
|
|
|
|
|
|
|
|
|
концентрации в растворе по формуле (4.14), используя значения ( / C), |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
записать результаты расчета в табл. 4.4 и построить изотерму адсорбции |
|||||||||||||
|
Концентрация |
h1, мм |
|
h2, мм |
|
Р, |
|
σ, дн/см |
|
ПАВ на поверхности воды. Для этого на оси абсцисс отложить |
||||||||||||||
|
ПАВ, моль л–1 |
|
|
мм вод.ст. |
|
|
концентрацию раствора С, а на оси ординат − адсорбцию Г. |
|||||||||||||||||
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 4.4. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
0,05 |
|
|
|
|
|
|
|
|
|
|
|
|
С, моль/л |
|
|
Г, моль/см2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
|||||||||||
|
0,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,05 |
|
|
|
|
|
|
|
|||
|
0,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
|||
|
0,3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,3 |
|
|
|
|
|
|
|
|
|
0,5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,4 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
6. |
Через нижнюю трубку вылить воду из пробирки 2, |
выдуть воду из |
|
|
0,5 |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
капилляра К и осушить его с помощью фильтрованной бумаги. Промыть |
|
Вопросы и упражнения к лабораторной работе № 4 (I) |
||||||||||||||||||||||
пробирку 2 и капилляр К исследуемым раствором, затем налить его в |
|
|||||||||||||||||||||||
1. Причины возникновения адсорбции. Определение адсорбата, адсорбента и |
||||||||||||||||||||||||
пробирку |
2 и |
измерить давление |
Р, при |
котором отрывается пузырек |
||||||||||||||||||||
воздуха, |
как |
это |
делалось для |
воды. Концентрация растворов ПАВ, |
изотермы адсорбции. |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
8
2. |
Физические и химические силы, вызывающие адсорбцию. |
9 м – 10-5 м, и непрерывной дисперсионной среды, в которой распределены |
||||||||
3. |
В чём отличие физической адсорбции от химической? |
эти частицы. |
|
|
|
|
||||
4. |
Теория адсорбции Лэнгмюра. Теория адсорбции БЭТ. Ихразличия. |
Раздробленность дисперсной фазы характеризуется степенью дисперсности |
||||||||
5. |
Адсорбция по Гиббсу. Определение поверхностного натяжения на границе |
δ, которая является величиной, обратной среднему диаметру (м-1): |
||||||||
двух фаз. Его роль в определении адсорбции. Какова его размерность? Как |
|
1 |
|
(5.1) |
|
|||||
зависит поверхностное натяжение оттемпературы? |
d |
|
||||||||
|
|
|
|
|
|
|||||
6. |
Уравнение Гиббса для адсорбции. Поясните значение входящих в него |
Удельная поверхность – это отношение общей площади поверхности |
||||||||
величин. |
дисперсной фазы Sд.ф. к её общему объёму или к её массе: |
|
||||||||
7. |
ПАВ, ПИВ, ПНВ. Какие вещества входят в каждую категорию? Объяснить |
Sóä.,V |
Sä.ô . |
, м-1 |
или Sóä.,m |
Sä.ô . |
, м2/г |
(5.2) |
||
расположение молекул на поверхности воды для каждой группы веществ. |
||||||||||
Графики поверхностного натяжения и адсорбции. |
|
Vä.ô . |
|
mä.ô . |
|
|||||
8. |
Что принято считать мерой поверхностной активности? Как зависит |
Коллоидное состояние вещества имеет два основных признака – |
||||||||
поверхностная активность вещества от его молекулярной массы? |
дисперсность и гетерогенность. |
|
||||||||
Сформулируйте правило Траубе. |
Для получения коллоидных растворов необходимо: |
|
||||||||
9. |
Каким образом в приборе Ребиндера создаётся перепад давления? Почему |
1) достичь коллоидной степени дисперсности; |
|
|||||||
нельзя допускать попадания жидкости в соединительные трубки прибора? |
2) подобрать дисперсионную среду, в которой нерастворимо вещество |
|||||||||
10. |
Почему в приборе Ребиндера капилляр должен только касаться |
дисперсный фазы; |
|
|
|
|
||||
поверхности исследуемой жидкости, а не быть погружённым в неё? Почему |
3) подобрать третий компонент – стабилизатор, сообщающий |
|||||||||
определение поверхностного натяжения исследуемых растворов проводят в |
коллоидной системе устойчивость. В качестве стабилизаторов |
|||||||||
порядке возрастания концентраций? |
используют вещества, препятствующие агрегации (слипанию) |
|||||||||
11. |
Указать, какие из перечисленных ниже веществ уменьшают, какие |
коллоидных частиц |
в более крупные и выпадению |
их в осадок |
||||||
увеличивают, а какие не изменяют поверхностное натяжение воды: C3H7OH, |
(небольшой избыток одного из реагентов, из которых получается |
|||||||||
KOH, C6H12O6(фруктоза), NaCl, H2SO4, CH3COONa, Na2SO4, HCOOH, |
вещество дисперсной фазы; ПАВ; белки; полисахариды). |
|||||||||
C6H12O6(глюкоза). |
В основе классификаций лежат различные свойства дисперсных систем: |
|||||||||
12.Приведите два способа уменьшения поверхностного натяжения воды. размер частиц дисперсной фазы, агрегатное состояние дисперсной фазы и
13.Представьте на одном графике изотермы адсорбции масляной, уксусной и дисперсионной среды, характер взаимодействия дисперсной фазы с
пропионовой кислотиз водныхрастворов.
V. КОЛЛОИДНЫЕ СИСТЕМЫ
Коллоидной системой (золем) называется гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределёнными в объёме другой однородной фазы. Это ультрамикрогетерогенные системы, состоящие из частиц дисперсной фазы – совокупности раздробленных частиц, размер которых лежит в пределах 10-
дисперсионной средой, структурно-механические и др. свойства.
Таблица 5.1.
Классификация по агрегатному состоянию фаз.
Агрегатное состояние дисперсной фазы |
Агрегатное состояние дисперсионно средый |
Условное обозначение, /фс |
Название |
Примеры |
|
|
|
||
|
|
|
системы |
|
|
|
|
|
|
|
|
|
|
|
ж |
г |
ж/г |
аэрозоли |
Туман, слоистые облака |
9
тв |
|
г |
|
тв/г |
|
Дымы, пыли, перистые |
а) механическое измельчение с использованием шаровых и коллоидных |
|
|
|
|
облака |
мельниц; |
||||
|
|
|
|
|
|
|||
|
|
|
|
|
газовые |
Газированная вода, |
б) электрическое распыление веществ – используют для получения золей |
|
|
|
|
|
|
мыльная пена, лечебный |
металлов; |
||
г |
|
ж |
|
г/ж |
эмульсии, |
|||
|
|
кислородный коктейль, |
в) диспергирование ультразвуком – используют для получения золей из |
|||||
|
|
|
|
|
пены |
|||
|
|
|
|
|
пивная пена |
двух несмешивающихся жидкостей. |
||
|
|
|
|
|
|
|||
ж |
|
ж |
|
ж/ж |
эмульсии |
Молоко, масло сливочное, |
Чтобы не дать образовавшимся частицам слипаться, все выше описанные |
|
|
|
маргарин, кремы и т.д. |
способы диспергирования проводят в присутствии дисперсионной среды и |
|||||
|
|
|
|
|
|
|||
|
|
|
|
|
лиозоли, |
Естественные водоёмы, |
стабилизатора. |
|
тв |
|
ж |
|
тв/ж |
краски, красители для |
1.2) |
Химическое диспергирование (пептизация): перевод в коллоидное |
|
|
|
суспензии |
||||||
|
|
|
|
|
ткани |
состояние свежеприготовленного осадка с помощью пептизатора. |
||
|
|
|
|
|
|
|||
|
|
|
|
|
|
Пемза, твёрдые пены, |
2. Методы конденсации. |
|
|
|
|
|
|
|
пенопласт, |
Методы конденсации связаны с выделением новой фазы из гомогенной |
|
г |
|
тв |
|
г/тв |
твёрдые пены |
активированный уголь, |
системы. |
|
|
|
|
|
|
|
пенобетон, хлеб, пористые |
2.1) Физическая конденсация: |
|
|
|
|
|
|
|
тела в газе |
а) метод замены растворителя; |
|
|
|
|
|
|
|
|
б) метод конденсации из паров. |
|
|
|
|
|
|
|
Вода в парафине, |
||
ж |
|
тв |
|
ж/тв |
твёрдые |
природные минералы с |
2.2) Химическая конденсация: любая химическая реакция, в результате |
|
|
|
эмульсии |
жидкими включениями, |
которой образуется плохо растворимое соединение (реакция гидролиза, |
||||
|
|
|
|
|
|
древесина |
восстановления, окисления, нейтрализации и т.д.). |
|
|
|
|
|
|
|
Сталь, чугун, цветные |
|
Оптические свойства дисперсных систем. |
тв |
|
тв |
|
тв/тв |
твёрдые золи |
стёкла, драгоценные |
|
|
|
|
|
|
|
|
камни |
При падении света на дисперсную систему могут наблюдаться следующие |
|
|
|
|
|
|
|
|
явления: |
|
|
|
|
|
|
|
|
||
Дисперсной системы, у которой и дисперсная фаза и дисперсионная среда |
прохождение света частицами дисперсной фазы (наблюдается для |
|||||||
являются газами, не существует, так как газы неограничено растворимы |
прозрачных систем, в которых частицы много меньше длины волны |
|||||||
друг в друге. |
|
|
|
|
|
падающего света (r<<λ)); |
||
|
|
|
|
|
|
|
преломление света частицами дисперсной фазы (если эти частицы |
|
|
|
|
Методы получения коллоидных систем |
прозрачны); |
||||
Коллоидные системы занимают промежуточное положение между |
|
отражение света частицами дисперсной фазы (если частицы |
||||||
грубодисперсными и молекулярными системами, поэтому получать их |
непрозрачны); Преломление и отражение света наблюдается для систем, в |
|||||||
можно либо дроблением более крупных частиц (диспергированием), либо |
которых частицы много больше длины волны падающего света (r>>λ). |
|||||||
объёдинением |
молекул или |
ионов в агрегаты коллоидных размеров |
Визуально это явление выражается в мутности этих систем. |
|||||
(конденсацией) с применением физических и химических методов. |
|
рассеяние света; наблюдается для систем, в которых частицы |
||||||
1. Методы диспергирования. |
|
|
дисперсной фазы меньше, но соизмеримы с длиной волны падающего света |
|||||
1.1) Физическое диспергирование: |
|
(r ≈ 0,1 λ); |
||||||
10
