
- •Часть II
- •Часть II
- •Водород.
- •Пероксид водорода.
- •Задачи и упражнения.
- •Лабораторная работа № 2.
- •Элементы iiа группы.
- •Бериллий, магний, кальций, стронций, барий.
- •Опыт 1. Получение гидроксида бериллия.
- •Задачи и упражнения.
- •Лабораторная работа № 3. Элементы iiiа группы. Бор, алюминий.
- •Задачи и упражнения.
- •Лабораторная работа № 4. Элементы iva группы. Углерод, кремний.
- •Германий, олово, свинец.
- •Лабораторная работа № 5. Элемент V a группы азот. Водородные соединения азота.
- •Задачи и упражнения.
- •Лабораторная работа № 6. Элемент va группы. Азот. Кислородные соединения азота.
- •Задачи и упражнения.
- •Лабораторная работа № 7 элемент V a группы. Фосфор.
- •Опыт 4. Получение метафосфорной кислоты и свойства ее солей.
- •Задачи и упражнения.
- •Лабораторная работа № 8 элементы V a группы. Мышьяк, сурьма, висмут.
- •Задачи и упражнения.
- •Лабораторная работа № 9. Элементы VI a группы. Кислород, сера, селен, теллур.
- •Задачи и упражнения.
- •Лабораторная работа № 10.
- •Элементы VII a группы.
- •Галогены.
- •Получение и свойства галогенов.
- •Получение и свойства галогеноводородов.
- •Свойства кислородных соединений галогенов
- •Задачи и упражнения.
- •Положение о курсовых работах по курсу «неорганическая химия» для специальности «химия».
- •I. Общие положения.
- •II. Составление обзора литературы.
- •III. Выполнение экпериментальной части.
- •IV. Оформление курсовой работы.
- •Содержание.
А.К. Молодкин, Н.Я. Есина
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
(s и p элементы)
Часть II
Москва
Издательство Российского университета дружбы народов
2007
А.К. Молодкин, Н.Я. Есина.
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
(s и p элементы)
Часть II
Для студентов I курса направления «Химия»
Москва
Издательство Российского университета дружбы народов
2007
У т в е р ж д е н о
РИС Ученого совета
Российского университета
дружбы народов
Молодкин А.К., Есина Н.Я.
Лабораторный практикум по неорганической химии. Часть II. М.: Изд-во РУДН 2007 – 68с.
Подготовлено на кафедре неорганической химии.
Для студентов I курса направления «химия»
ЛАБОРАТОРНАЯ РАБОТА № 1.
ВОДОРОД, ПЕРОКСИД ВОДОРОДА И ЭЛЕМЕНТЫ IA ГРУППЫ.
Водород.
Опыт 1. Получение водорода. Взаимодействие металла с кислотой.
Положить в пробирку несколько кусочков цинка и налить до 1/3 высоты разбавленной серной кислоты. После этого закрыть пробирку пробкой с газоотводной трубкой (рис.1) и укрепить пробирку в штативе вертикально. Наблюдать выделение газа.
И спытать
водород на чистоту. Для этого наполняют
пробирку водородом путем вытеснения
воздуха (держать вертикально вверх
дном), затем подносят к пламени спиртовки
или горелки. Если слышится резкий хлопок,
то это означает, что водород смешан с
воздухом. В этом случае нельзя поджигать
водород, так как может произойти взрыв.
Необходимо повторно испытать водород
на чистоту, добиваясь того, чтобы при
поджигании водорода в пробирке слышался
лишь легкий хлопок.
спытать
водород на чистоту. Для этого наполняют
пробирку водородом путем вытеснения
воздуха (держать вертикально вверх
дном), затем подносят к пламени спиртовки
или горелки. Если слышится резкий хлопок,
то это означает, что водород смешан с
воздухом. В этом случае нельзя поджигать
водород, так как может произойти взрыв.
Необходимо повторно испытать водород
на чистоту, добиваясь того, чтобы при
поджигании водорода в пробирке слышался
лишь легкий хлопок.
Рис 1.
Убедившись, что из пробирки идет чистый водород, зажечь его у отверстия оттянутой трубки. Подержать над пламенем сухой стакан. Обратить внимание на капельки воды, которыми покрываются стенки стакана. Написать уравнения реакций.
Опыт 2. Взаимодействие металла со щелочью.
В пробирку прибора, описанного в опыте 1, налить раствора едкого натра и всыпать алюминиевых стружек. Наблюдать выделение газа. Закрыть пробирку пробкой с оттянутой трубкой и, убедившись в полноте вытеснения воздуха из пробирки, поджечь выделившийся газ. Написать уравнение реакции получения водорода.
Опыт 3. Восстановительные свойства водорода.
С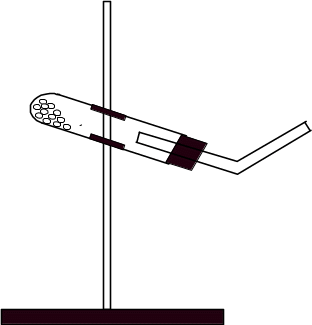 ухую
пробирку с небольшим
ухую
пробирку с небольшим
количеством
оксида меди (II)
укрепить в лапке штатива в немного
наклонном положении
так, чтобы дно пробирки было несколько
приподнято (рис. 2). После этого пропускать
водород в пробирку с оксидом меди.
Убедившись в чистоте выделившегося
из
пробирки водорода, осторожно нагреть
ту часть пробирки, где находится оксид
меди.
Наблюдать превращение черного
оксида
меди в красную медь и образование
капель
воды на стенках пробирки.
Прекратить
нагревание и дать пробирке
охладиться,
продолжая пропускать водород.
Написать
уравнение реакции.
Рис 2.
Опыт 4. Сравнение восстановительных свойств молекулярного и атомного водорода (водорода в момент выделения).
Налить в пробирку 1 мл разбавленного перманганата калия, добавить 2 мл 20%-ного раствора серной кислоты. Через подкисленный раствор перманганата калия пропустить ток водорода из аппарата Киппа.
В другую пробирку налить 1 мл разбавленного раствора перманганата калия, добавить 2 мл 20%-ного раствора серной кислоты. В подкисленный раствор перманганата калия бросить несколько кусочков цинка. Что происходит? Почему? Напишите уравнение реакции.
