
- •Содержание
- •Работа 1. Физико-химический анализ двухкомпонентной смеси.
- •Работа 3. Изучение взаимной растворимости трехкомпонентной системы
- •Свойства разбавленных растворов
- •Работа 4. Определение изотонического коэффициента I электролита в водном растворе методом криоскопии.
- •Электропроводность растворов электролитов.
- •Работа 5. Определение электропроводности и константы диссоциациислабого электролита.
- •Контрольные вопросы
- •Работа 7. Измерение эдс гальванического элемента.
- •Адсорбция
- •Работа 9. Влияние различных факторов на величину адсорбции израстворов.
- •Контрольные вопросы
- •Работа10. Изучение адсорбции поверхностно-активного вещества (пав) на границе воздух-раствор.
- •Контрольные вопросы
- •Газовая хроматография
- •Работа 13. Изучение кинетики гомогенного каталитического разложения н2о2.
- •1. Некоторые физические постоянные
- •2. Криоскопические и эбуллиоскопические постоянные некоторых растворителей
- •3. Константы диссоциации некоторых кислот
- •4. Удельная электропроводность раствора кСl (0,01 моль/л) при различных температурах, Ом-1 см-1.
- •7. Зависимость поверхностного натяжения воды от температуры.
- •8. Свойства логарифмов
- •9. Некоторые интегралы
Газовая хроматография
Хроматография широко используется в медико-биологических исследованиях и клинической практике для диагностики различных заболеваний, анализа сложных лекарственных препаратов и определения их чистоты, изучения их метаболизма в организме.
Хроматография – физико-химический метод разделения и анализа сложных смесей, при котором компоненты смеси распределяются между двумя фазами: неподвижной (с большой поверхностью контакта) и подвижной (в виде потока, фильтрующегося через неподвижный слой). Анализируемые вещества растворены в подвижной фазе. Перемещаясь вдоль неподвижной фазы, помещенной в трубку, которая называется хроматографической колонкой, они взаимодействуют с ней, в результате чего изменяется скорость их движения. Чем больше среднее "время жизни" молекул индивидуального вещества в сорбированном состоянии, тем меньше их средняя скорость движения вдоль колонки, так как движение веществ вдоль колонки происходит только с потоком газа-носителя, в то время, как в сорбированном состоянии они направленно не движутся. Вещества, слабо взаимодействующие с неподвижной фазой, вымываются быстрее. Наоборот, сильноевзаимодействие снижает скорость перемещения компонентов вдоль стационарной фазы.
Результаты хроматографического разделения смеси веществ регистрируются в виде хроматограммы, которая представляет зависимость сигнала детектора, пропорционального концентрации компонента смеси в газе-носителе от времени. Таким образом, хроматограмма показывает
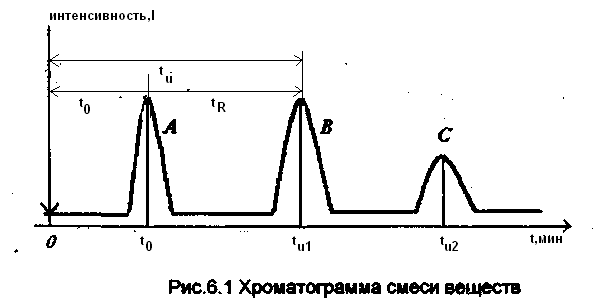
последовательность выхода компонентов и их количества, пропорциональные площади пиков. На рис.6.1 представлена хроматограмма смеси из трех веществ. Вещество А не сорбируется поверхностью стационарной фазы. Стрелкой обозначен момент впуска смеси в поток газа-носителя у входа в колонку.
Принципиальная схема газового хроматографа показана на рис.6.2. Проба анализируемого вещества подается в хроматографическую колонку 1 с помощью дозатора 2, через который пропускают газ-носитель. Обычно пробу вводят в поток газа-носителя шприцем. В колонке 1 компоненты пробы распределяются вдоль слоя сорбента, детектор 3 фиксирует концентрации выходящих из колонки компонентов в потоке газа-носителя. Сигнал детектора регистрируется самописцем 6.

Рис. 6.2. Схема газового хроматографа.
1 - хроматографическая колонка; 2 - дозатор; 3 - детектор; 4- баллон с газом-носителем; 5а - вентиль тонкой регулировки; 5б - манометр; 5в - пенометр; 6 -самописец; 7 - термостат.
Качественный и количественный анализ в газовой хроматографии
Качественный анализ
Основными характеристиками, с помощью которых можно произвести качественный анализ смеси веществ, являются время удерживания вещества tu , удерживаемый объем VR и относительный удерживаемый объем V0.
Время удерживания tu – время от момента ввода пробы до момента регистрации максимума пика на хроматограме (см. рис.6.1.). Оно складывается из времени движения вещества с газом-носителем t0 вдоль колонки и суммарного времени нахождения в сорбированном состоянии tR (исправленное время удерживания).
tu= t0 +tR (6.1)
где t0 одинаково для всех веществ смеси и определяется скоростью потока газа-носителя u0, tR при постоянных условиях опыта (температуре и скорости газа-носителя) зависит от природы анализируемого вещества и неподвижной фазы. Компоненты смеси, различающиеся по энергии взаимодействия с данной неподвижной фазой, будут иметь различные значения tR.
Удерживаемый объем VR – это объем газа-носителя, прошедшего через колонку за время удерживания tR. Его значение рассчитывают по формуле:
VR = tRw, (6.2)
где w – объемная скорость газа-носителя (объем газа-носителя, проходящий через колонку за единицу времени ). Величина VR зависит от объема неподвижной фазы в колонке Va и коэффициента распределения вещества между двумя фазами G = Ca /C ( Са и С – концентрации анализируемого вещества в неподвижной фазе и газе-носителе, соответственно), который определяется температурой и природой вещества.
VR = VaG (6.2’)
Отношение удерживаемого объема вещества VR к удерживаемому объему вещества-стандарта VRst называют относительным удерживаемым объемом V0
V0 = VR /VRst = G/Gst (6.3)
Величина V0 зависит только от природы веществ и температуры и мало зависит от изменения других параметров опыта (размеров колонки, скорости потока и др.). Таким образом, относительный удерживаемый объем является более воспроизводимой качественной характеристикой вещества по сравнению с tu, tR, VR.
Для веществ одного гомологического ряда график зависимости lg VR от числа атомов углерода в молекуле nc обычно представляет собой прямую линию (рис.6.3). Наклон прямой определяется природой анализируемых веществ и неподвижной фазы, температурой колонки.
Л инейная
зависимость lg
VR
от числа атомов в углерода н-алканов
используется для качественного анализа
веществ, принадлежащих к разным классамс помощью индексов удерживанияI(индексов Ковача). По определению,
н-алканам приписываютя значения индексов
Ковача, равные числу углеродных атомов
в молекуле, умноженному на 100. Например,
для метана I=100, для пропанаI=300,
для деканаI= 1000 и т.д. Индекс КовачаIxлюбого
другого вещества для данной неподвижной
фазы при заданной
температуре колонки имеет промежуточное
значение между значениями индексов
Ковача н-алканов (In
и In+1
) выходящих из колонки до и после этого
вещества.
инейная
зависимость lg
VR
от числа атомов в углерода н-алканов
используется для качественного анализа
веществ, принадлежащих к разным классамс помощью индексов удерживанияI(индексов Ковача). По определению,
н-алканам приписываютя значения индексов
Ковача, равные числу углеродных атомов
в молекуле, умноженному на 100. Например,
для метана I=100, для пропанаI=300,
для деканаI= 1000 и т.д. Индекс КовачаIxлюбого
другого вещества для данной неподвижной
фазы при заданной
температуре колонки имеет промежуточное
значение между значениями индексов
Ковача н-алканов (In
и In+1
) выходящих из колонки до и после этого
вещества.
Рис.6.3 а. Зависимость lgVR от числа атомов углерода в молекуле для представителей различных гомологических рядов.
Величину Ix можно определить графически (рис. 6.36). Более точные результаты получают, рассчитываяIxпо формуле:
 (6.4)
(6.4)
где VRn, VRx, VR(n+1) - удерживаемые объемы анализируемого вещества X и н-алканов с числом углеродных атомов n и n+1.
Идентификация веществ производится на основании совпадения параметра удерживания чистого вещества и этого вещества в смеси в одних и тех же условиях (колонка, температура, расход газа-носителя). Однако, какпоказано выше, менее зависят от условий опыта V0 или I, поэтому вместоtu и VR лучше использовать эти величины, причем V0 и I для предполагаемых веществ можно использовать и из литературных источников.
Количественный анализ
Площадь пика i-гo компонента Si на хроматограмме пропорциональна его количествуqiв смеси, введенной в колонку.
qi=KiSi (6.5)
где Ki- поправочный коэффициент, зависящий от природы анализируемого вещества. Коэффициент Кi, учитывает разную чувствительность детектора по отношению к компонентам анализируемой смеси, в связи, с чем вещества, присутствующие в смеси в равных количествах, дают на хроматограмме пики, отличающиеся по площади.
В том случае, если все вещества анализируемой смеси дают пики на хроматограмме, т.е. фиксируются детектором, можно рассчитать долю i-гoкомпонента смеси xi методом внутренней нормализации
![]() (6.6)
(6.6)
где суммирование производится по всем пикам. Если числитель и знаменательправой части уравнения (6.6) разделить на поправочный коэффициент одного из веществ смеси, взятого за стандарт, тоKi0=Ki/Kstназываетсяотносительным поправочным коэффициентом, и в уравнение (6.7) будут входитьKi0для всех компонентов.

![]() (6.7)
(6.7)
Величину Кi, легко определить экспериментально. Для этого составляют смесь заданного состава всех анализируемых веществ, включая истандартное вещество. Из хроматограмм такой смеси определяют площади пиков всех компонентов и рассчитывают величины К0 для всех веществ по формуле:
![]() (6.8)
(6.8)
qi/qst - соответствует отношению количеств i-гo компонента и стандарта в исходной смеси. Количества компонентов (q) могут определяться по весу или в молях, из них рассчитывают, соответственно, весовые или мольные относительные поправочные коэффициенты. С помощью весовыхкоэффициентов определяют весовые доли, а с помощью мольных - мольные доли веществ в смеси.
Работа 12. Качественный и количественный анализ смеси углеводородов с помощью газовой хроматографии на колонке с апьезоном, нанесенном на хроматон.
Цель работы.
1. Провести качественный анализ углеводородов по временам удерживания, удерживаемым объемам и индексам Ковача.
2. Определить количественный состав контрольной смеси углеводородов.
Условия опыта: Хроматограф ЛХМ-80
Сорбент - апьезон, нанесенный на хроматон.
Газ-носитель - азот.
Детектор - катарометр. Ток моста детектора 60 mА
Температура детектора 150° С.
Температура испарителя 150° С.
Температура колонки 125° С.
Порядок выполнения работы:
1. Измерить объемную скорость газа-носителя на выходе из колонки w с помощью пенометра. Для этого нажатием груши пенометра получить движущуюся пленку и измерить секундомером время t , за которое пленка пройдет заданный объём V, например, 10 мл. Для получения достаточной точности измерения время не должно быть меньше 30 сек. Измерения проводятся не менее 3 раз и усредняются. Результаты измерений записать в табл.6.1.
Величину wрассчитать по формуле
w = V /t(6.9)
Значение скорости потока должно находиться в пределах от 15 до 22 мл/мин в каждой колонке.
2. Рассчитать объёмную скорость газа-носителя в колонке при 125° С (wиспр) по формуле (6.10) с учетом того, что измерение потока газа производится при комнатной температуре.
![]() (6.10)
(6.10)
где Ткол- температура колонки,Tком- температура в комнате в градусах Кельвина.
3. Определить времена удерживания гексана, гептана, октана и нонана. Для этого микрошприцем набрать 1-2 мкл гексана так, чтобы в шприце не оставалось пузырьков воздуха. Включить тумблер "диаграмма" на самописце 6. Ввести пробу микрошприцем в колонку 1, включив секундомер в момент впуска вещества и отметив время выхода максимума пика. Аналогичные впуски повторить для гептана, октана и нонана. Результаты измерений записать в таблицу 6.2.
ВНИМАНИЕ! Работа с микрошприцем требует внимания и аккуратности. Первую пробу вводить только после объяснения лаборанта.
4. Получить хроматограмму эквимолярной смеси углеводородов С6-С9, сделав впуск 1-2 мкл смеси. По мере выхода углеводородов в порядке возрастания их молекулярных весов записывать время выхода максимумов пиков tu. Повторить опыт еще 2-3 раза. Записать полученные tu в табл.6.2.
5. Определить время удерживания несорбирующегося газа - воздуха tu,air=t0 и записать его значение в таблицу 6.2.
6. Сделать 2 впуска контрольной смеси по 1-2 мкл и записать времена выхода максимумов пиков в табл.6.3.
7. Сделать впуск неизвестного вещества, предложенного преподавателем, определить время выхода tux и записать его в таблицу 6.2.
I. Определение качественного состава смеси углеводородов
а.по совпадению времен удерживания компонентов контрольной смеси с временами удерживания углеводородов С6 –С9.
1. Сравнить времена, удерживания tu компонентов контрольной смеси (табл.6.3) с временами удерживания гексана, гептана, октана и нонана(табл.6.2). По совпадению величин tu сделать вывод о составе контрольной смеси.
б. по индексам Ковача.
2. Рассчитать для каждого компонента эквимолярной смеси исправленное время удерживания tR no формуле (6.11) и результаты записать в таблицу 6.2.
tR=tu- tu,air (6.11)
З. По формуле (6.2) рассчитать VR , lgVR и записать эти результаты в табл.6.2. Построить график зависимости Ig VR от nc. Убедиться в линейности этой зависимости.
4. Рассчитать величину VR и IgVR неизвестного вещества и результаты записать в таблицу 6.2.
5. Определить индекс Ковача IХ неизвестного вещества графически и рассчитать по формуле (6.4). Полученные результаты записать в таблицу 6.3.
6. Сравнить рассчитанные IХ со справочными данными (взять у преподавателя) и определить неизвестное вещество.
ΙΙ.Определение количественного состава контрольной смеси углеводородов в мольных процентах.
1. Определить площади пиков эквимолярной смеси методом треугольника по формуле
S=hσ(6.12)
где h- высота пика, а σ- ширина его на половине высоты. Отсчет высотпиков производится от положения базовой линии, экстраполированной в пределы записанного пика, как показано на рис.6.4. Определенные таким образом площади записать в табл.6.4.

2. Рассчитать относительные мольные поправочные коэффициенты для каждого впуска эквимолярной смеси, приняв за стандарт н-гексан по формуле
Ki 0=Sst/Si(6.13)
Записать рассчитанные Kio в табл.6.4 и найти их средние значения.
3. Определить площади пиков компонентов контрольной смеси.
4. Рассчитать мольный процент каждого компонента смеси по формуле (6.7). Результаты записать в табл.6.4.
Таблица 6.1
Определение объемной скорости газа-носителя.
|
№ |
t,сек |
t¯ ,сек |
V, мл |
w, мл/сек |
Wиспр ,мл/сек |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 6.2
Времена выхода tu и удерживаемые объемы н-алканов С6 - С9 эквимолярной смеси, неизвестного вещества и воздуха.
|
Компонент
|
№ впуска |
tu |
t¯u |
tR |
VR |
lgVR |
nc |
I |
|
|
гексан |
|
|
|
|
|
|
|
|
|
|
гептан |
|
|
|
|
|
|
|
|
|
|
октан |
|
|
|
|
|
|
|
|
|
|
нонан |
|
|
|
|
|
|
|
|
|
|
неизв. в-во |
|
|
|
|
|
|
|
|
|
|
в |
|
|
|
|
| ||||
|
|
|
|
|
|
|
| |||
Таблица 6.3
Качественный анализ неизвестных веществ по временам удерживания и индексам Ковача.
|
Контрольная смесь |
Неизвестное вещество | ||||
|
№ пика |
t u |
вещество |
Ix |
вещество | |
|
из графика |
вычисл. | ||||
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
……. |
|
|
|
|
|
Таблица 6.4
Определение количественного состава контрольной смеси.
|
вещество |
Эквимолярная смесь |
Контрольная смесь | ||||
|
№ впуска |
Si |
Ki0 |
K¯i0 |
Si |
xi | |
|
гексан |
|
|
|
|
|
|
|
гептан |
|
|
|
|
|
|
|
октан |
|
|
|
|
|
|
|
нонан |
|
|
|
|
|
|
Контрольные вопросы
Перед выполнением работы
Цель данной работы.
Нарисуйте схему газового хроматографа.
Назовите основные части хроматографической установки.
Какие параметры необходимо определить для качественного анализа смеси неизвестного состава?
Зачем делают импульсный ввод воздуха?
Как определить, какой пик хроматограммы соответствует каждому из четырех углеводородов стандартной смеси?
Что является количественной характеристикой вещества при хроматографическом анализе?
Какие параметры необходимо знать для определения количественного состава смеси веществ?
Как определить площадь пика на хроматограмме?
Как определить относительные мольные поправочные коэффициенты веществ по смеси этих веществ известного состава?
К защите работы
Как происходит разделение компонентов смеси в хроматографическом опыте?
Что является качественной характеристикой данного вещества в хроматографическом анализе?
Какие зависимости параметров удерживания наблюдаются в гомологических рядах углеводородов?
Как определить количество выходящего из колонки вещества по площади его пика на хроматограмме?
Дайте определение относительному поправочному коэффициенту.
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика изучает скорости протекания химических процессов, их зависимость от различных факторов: концентрации реагирующих веществ, температуры, давления, присутствия катализаторов.
Скоростью
химической реакции
называется изменение количества
реагирующего
вещества в единицу времени в единице
объёма. Средняя
скоростьреакции![]() равна
равна
![]() (7.1)
(7.1)
где n1 и n2 - количество молей реагирующего вещества в моменты времени t1 и t2, соответственно, V- объём системы. Если объем системы не меняется в ходе реакции, то
![]() (7.1')
(7.1')
Скорость реакции всегда положительна, поэтому знак "минус" в формуле (7.1) ставят, если скорость реакции определяют по изменению количества исходного вещества, которое расходуется в ходе процесса.
Истинной скоростью реакции v в данный момент времени называется изменение количества реагирующего вещества за бесконечно малый промежуток времени, т.е. производная концентрации С по времени t.
v = ±dC/dt(7.2)
Скорость химического процесса можно определять по любому исходному или любому конечному веществу. Если в уравнении реакции не все стехиометрические коэффициенты равны единице, то необходимо указать, по изменению концентрации какого вещества определяется скорость. Например, для реакции
nA + mB = D(7.3)
можно записать
![]()
Скорость элементарнойреакции, протекающей в одну стадию, механизм которой передается стехиометрическим уравнением,пропорциональна концентрациям исходных веществ в степенях, равных стехиометрическим коэффициентам (закон действия масс):
v= k Can Cbm (7.4)
Коэффициент k называется константой скорости реакции (или удельной скоростью реакции) и численно равен скорости реакции при концентрациях всех реагирующих веществ, равных единице. Константа скорости зависит от природы реагирующих веществ, температуры, катализатора и его концентрации, от среды, в которой протекает реакция.
Величины n и m называются частными порядками реакции по веществам А и В, соответственно. Порядок реакции в целом равен сумме порядков реакции по всем реагирующим веществам, т.е. (n + m).
Если реакция протекает в несколько стадий (сложная реакция), то соотношение (7.4) выполняется для каждой стадии.
Очень часто скорость сложных химических реакций описывается уравнением, аналогичным уравнению (7.4), однако в этом случае величины n и m не равны стехиометрическим коэффициентам. Они могут быть целыми, дробными, положительными и отрицательными.
Для характеристики элементарных реакций используют понятие молекулярности реакции, равной числу реагирующих молекул. По числу молекул, участвующих в элементарном акте химического превращения, различают реакции моно-, двух- и трехмолекулярные. Вероятность одновременного столкновения нескольких молекул определенного вида ничтожно мала, поэтому трехмолекулярные реакции немногочисленны. Реакций более высокой молекулярности неизвестно. Для элементарной реакции порядок и молекулярность совпадают.
Рассмотрим простейшие кинетические уравнения реакций первого и второго порядков.
Скорость реакций первого порядка в каждый момент времени пропорциональна концентрации реагирующего вещества:
-dC/dt = kC(7.5)
Интегрирование уравнения (7.5) дает
lnC0/ C = kt (7.6)
где С0- исходная концентрация вещества, С - концентрация вещества в момент времени t. Видно, что константа скорости имеет размерность, обратную времени (с-1), и не зависит от единиц концентрации.
Для реакций первого порядка характерна, как видно из уравнения (7.6), линейная зависимостьln Сот времениt.
Время полупревращения t1/2 , за которое прореагирует половина исходного вещества, можно определить, подставляя в уравнение (7.6) значение С = С0/2:
![]() (7.7)
(7.7)
Скорость реакций второго порядка описывается уравнением
v = kCaCb, при Са= Сb, -dC/dt=kC2(7.8)
Интегрируя это уравнение, получим
1/C-1/C0=kt (7.9)
Размерность константы скорости в этом случае зависит от единиц концентрации. Если время выражено в секундах, а концентрация - в моль/л, то размерностьк - л/моль с.
Из уравнения (7.9) видно, что для реакций второго порядка характерна линейная зависимость 1/С от времениt.
Время полупревращения в случае реакций второго порядка обратно пропорционально начальной концентрации вещества:
![]() (7.10)
(7.10)
Опыт показывает, что в подавляющем большинстве случаев скорость реакции увеличивается с ростом температуры. Обычно при повышении температуры на 10 С скорость гомогенной реакции возрастает в 2 - 4 раза (приближенное правило Вант-Гоффа). Температурный коэффициент реакции γ :
![]() (7.11)
(7.11)
Более точную зависимость константы скорости к от температуры передает эмпирическое уравнение Аррениуса
![]() (7.12)
(7.12)
где к0 - предэкспоненциальный множитель, Е- энергия активации реакции, показывающая тот необходимый избыток энергии (по сравнению со средним уровнем), которым должны обладать молекулы, чтобы реакция была возможной.
Уравнение (7.12) можно записать в логарифмической форме:
![]() (7.13)
(7.13)
Согласно этому уравнению, график зависимости lgк от 1/Т должен представлять прямую линию. Используя эту зависимость можно из экспериментальных данных определить величину к0 и энергию активации реакции Е.

 оздух
оздух
